术后早期肠内营养支持在食管癌患者中的应用
板利娟
(河南省新乡市第一人民医院心胸外科 新乡453000)
食管癌为临床常见的一种消化道肿瘤,多见于中老年群体,其发病病因与饮食习惯、环境等因素相关,临床主要表现为胸骨后疼痛、吞咽困难、哽噎感等。食管癌可对患者发声、进食等造成严重影响,导致呼吸困难,甚至损伤脑、肝等重要脏器。手术为临床治疗食管癌的重要手段,但术后消化道重建以及术后高分解代谢,会降低患者营养水平,导致较严重的营养不良[1]。本研究将早期肠内营养支持应用于食管癌术后患者中,取得显著效果。现报道如下:
1 资料与方法
1.1 一般资料 选取2017年4月~2018年9月我院收治的32例食管肿瘤患者为研究对象,随机分为观察组和对照组各16例。观察组男9例,女7例;年龄 53~74岁,平均年龄(62.42±7.48)岁。对照组男10例,女6例;年龄52~73岁,平均年龄(62.38±7.45)岁。两组患者性别、年龄等一般资料比较差异无统计学意义,P>0.05,具有可比性。所有患者均符合食管癌相关诊断标准,并自愿签署知情同意书,且本研究已经通过医院伦理委员会批准。
1.2 方法
1.2.1 对照组 行肠外营养支持:术后6 h起,给予50%葡萄糖+10%葡萄糖+20%脂肪乳+氨基酸全合一营养制剂静注,计算每日所需热量(125.5 kJ/kg),持续输注4 d,待患者肠道通气后,行胃管鼻饲流食,500 ml/d,术后第8天逐渐过渡到经口进食流质食物。
1.2.2 观察组 行早期肠内营养支持:计算患者每日所需热量(125.5 kJ/kg),予以营养液匀速滴注(遵循少量缓慢滴注的原则),之后逐渐增加营养液浓度与滴注速度。术后1~2 d予以淡盐水或温的糖盐水50 ml鼻饲,2 h/次,若患者未出现胃肠道反应,如腹痛,发热等,开始由营养科配置营养餐,200 ml/次,由营养管滴注,输液泵控制滴速50 ml/h,温度控制在38~39℃,滴注过程中密切观察患者有无腹泻、腹痛等症状出现,若无明显症状,可调至200 ml/h。同时予以短肽型制剂,每日递增500 ml,增加至1 500~2 000 ml/d,初始滴注速度为 20 ml/h,之后逐渐调至100 ml/h。术后1~3 d对能量不足的患者给予葡萄糖液、营养液行静脉补充,术后4~5 d停用营养液,给予整蛋白型制剂2 000~3 500 ml,术后第8天逐渐过渡到经口进食流质食物。
1.3 观察指标 (1)观察两组干预前后血清白蛋白、前白蛋白水平变化。(2)比较两组干预前后C反应蛋白(CRP)、白细胞介素 -6(IL-6)、肿瘤坏死因子-α(TNF-α)水平。(3)统计两组干预期间并发症发生情况。
1.4 统计学方法 数据处理采用SPSS18.0统计学软件,计量资料以(±s)表示,采用t检验,计数资料用率表示,采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组干预前后血清白蛋白、前白蛋白水平比较干预前,两组血清白蛋白、前白蛋白水平比较差异无统计学意义,P>0.05;干预后,观察组白蛋白、前白蛋白水平明显高于对照组,P<0.05,差异具有统计学意义。见表1。
表1 两组干预前后血清白蛋白、前白蛋白水平比较(±s)

表1 两组干预前后血清白蛋白、前白蛋白水平比较(±s)
?
2.2 两组干预前后 CRP、IL-6、TNF-α 水平比较干预前,两组CRP、IL-6、TNF-α水平比较差异无统计学意义,P>0.05;干预后,观察组 CRP、IL-6、TNF-α水平明显低于对照组,P<0.05,差异具有统 计学意义。见表2。
表2 两组干预前后CRP、IL-6、TNF-α 水平比较(±s)
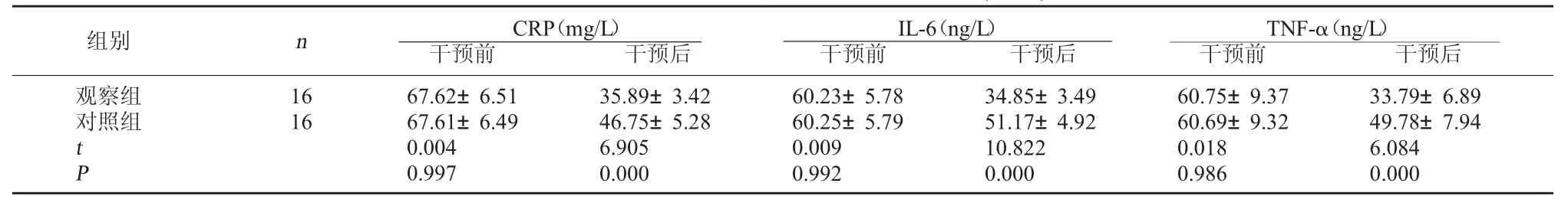
表2 两组干预前后CRP、IL-6、TNF-α 水平比较(±s)
?
2.3 两组并发症发生情况比较 观察组并发症发生率明显低于对照组,P<0.05,差异具有统计学意义。见表3。

表3 两组并发症发生情况比较[例(%)]
3 讨论
食管癌为食管鳞状上皮异常增生导致的恶性病变,近年来发病率持续增长,每年大概有30万人死于食管癌[2]。手术为治疗食管癌患者的首选方式,结合放疗、化疗等综合手段治疗效果理想,可延长患者生存时间[3]。食管癌患者因进食困难,加上肿瘤本身的消耗,因此其常伴有不同程度的营养不良,而手术后由于高代谢反应、术后禁食等因素更会加重营养不良。营养不良会导致机体免疫力低下,对患者术后恢复造成严重影响,容易增加术后并发症的风险,影响预后,降低其生存质量[4]。因此对食管癌术后患者采取合理的手段,以改善其营养状况,对提升生存质量、改善预后具有重要意义。
术后营养支持为临床辅助治疗食管癌术后患者的重要手段。食管癌患者术后需禁食1周,传统的术后营养支持方式是肠外营养支持,即在术后3~5 d予以营养液静脉输注。但由于患者胃肠道缺乏食物刺激,肠外营养支持容易引起肠黏膜萎缩,降低肠道屏障功能,使得肠道内大量滋生细菌,容易出现肠道细菌的移位,引发一系列并发症[5]。饶新辉等[6]研究认为,与肠外营养支持相比,肠内营养支持对食管癌术后患者的效果更为显著,可提升机体免疫能力,改善其营养状况,减少并发症发生。对术后存在胃肠功能障碍的患者而言,术后早期给予肠内营养支持,不仅可提供机体所需的营养底物,还可降低胰岛素抵抗、高分解代谢,阻止炎症因子释放,促进合成代谢,有效保护机体肠道黏膜屏障,避免细菌发生移位,减少并发症发生[7~8]。
血浆蛋白水平可反映机体蛋白质营养状况,利于临床评估患者病情与预测手术风险。本研究结果显示,干预前,两组血清白蛋白、前白蛋白水平比较差异无统计学意义(P>0.05);干预后,观察组白蛋白、前白蛋白水平明显高于对照组(P<0.05)。提示肠内营养支持可有效改善食管癌术后患者机体营养状况。本研究结果还显示,干预前,两组CRP、IL-6、TNF-α水平比较差异无统计学意义(P>0.05);干预后,观察组CRP、IL-6、TNF-α水平明显低于对照组(P<0.05);观察组并发症发生率明显低于对照组(P<0.05)。说明肠内营养支持可有效减轻食管癌术后患者炎症反应。分析原因为,肠内营养支持可通过改善机体肠道黏膜免疫屏障功能,抑制CRP、补体蛋白,进而起到减轻炎症反应的效果,减少术后并发症发生[9]。综上所述,对食管癌术后患者实施早期肠内营养支持的效果显著,值得临床推广。

