基于MAPK/ERK信号通路探讨电针分娩镇痛机制❋
蒋秋燕,王梦莹,王美丽,蒋桂秀,唐乾利,李妹燕△
(1. 广西中医药大学第一附属医院,南宁 530023; 2. 右江民族医学院, 广西 百色 5330001)
针刺镇痛效果明显,历史悠久,中国传统医学认为通则不痛、荣则不痛是针刺镇痛的作用机制。目前现有的研究证实,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK) 信号通路可被应激刺激激活,将胞外刺激信号转换至胞核内产生生物学效应,而脊髓背脊中的细胞外信号调节激酶(extracellularsignal-regulated protein kinase,ERK)在疼痛早期活化,参与疼痛的产生和维持[1]。本研究通过对分娩大鼠应用电针及Real-timePCR、Westernblot检测,从MAPK /ERK 信号通路探讨电针分娩镇痛作用机制,现报道如下。
1 材料与方法
1.1 实验仪器及试剂
电针仪由北京华卫公司生产的韩氏穴位神经刺激仪LH202H;针灸毫针是天津杏林书院医疗器械有限公司生产汉医牌0.17 mm × 7 mm;镇痛药物由宜昌人福药业有限责任公司生产的盐酸瑞芬太尼(批准文号国药准字H20030197)。Roche LightCycler® 480 荧光定量PCR仪,LightCycler® 480 DNA SYBR Green I Master,由生工生物工程上海(股份)有限公司设计与合成Real-time PCR引物,购于invitrogen公司的TRIzol试剂及购于ABI公司DNA Marker的定量PCR试剂ABI SybrGreen PCR Master Mix(2X),氯仿、异丙醇、无水乙醇、第一链cDNA合成试剂盒(AMV First Strand cDNA Synthesis Kit)DEPC H2O,6×DNA Loading Dye,10×TAE,(400mM Tris-acetate and 10mM EDTA,pH8.0)等试剂均购于生工生物工程(上海)股份有限公司。
1.2 动物造模及分组
通过广西中医药大学伦理委员会批准这项研究(reference no. 201302026),所有实验过程都是遵循国立健康研究院有关实验动物护理和使用指导原则(动物合格证号SCXK桂2009-0002)。性成熟未交配,3月龄健康SD大鼠,体质量(300±50)g。雌鼠140只,雄鼠20只。按雌、雄1∶1比例合笼,每日上午检查托盘,发现阴栓取出编号,并连续2 d对大鼠进行阴道脱落细胞涂片检查发现卵圆体即确定妊娠[2]。对造模成功的120例孕鼠采用随机数字表法分为瑞芬太尼组、电针三阴交加合谷组、电针夹脊穴组及空白对照组各30只。所有孕鼠在妊娠第19天开始灌服蓖麻引产餐诱发大鼠启动产程[3]。
1.3 治疗方法
1.3.1 空白对照组 自然分娩,未行任何处理。
1.3.2 电针夹脊穴组 大鼠产程启动至产下最后1个鼠仔期间,将大鼠固定在自制的木板上,在大鼠双侧L2、L4夹脊穴,相当脊柱正中旁开0.3 cm之处取穴[4], 直刺0.3寸左右,电针仪强度为0.1 mA,频率2/100HZ交替疏密波,以能引起大鼠肢体轻微抖动为针刺得气,电针20 min,每隔2 h再电针1次,左右各1组,同侧的L2、L4为1组。
1.3.3 电针三阴交加合谷组 在两前肢第一、二掌骨之间取合谷穴直刺1 mm,在两后肢内踝尖直上10 mm处取三阴交穴直刺3 mm。两穴接电针治疗仪,频率为2/100 Hz交替疏密波,强度0.1 mA,电压9 V,波宽0.2~0.6 mS,左右各1组,同侧的合谷、三阴交为1组。
1.3.4 瑞芬太尼组 孕鼠产程启动后, 尾静脉持续泵注射盐酸瑞芬太尼5 μg/kg/min,直至产下最后1个仔鼠为止[5]。
1.4 大鼠痛阈测定方法
热水甩尾痛阈测定,各组大鼠在干预措施前后分别以(50±0.5)℃热水浸烫鼠尾4 cm,记录入水至甩尾出水的间隔时间(测量3次,取其均数,时间按秒计算[6])。
1.5 标本采集方法
大鼠分娩结束后,按0.4 ml/100 g剂量10%的水合氯醛腹腔注射麻醉下断头处死,生理盐水洗干净,取大鼠大脑灰质顶叶区、脊髓腰膨大段组织及子宫肌层组织,在-80 ℃冰箱标号保存,3个月时间内完成Western blot 及Real-time PCR检测。
1.6 实验步骤
1.6.1 Western blot检测大鼠中枢ERK通路信号分子C-Raf、 ERK-1、CREB蛋白及其磷酸化水平,靶器官ERK通路效应分子Dyn蛋白表达 将大鼠大脑灰质、脊髓腰椎膨大段及子宫肌层组织总蛋白提取,称取120 mg加入预冷500 μL细胞裂解液,裂解30 min,4℃ 12000 r/min离心20 min,蛋白定量。将蛋白上样缓冲液稀释,煮4 min置-80℃ 备用。经SDS-PAGE电泳分离,至溴酚蓝刚跑出分离胶时停止电泳(250 mA,90 min)转膜, 5%脱脂奶粉封闭PVDF膜,在室温下振摇1~2 h,滴加一抗在封闭的膜内,4℃过夜。次日PBS漂洗15 min,将膜用TBST清洗4次,每次5 min,再与二抗室温下孵育1 h。TBST清洗后,将显影剂滴加到PVDF膜正面,分析目标蛋白灰度值采用凝胶图像系统。Biovision公司提供BCA蛋白浓度测定试剂盒,由CST公司提供的抗Raf、ERK、CREB,由Santa Cruz Biotechnology公司提供DYN抗体,由Thermo Fisher Scientific公司提供二抗及化学发光试剂盒,检测操作按试剂盒说明书进行。
1.6.2 Real-time PCR检测大鼠中枢ERK通路信号分子C-Raf、 ERK-1、CREB及靶器官效应分子Dyn 等mRNA表达 表1显示,根据厂家说明书用TRIzol试剂盒(Invitrogen Life Technologies,Carlsbad,California,USA)从速冻大鼠脑灰质顶叶区、脊髓腰膨大段及子宫肌层提取总RNA,将RNA逆转录为cDNA,-20 ℃保存备用。GAPDH为内参基因进行校准。ABI Step One 型荧光定量PCR仪系统检测相关基因表达量,相对基因表达量采用定量real-time PCR分析。反应条件如下:起始阶段,95 ℃,10 min;循环阶段,变性,94 ℃,15 s,退火和延伸,72 ℃,10 s。扩增反应在ABI Step One detection system进行,使用引物序列。

表1 引物序列
1.7 统计学方法
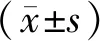
2 结果
2.1 电针对4组大鼠行为学影响
表2显示,方差分析结果显示,4组大鼠治疗前组间痛阈值比较差异无统计学意义(P>0.05);治疗后组间比较差异有统计学意义(P<0.01)。进一步LSD法多重比较显示,与空白对照组比较,药物镇痛组、电针夹脊穴组与电针三阴交加合谷组痛阈值均明显升高(P<0.01),电针三阴交加合谷组与电针夹脊穴组比较差异无统计学意义(P>0.05),痛阈值由高到低依次为药物镇痛组>电针三阴交加合谷组 /电针夹脊穴组>空白对照组。

表2 4组大鼠治疗前后痛阈值比较
注:与治疗前比较:**<0.01;与对照组比较:##P<0.01;与瑞芬太尼比较:&&P<0.01
2.2 MAPK/ERK通路信号分子mRNA在大鼠中枢及靶器官表达
表3显示,ERK通路信号分子Raf-1、ERK-1、CREB mRNA在大脑灰质组织细胞中表达组间无明显差异性,而在脊髓膨大段组织细胞中表达组间比较差异有统计学意义(P<0.01);进一步LSD多重比较显示,药物组、电针夹脊穴组与电针三阴交加合谷组均显著低于空白对照组(P<0.01),电针夹脊穴组与电针三阴交加合谷组比较差异无统计学意义(P>0.05),Raf-1、ERK-1、CREB mRNA表达依次为:空白对照组>电针三阴交加合谷组/ 电针夹脊穴组>药物镇痛组。单因素方差分析各组大鼠子宫肌层组织细胞中效应分子DYN mRNA表达,组间比较差异有统计学意义(P<0.01);LSD法两两比较显示,药物镇痛组、电针夹脊穴组与电针三阴交加合谷组DYN mRNA表达量均显著高于空白对照组(P<0.01),依次为药物镇痛组>电针三阴交加合谷组 /电针夹脊穴组>空白对照组。同样电针三阴交加合谷组与电针夹脊穴组比较差异无统计学意义(P>0.05)。

表3 ERK通路信号分子及效应分子mRNA在大鼠中枢及靶器官表达水平比较
注:与对照组比较:**P<0.01;与电针夹脊穴组比较:##P<0.01,#P<0.05;与电针三阴交加合谷组比较:&&P<0.01
2.3 MAPK/ERK通路信号分子及效应分子蛋白在大鼠中枢及靶器官表达
表4图1、2显示,Western Blot检测ERK信号分子及效应分子蛋白在大鼠中枢及靶器官蛋白灰度值结果显示,ERK通路信号分子C-Raf、ERK 1、P- ERK 1、CREB、P-CREB蛋白在大脑灰质表达组间无明显差异性, 脊髓膨大段组织细胞中组间比较差异有统计学意义(P<0.01);进一步LSD多重比较显示,药物组、电针夹脊穴组与电针三阴交加合谷组均低于空白组(P<0.01),C-Raf、ERK 1、P- ERK 1、CREB、P-CREB蛋白在组间表达依次为空白对照组>电针三阴交加合谷组/电针夹脊穴组 >药物镇痛组; 单因素方差分析各组大鼠子宫肌层组织细胞中DYN蛋白表达,组间比较差异有统计学意义(P<0.01);LSD法两两比较显示,药物镇痛组、电针夹脊穴组与电针三阴交加合谷组DYN蛋白表达均显著高于空白对照组(P<0.01),依次为药物镇痛组> 电针三阴交加合谷组/电针夹脊穴组>空白对照组,而电针三阴交加合谷组与电针夹脊穴组比较差异无统计学意义(P>0.05)。

表4 ERK通路信号分子及效应分子蛋白及其磷酸化水平在大鼠中枢及靶器官表达比较
注:与对照组比较:**P<0.01;与电针夹脊穴组比较:##P<0.01,#P<0.05;与电针三阴交加合谷组比较:&&P<0.01

图1 大鼠中枢ERK通路信号分子蛋白电泳图

图2 大鼠靶器官ERK通路效应分子DYN蛋白电泳图
3 讨论
分娩镇痛是现代文明的标志,无副作用的镇痛方法更是人们追求的目标。针灸穴位镇痛历史悠久,由于操作方法简单、镇痛效果明显,无创伤且无副作用的优势而被临床广泛应用,但其镇痛机制一直是人们研究的热点问题。随着对针刺镇痛作用机制研究的不断深入,对MAPK /ERK 信号通路,被应激刺激激活调控疼痛的发生发展越来越受到学界的关注。
MAPK 信号通路广泛存在于真核细胞内,它通过高度保守的激酶、磷酸酯酶两位点磷酸化和去磷酸化的联级反应,可以将胞外刺激信号信息传导至细胞核内产生生物学效应[8-9]。细胞外信号调节激酶(extracellularsignal-regulated protein kinase,ERK) 是 MAPK 家族依赖于 Ras途径激活的一个蛋白激酶[10],ERK 信号通路通过底物水平磷酸化而激活,属于蛋白转录后修饰过程[11]。丝/苏氨酸蛋白激酶Raf是MAPK级联反应的第一个分子,启动三级酶促级联反应即MAPKKK-MAPKK (MKK)-MAPK[12],MAPK通路中的分子开关Ras介导细胞外信号传导, Raf在活化的Ras作用下产生磷酸化而激活MEK,进而激活ERK,被激活的ERK一方面在胞浆内激活其他蛋白激酶,如RSK2或影响脊髓背角神经元膜上离子通道Kv4.2及A-typek +电流(IA),Kv4.2和IA在中枢敏化的神经元兴奋性中发挥着重要作用[13-14]。另一方面活化的ERK可从细胞浆易位到细胞核激活RSK2,使转录因子cAMP反应元件结合蛋白(CREB)在丝氨酸133上磷酸化, cAMP反应元件(CRE) DNA与磷酸化的CREB结合在一起启动区域位点,从而启动基因的转录。转位进入磷酸化转录因子CREB,调节目的基因表达,如强啡肽、内啡肽、c-fos、NK-1、神经肽Y、促生长激素及TrkB等,在痛觉敏化中发挥作用[15-16]。
强啡肽(dynorphin,DYN) 是中枢神经系统内的一个重要阿片肽,介导高强刺激镇痛,且镇痛作用部位主要在脊髓水平,脊髓水平的疼痛信息调控是在脊髓节段内完成的,不依赖于脊髓与其以上脑结构之间的完整联系[17]。课题组在前期临床中,对产妇在分娩时使用电针穴位发现能够减轻分娩疼痛并能使产妇血清中强啡肽含量增加[18]。同时又对120例SD大鼠在分娩过程中应用穴位电针并与药物镇痛组及空白组对照观察,结果显示,电针穴位可提高大鼠痛阈值,使血清dyn量升高及脊髓Pdyn、Oprk1 mRNA与蛋白表达水平升高[19]。Ji等发现,ERK的激活导致前强啡肽原mRNA和P物质受体神经激肽(NK-1)表达增加,从而增加佐剂性关节炎大鼠对热伤害刺激和机械伤害刺激的痛敏[20]。电针可能通过对ERK1/2活化的抑制, 进而抑制其下游致痛产物发挥即刻镇痛效应[21]。有文献证实,神经损伤后,ERK信号通路激活可引起下游CREB的表达增加,使用MEK抑制剂PD98059可以减少CREB的表达,从而减轻痛觉过敏现象[22]。
本实验结果显示,电针夹脊穴组及电针三阴交加合谷穴组均能有效提高分娩大鼠痛阈值,降低大鼠脊髓Raf/ERK/CREB蛋白与基因表达,并能进一步抑制 ERK-CREB通路的磷酸化与增加DYN蛋白与基因表达。电针夹脊穴组与电针三阴交加合谷组比较,2电针组间比较差异无统计学意义,提示在电针作用下,Raf/ERK/CREB蛋白表达及其磷酸化水平与DYN蛋白表达存在负反馈作用,呈负相关性关系。由此推测,电针对分娩镇痛机制可能是通过抑制大鼠脊髓Raf/ERK/CREB通路信号分子蛋白表达及降低其磷酸化水平,提高DYN蛋白表达水平实现的。本研究结果可以为电针分娩镇痛提供科学依据和理论基础。

