甘肃红芪和黄芪血清移行成分对比研究❋
许 京,叶 迎,王瑞海,苗 青,王 震,聂颖兰,刘丽梅△
(1. 中国中医科学院中医基础理论研究所,北京 100700; 2. 中国中医科学院医学实验中心,北京 100700)
红芪为豆科植物多序岩黄芪HedysarumpolybotrysHand. -Mass. 的干燥根。黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var.mongholicus(Bge.) Hsiao 或膜荚黄芪Astragalusmembranaceus(Fisch.) Bge. 的干燥根[1]。红芪在甘肃的宕昌、武都、陇西、岷县等地均广泛栽培,其产量约占全国的95%以上[2]。黄芪产于甘肃的品质好,被誉为“陇芪”[3]。作为传统中药,二者均具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、脱毒排脓、敛疮生肌的功效[1]。现代研究表明,红芪和黄芪含有一定相同或相似的黄酮和皂苷类化合物[4-5],并在抗氧化[6]、调节免疫功能[7]、保肝[8]和保护心脑血管[9]等诸多方面具有显著疗效。在历版《中华人民共和国药典》中,1977、1995年版将红芪列为正品黄芪之一,1985、2005、2010、2015年版均将二者分列。在西南、西北地区有以红芪代黄芪入药的习俗[10],但红芪和黄芪是否可以替代使用尚无系统的研究。血液作为中药成分在体内运转的枢纽,绝大多数成分借助血液分布到作用部位或受体部位,而一部分成分在血浆中与生物大分子蛋白结合进而发挥作用[11]。为深入研究其药理作用差异,可以通过入血成分的分析,检测血清中含有药材成分,推断可能发挥药效的成分[12]。目前已有黄芪血清移行成分研究的报道[13],但红芪血清移行成分、红芪和黄芪血清移行成分对比研究未见报道。因此,本文从血清移行成分入手,开展红芪、黄芪对比研究,为红芪和黄芪是否可以替代使用提供一定的科学依据。
1 仪器与试药
1.1 仪器
安捷伦6320液相-离子肼质谱联用(LC-TRAP-MS)系统,包括电喷雾离子源(ESI),自动进样器,柱温箱,数据采集与处理采用6300 Series Ion Trap LC/MS Software 6.1工作站。SatoriusBT25S电子天平,Stuart SBHCONC/1氮吹仪,Millipore Intergral 3 纯水仪,昆山KQ-500DE型超声波清洗仪,上海安亭科学仪器厂Anke TDL-5-A低速台式离心机,安亭TGL-16 GB高速离心机,Gene G560E漩涡式混匀仪。
1.2 试剂与药品
乙腈、甲酸均为色谱纯,购自迪马公司;乙酸乙酯为色谱纯,购自Fisher公司,超纯水为自制。对照品:黄芪皂苷I(批号14011302)、黄芪皂苷II(批号13062004)、异黄芪皂苷II(批号13051404)购自成都普思生物科技股份有限公司;黄芪甲苷对照品(批号H-013-140729),购自北京盛世康普化工技术研究院;熊果酸对照品(批号110742-200516),购自中国药品生物制品检定所;黄芪皂苷III(批号20160317),购自上海将来实业有限公司;大豆皂苷I(批号15121104),购自盈泽纳新化工技术研究院;毛蕊异黄酮对照品(批号13081501)、芒柄花苷对照品(批号13081501)购自成都普思生物科技股份有限公司;毛蕊异黄酮苷对照品(批号20141109),购自北京坛墨质检科技有限公司;芒柄花素对照品(批号111703-200603),购自中国食品药品检定研究院。药材:红芪、黄芪药材采于甘肃,经中国中医科学院中药研究所胡世林研究员鉴定为2015版《中华人民共和国药典》收载的正品红芪和黄芪。
1.3 实验动物
雄性SD大鼠,体质量(250±20) g,中国人民解放军军事医学科学院实验动物中心,许可证号SCXK-(军)2012-0004。
2 方法
2.1 样品制备
2.1.1 红芪和黄芪动物给药样品制备[14]取红芪和黄芪药材饮片各200 g,1000 mL 70% 乙醇回流提取2次,每次2 h,减压干燥、粉碎得提取物红芪70.51 g,黄芪63.25 g。各取红芪和黄芪药材提取物适量,加蒸馏水配制成含生药1.5 g/mL大鼠灌胃药液。
2.1.2 含药血清制备 大鼠适应性喂养数日。实验前禁食约12 h,自由饮水。取 SD 大鼠12只,随机分成红芪组和黄芪组,按30 g/kg体质量灌胃,在给药0、15、30、60、120、240、360、480、600 min时眼眶各采血0.5 mL,3500 rpm离心10 min,吸取上部血清,同组血清合并置-80 ℃冰箱保存备用。
2.1.3 供试品溶液的制备 取1 mL血清,加10 mL乙酸乙酯,涡旋5 min,12000 rpm离心10 min,吸取上清、氮吹,以0.1 mL 70% 甲醇复溶,12000 rpm离心10 min,制得血清样品。取“2.1.1”项下的灌胃药液,1: 10加入甲醇溶液,超声30 min,5000 rpm离心10 min,吸取上清液,过0.22 μm微孔滤膜,得红芪和黄芪样品。
2.1.4 对照品溶液配制 精密称取各对照品适量,分别甲醇溶解配制成1 mg/mL对照品溶液,精密量取各对照品溶液50 μL至同一5 mL容量瓶中,加甲醇稀释定容,得10 μg/mL混合对照品溶液,作为混合对照品储备液保存于4 ℃冰箱。
2.2 液相条件和质谱条件[15-16]
2.2.1 液相条件 色谱柱Dikma Leapsil C18(100×2.1 mm,2.7 μm),流动相为:A,水(含0.1%甲酸),B,乙腈(含0.1%甲酸),梯度洗脱0 min,20% B,0 ~ 5 min,20% ~ 40% B,5 ~ 15 min,40% ~ 54% B,15 ~ 20 min,54% ~ 65% B,20 ~ 30 min,65% ~ 90% B,30 ~ 31 min,90% ~ 100% B,31 ~ 33 min,100% B。流速0.4 mL/min,柱温30 ℃,进样量5 μL。
2.2.2 质谱条件 ESI 离子源,负离子检测。离子源条件为干燥器温度(Gas Temp)350 ℃,干燥气流量10 L/min,雾化器压力45 psi,毛细管电压4500 V,扫描范围100 ~ 1500 m/z。
3 结果
3.1 红芪、黄芪入血成分鉴别[17-20]
图1~3表1显示,由LC-TRAP-MS分析得到红芪及黄芪灌胃药液、空白血清、含药血清总离子流图和不同溶剂处理含药血清及混合对照品溶液提取离子流图,用工作站软件导出及一定处理。通过与标准品对照或由分子离子峰、文献报道的多级质谱碎片信息对比分析,推测出多数色谱峰的可能组成,灌胃药液中一共鉴定出成分24个,其中红芪18个,黄芪22个,二者相同成分16个,不同成分8个,由色谱峰响应值可判断二者相同成分含量不一样。
3.2 红芪及黄芪血清中移行成分分析
对比红芪、黄芪与其相应含药血清的质谱数据,大鼠口服红芪或黄芪后吸收入血成分较多,但较内源性成分的电离程度弱。本实验通过EIC模式提取含药血清中来源于红芪、黄芪中的相应成分,对比对照品和红芪、黄芪总离子流质谱指纹图的保留时间,发现吸收入血成分13个,其中红芪9个,黄芪13个, 差异4个(Kaempfrol-4’-methether-3-β-D-glucoside、Isomucronulatol-7,2'-di-O-glucoside/(3S)- mucronulatol-7-O-β-D- glucoside、黄芪甲苷、黄芪皂苷Ⅲ)。图4、5显示红芪、黄芪吸收血成分变化。红芪入血成分随时间推移呈现先增多后减少的趋势,成分个数减少较大,表明红芪入血成分种类变化较大;黄芪入血成分随时间推移有减少但相对平稳,表明黄芪入血成分种类变化较小。
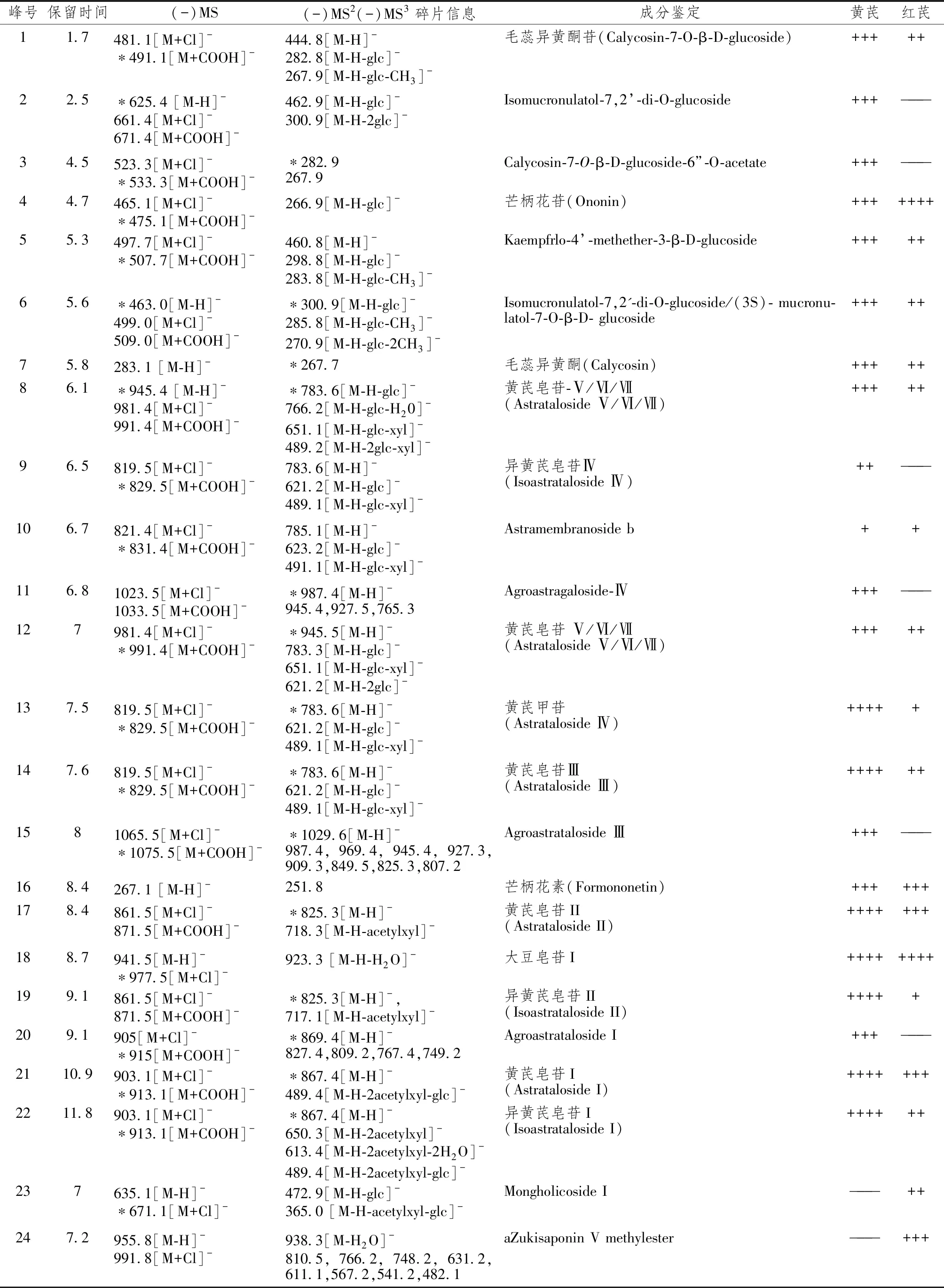
表1 红芪、黄芪灌胃药液中黄酮及皂苷类成分定性鉴别
注:*下—级质谱测试所选定的母离子,acetylxyl乙酰基木糖 xyl木糖 glc葡萄糖;——表示未检测到该成分,+表示含有少量该成分(EIC峰高响应值数量级105),++、+++和++++表示随峰高响应值数量级增加含量依次增加
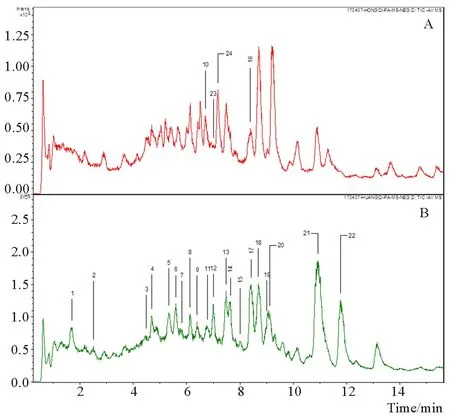
注:A. 红芪;B. 黄芪图1 灌胃药液总离子流图(TIC)
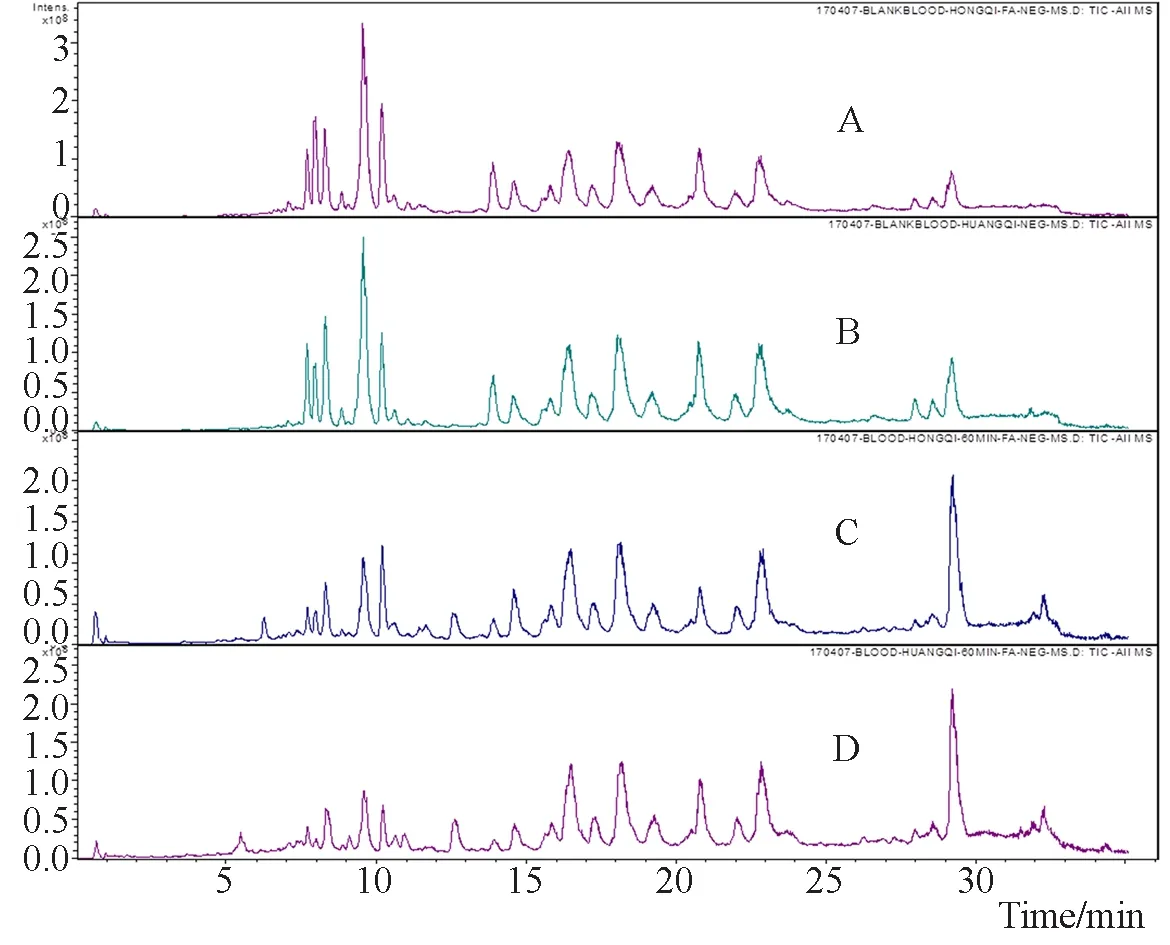
注:A. 红芪组空白血清;B. 黄芪组空白血清;C. 红芪60 min含药血清;D. 黄芪60 min含药血清图2 空白血清与含药血清总离子流图(TIC)
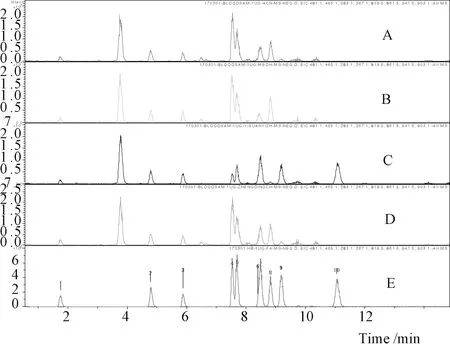
注:A. 乙腈;B. 甲醇;C. 乙酸乙酯;D. 正丁醇;E. 对照品溶液1.毛蕊异黄酮苷;2.芒柄花苷;3.毛蕊异黄酮;4.黄芪甲苷;5.黄芪皂苷Ⅲ ;6.芒柄花素;7.黄芪皂苷II;8.大豆皂苷I;9.异黄芪皂苷II;10.黄芪皂苷I图3 不同溶剂处理含药血清及混合对照品溶液提取离子流图(EIC)

峰号保留时间(min)(-)MS成分鉴定15 min30 min60 min90 min120 min240 min360 min480 min600 min黄芪红芪黄芪红芪黄芪红芪黄芪红芪黄芪红芪黄芪红芪黄芪红芪黄芪红芪黄芪红芪11.7481.1491.1毛蕊异黄酮苷++++++++++++++++++++—+—22.5/4.3625.4661.4671.4Isomucronulatol-7,2’-di-O-glucoside+—+—+—+—+—+—+—+———44.7465.1475.1芒柄花苷+++++++++++++++++++++++++55.3497.7507.7Kaempfrol-4’-methether-3-β-D-glucoside++—+++—+++—++—++—++—++—+—+—65.6463.0499.0509.0Isomucronulatol-7,2'-di-O-glucoside/(3S)- mucronulatol-7-O-β-D- glucoside+++++++++++++++—++—+—+—+—+—75.8283.1毛蕊异黄酮+++++++++++++++++—137.5819.5829.5黄芪甲苷++—++—++—++—++—++—++—++—++—147.6819.5829.5黄芪皂苷Ⅲ+—+—+—+———————————168.4267.1芒柄花素++++++++++++++++++++++++++178.4861.5871.5黄芪皂苷II+++—+++—+++—+++++++++++++++++—++—++—199.1861.5871.5异黄芪皂苷II++—+++—+++—+++—++++++++—++—++—2110.9903.1913.1黄芪皂苷I+++++++++++++++++++++++++++++2211.8903.1913.1异黄芪皂苷I+++++++++++++++++++—+—+—
注:—表示未检测到该成分,+:表示含有少量该成分(EIC峰高响应值数量级105),++、+++和++++:表示随峰高响应值数量级增加含量依次增加
4 讨论
4.1 样品提取方法的确定
参考黄芪水提取、醇提取最佳提取工艺研究文献[21-24],分别采用水提取(10倍量,煮取2次,每次1.5 h)和70%乙醇提取(10倍量,回流提取2次,每次2 h)制备样品,预实验结果表明,70%乙醇提取样品入血成分数量多、峰面积大,因此,采用70%醇提取样品。
4.2 血清样品处理方法考察
实验考察了4种血清处理方法,取450 μL空白血加入10 μg/mL混标溶液,50 μL配成1 μg/mL含药血清共4份,分别加入1.5 mL甲醇、乙腈、乙酸乙酯和正丁醇涡旋混匀12000 rpm离心10 min,取上清氮吹,以0.1 mL 70%甲醇复溶,12000 rpm离心10 min,制得4份血清样品。4种溶剂对4种黄酮类成分提取无明显差异,甲醇、乙腈和正丁醇对黄芪甲苷和大豆皂苷I提取率较乙酸乙酯高,而乙酸乙酯对黄芪皂苷II、异黄芪皂苷II及黄芪皂苷I的提取率要高于其他3种溶剂,乙酸乙酯提取可有效检测到全部10种化合物,最终选取乙酸乙酯萃取法作为样品处理方法。
4.3 应用LC-MS技术检测血清中移行成分
本实验采用LC-TRAP-MS进行血中移行成分检测。大鼠口服红芪或黄芪后血清中内源性成分的电离程度强,对入血成分影响较大。故本实验采取EIC模式提取含药血清中来源于黄芪及红芪中的相应成分,通过比对二者在相同保留时间处色谱峰的质谱图,同时参考文献推测血清中微量的移行成分。采用LC-TRAP-MS技术,结果灵敏、准确,为阐明红芪和黄芪药入血成分(可能的药效物质基础)的研究提供科学数据。
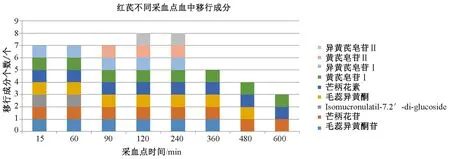
图4 红芪不同采血点血中移行成分
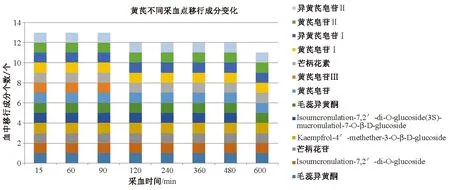
图5 黄芪不同采血点血中移行成分
LC-TRAP-MS检测灵敏度为104,本实验中检测不到成分并不代表血中没有,但一些成分由于技术要求难以鉴别,或其含量太低无法检测。因此,本文所报道的红芪、黄芪血中移行成分的差异是在此条件下的研究结果。
4.4 红芪、黄芪入血成分的对比分析
图4、5显示,红芪入血成分随时间推移呈现先增多后减少的趋势,成分个数减少较多,表明红芪入血成分种类变化较大;黄芪入血成分随时间推移有减少,但相对平稳,表明黄芪入血成分种类变化较小。
综上,从红芪、黄芪血中的移行成分分析,二者有一定的共有成分,可能有相近的功效,但血中不同移行成分较多且血中成分随时间推移变化差异较大,为《中华人民共和国药典》将红芪和黄芪分别列为2个品种提供了一定的科学依据。因此,建议红芪、黄芪不宜相互替代使用。

