ILK、E-cadherin及Twist在膀胱癌中的表达及意义
高 娟,董兵卫,张渭波,李 卓*
(1西安医学院第一附属医院检验科,西安 710077;2咸阳市中心医院病理科;*通讯作者,E-mail:lizhuo721@163.com)
膀胱癌(urothelial cell carcinoma,UCC)占膀胱肿瘤系统的80%-90%左右,60%左右的患者手术后会有复发的可能。上皮间质转化[1](epithelial mesenchymal transition,EMT)是多细胞胚胎发育与器官形成中的基础过程,近年来研究发现[2],EMT在肿瘤发生、发展与转移过程中起着重要的作用,EMT使没有侵袭、迁移能力的细胞获得浸润能力并最终转移到其他组织和器官,并再次通过间质上皮转化定植形成转移灶。
整合素连接激酶(intergrin-linked kinase,ILK)是一个59 kDa的细胞内信号蛋白,它在胞内的两个靶向催化位点是蛋白激酶B和糖原合成酶激酶-3。研究显示,ILK与神经胶质瘤等的发生、分化及侵袭转移密切相关[3],实验证实,运用siRNA ILK抑制ILK的活性,在膀胱癌细胞中,可以抑制细胞的生长、迁移、侵袭和血管生成[4]。ILK是哺乳动物细胞中主要的信号传导分子,在人类肿瘤发生EMT的过程中起着重要作用,但是其机制目前并不清楚[5]。上皮性钙黏附蛋白(E-cadherin)的下调与神经性钙粘附蛋白(N-cadherin)的上调是EMT的主要特征之一。研究表明下调ILK能使E-cadherin在体内外的表达均升高,而E-cadherin的低表达是EMT的重要标志[6-7],通过与靶基因启动子结合,诱导EMT的发生,促使肿瘤细胞发生侵袭与转移[8];而碱性螺旋环转录因子(Twist)通过抑制细胞凋亡与分化,诱导细胞上皮间质化转变,其高表达与肿瘤的转移与预后相关[9]。至今为止,ILK、E-cadherin及Twist在膀胱癌EMT中的作用未见报道,本文应用免疫组化SP法检测ILK、E-cadherin及Twist在膀胱癌组织中的表达,分析三者对膀胱癌EMT的影响。
1 材料与方法
1.1 一般资料
收集2015-06~2017-12咸阳市中心医院病理科膀胱肿瘤手术切除新鲜标本,离体5 min内进行取材,病理证实均为原发性膀胱癌,并无化疗、放疗。取62例(其中男50例,女12例)膀胱癌标本,患者年龄为49-81岁,平均年龄65岁,依据WHO(2004)泌尿系统肿瘤的病理分级标准分类:高分化28例,低分化34例;另取25例(其中男20例,女5例)癌旁正常组织作为阴性对照,年龄53-85岁,平均年龄69岁。所有标本用10%中性福尔马林固定,常规脱水、透明、浸蜡、包埋,4 μm厚连续切片。
1.2 方法
1.2.1 主要试剂 免疫组织化学、DAB染色试剂盒均由博奥森公司提供,兔抗人ILK多克隆抗体由Santa Cruz公司提供;兔抗人E-cadherin及Twist多克隆抗体均由迈新生物技术有限公司提供。
1.2.2 方法 免疫组织化学采用SP法进行染色,一抗兔抗人ILK、E-cadherin及Twist多克隆抗体稀释浓度均为1 ∶100。严格按照试剂盒说明书进行操作,用已知阳性切片作为阳性对照,以0.01 mol/L PBS(pH 7.4)替代一抗作为阴性对照。
1.2.3 结果判断 染色结果评定:ILK和Twist蛋白主要在细胞质内表达,以细胞浆中出现棕黄色染色为阳性染色,E-cadherin蛋白以细胞膜或细胞质出现棕黄色染色为阳性染色,评分标准:①随机选择计数1 000个细胞,计算阳性细胞百分数:阳性细胞百分数<10%为1分,10%-50%为2分,>50%为3分。②染色强弱计分:阴性为0分,浅黄色为1分,黄色为2分,棕黄(褐)色为3分。按照“阳性细胞百分数×染色强弱”计总分:0-1分为阴性(-),2-4分为弱阳性(+),6-8分为阳性(++),9分为强阳性(+++)。阳性判定标准为+,++,+++。
1.3 统计学分析
采用SPSS 18.0统计软件进行统计学分析,两组间比较选用χ2检验(包括Fisher精确概率法)。相关分析采用Spearman等级相关分析法处理统计结果。
2 结果
2.1 膀胱癌和癌旁正常组织中ILK、E-cadherin及Twist的表达
SP染色结果显示,ILK及Twist在膀胱癌中的表达较癌旁正常组织高,E-cadherin在膀胱癌中的表达较癌旁正常组织低(见图1)。ILK在膀胱癌和癌旁正常组织中的表达率分别为54.8%(34/62)和16.0%(4/25),两组相比差异具有统计学意义(χ2=10.9,P<0.05)。E-cadherin的阳性表达分别为32.3%(20/62)和72.0%(18/25),两组相比差异具有统计学意义(χ2=11.4,P<0.05)。Twist的阳性表达分别为64.5%(40/62)和4.0%(1/25),两组相比差异具有统计学意义(χ2=26.2,P<0.05,见表1)。
表1ILK、E-cadherin及Twist在膀胱癌和癌旁正常组织中的表达
Table1ExpressionofILK,E-cadherinandTwistinbladdercancerandadjacentnormaltissues
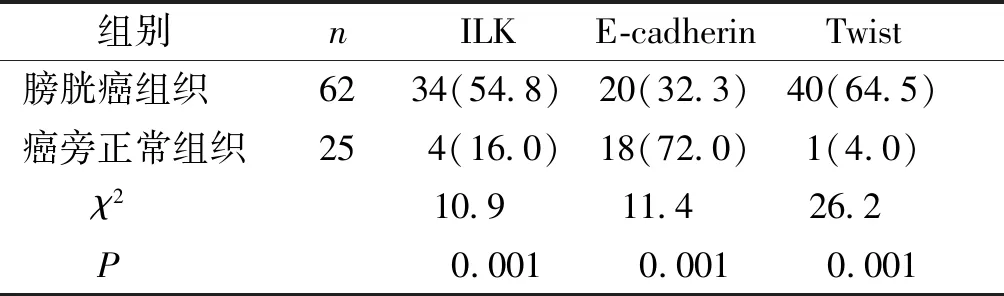
组别nILKE-cadherinTwist膀胱癌组织6234(54.8)20(32.3)40(64.5)癌旁正常组织25 4(16.0)18(72.0)1(4.0) χ210.9 11.4 26.2 P0.0010.0010.001
2.2 膀胱癌病理分级与ILK、E-cadherin及Twist表达的关系
膀胱癌不同病理分级ILK的表达分别为:高分化39.3%(11/28),低分化67.6%(23/34),两组相比差异具有统计学意义(χ2=4.9,P<0.05);E-cadherin在膀胱癌不同病理分级中的表达分别为:高分化53.6%(15/28),低分化14.3%(5/34),两组相比差异具有统计学意义(χ2=10.6,P<0.05);Twist在膀胱癌不同病理分级中的表达分别为:高分化53.6%(15/28),低分化73.5%(25/34),两组相比差异具有统计学意义(χ2=2.7,P<0.05,见表2)。
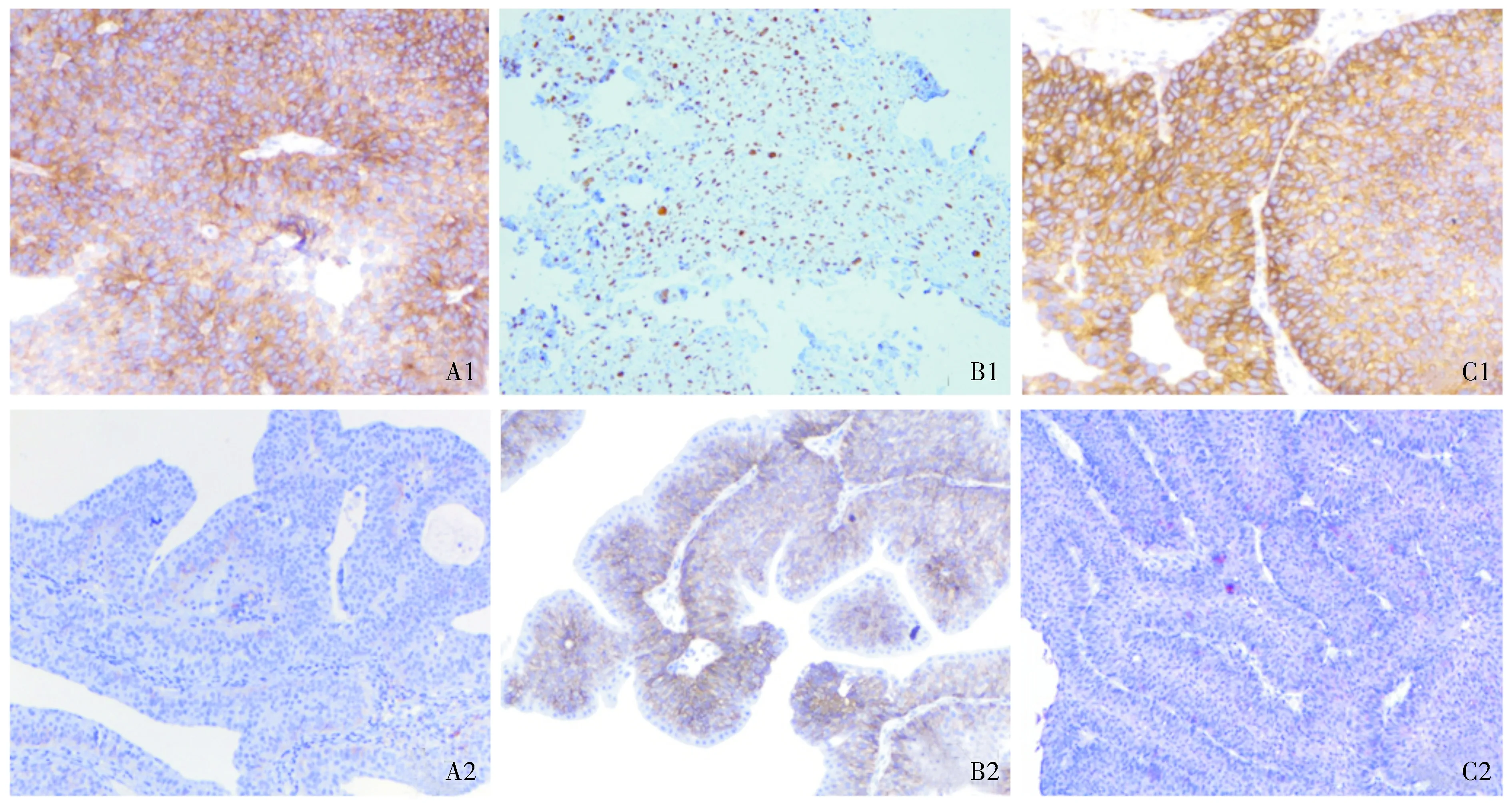
A1. ILK在膀胱癌组织中阳性表达;A2. ILK在癌旁正常组织中弱阳性表达;B1. E-cadherin在膀胱癌组织中弱阳性表达;B2. E-cadherin在癌旁正常组织中强阳性表达;C1. Twist在膀胱癌组织中阳性表达;C2. Twist在癌旁正常组织中不表达图1 ILK、E-cadherin及Twist在膀胱癌及癌旁正常组织中的表达 (SP,×100)Figure 1 Expression of ILK, E-cadherin and Twist in bladder cancer and adjacent normal tissues (SP,×100)
表2ILK、E-cadherin及Twist的表达与膀胱癌病理分级的关系
Table2TherelationshipbetweentheexpressionofILK,E-cadherinandTwistandthepathologicalgradeofbladdercancer
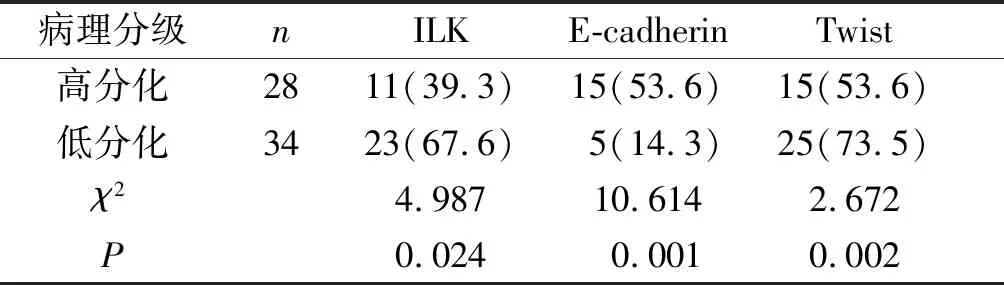
病理分级nILKE-cadherinTwist高分化2811(39.3)15(53.6)15(53.6)低分化3423(67.6)5(14.3)25(73.5)χ24.98710.6142.672P0.0240.0010.002
2.3 ILK、E-cadherin及Twist在膀胱癌中表达的相互关系
膀胱癌中E-cadherin与ILK表达呈负相关(r=-0.3,P<0.05,见表3),Twist与ILK表达呈正相关(r=0.4,P<0.05,见表3),E-cadherin与Twist表达亦呈负相关(r=-0.5,P<0.05,见表4)。
表3E-cadherin、Twist与ILK在膀胱癌中表达的关系
Table3RelationshipbetweenE-cadherin,TwistandILKexpressioninbladdercancer

ILKE-cadherinTwist+-rP+-rP+727-0.30.0012860.4 0.001-13151216
表4E-cadherin与Twist在膀胱癌中表达的关系
Table4RelationshipbetweenE-cadherinandTwistexpressioninbladdercancer
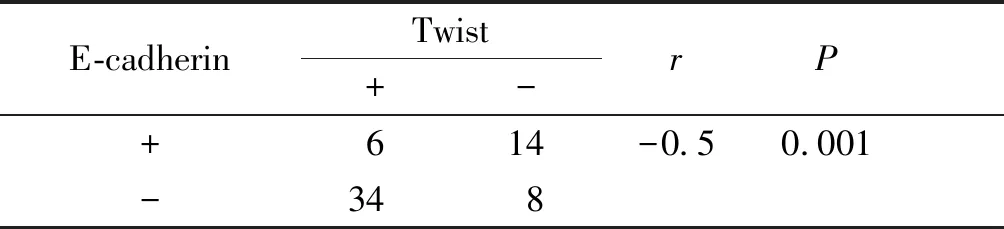
E-cadherinTwist+-rP+614-0.50.001-348
3 讨论
研究发现,EMT与膀胱癌的侵袭、转移密切相关,同时还与膀胱肿瘤分期、分级相关[10]。作为一种重要的EMT调控蛋白,ILK引起了广泛的关注,它通过使肿瘤细胞获得间质表型从而在多种肿瘤中介导了侵袭转移[11]。过表达ILK蛋白引起它所介导的信号通路的改变,最终会导致细胞向恶性分化。E-cadherin是一种钙依赖性跨膜蛋白,广泛参与同型细胞间的黏附及细胞骨架的稳定,它的异常表达被认为与EMT的发生密切相关[12]。Le等[13]研究报道,在乳腺癌患者E-cadherin蛋白表达明显降低。研究发现,显著降低ILK的表达后,EMT相关的蛋白分子E-cadherin表达增加,抑制肿瘤转移,使肿瘤细胞恶性程度降低[14]。本研究显示,ILK在膀胱癌中的表达明显高于癌旁正常组织,而E-cadherin的表达明显低于正常组织,且E-cadherin在高分化癌中表达明显高于低分化癌,并与ILK的表达呈负相关,提示E-cadherin表达下调诱发EMT,使细胞间的黏附作用削弱,从而使肿瘤细胞脱离原发灶,发生浸润和转移。
Twist是近年来倍受关注的癌基因之一,参与肿瘤细胞EMT过程,使肿瘤细胞通过适应周围基质环境获得新的上皮特性,形成转移病灶,且这种转移灶中的肿瘤细胞迁移、增殖的活性较原发肿瘤更强,并出现抗肿瘤药物的活性[15]。在多种肿瘤的研究[16]中发现,Twist是肿瘤细胞发生EMT,并获得迁徙、侵袭和转移能力的主要诱导因子之一。Twist具有独立的抑制E钙黏蛋白表达,并上调纤连蛋白和N钙黏蛋白的作用。Li等[17]研究乳腺癌MCF7细胞系和宫颈癌Hela细胞系中Twist的表达时发现,Twist高表达可诱导与EMT相关的细胞形态学变化。本文研究提示Twist在膀胱癌中的表达随着肿瘤恶性程度的增加而增高,并与ILK的表达呈正相关,同时,随着Twist的上调,E-cadherin表达出现下降,E-cadherin作为EMT过程中的关键因子,表明Twist1在膀胱癌中是通过E-cadherin最后发挥作用。因此,从本实验中我们推测,三者在作用机制上可能存在某种联系,通过相互调节,在膀胱癌EMT的发生、发展中发挥协同效应,构成膀胱癌恶性生物学行为的基础。本课题组在后续实验中将继续探讨三者的相互作用,为膀胱癌的诊治提供更多的科学依据。

