焙烧镁铝水滑石吸附脱硫废水中高浓度Cl-的基础研究
马双忱,刘亚争,马 岚,吴 伟,赵兴辉,高 然,林宸雨
(1.华北电力大学 环境科学与工程系,河北 保定 071003; 2.华能沁北发电有限公司,河南 济源 450052)
2015年《水污染防治行动计划》提出“狠抓工业污染防治”,一些重点地区禁止污水外排,电厂废水治理倍受关注。石灰石-石膏湿法烟气脱硫技术因其脱硫效率高,在超低排放改造后被火电厂广泛使用[1-2]。湿法脱硫循环运行过程中,脱硫浆液中氯离子不断富集,过量Cl-影响石灰石的溶解、降低石膏品质、导致设备的腐蚀加剧,为保证系统稳定可靠,控制Cl-浓度在10 000~20 000 mg/L外排脱硫废水[3]。脱硫废水作为终端废水水质恶劣,具有高氯、高硬度、高悬浮物、含重金属的特点,经过“中和、混凝、沉淀”的三联箱工艺处理后,重金属及悬浮物含量降低,但仍为高氯的含盐水且水量较大,2017年《火电厂污染防治可行性技术指南》(HJ2301—2017)指出实现废水近零排放的关键是实现脱硫废水零排放[4-6]。可以看出,脱硫废水中Cl-浓度是关键控制指标,若能降低脱硫废水的Cl-含量,可提高脱硫废水循环倍率,使得废水减量化,节约后续脱硫废水近零排放处理成本。
目前去除废水中氯离子的方法主要有电凝聚法、离子交换法、吸附法等[7]。吸附法具有固液分离、操作简单、成本低、效率高等优点,其中,水滑石(LDH)作为一种经济环保的吸附剂,在废水处理方面倍受关注[8]。水滑石又称层状双金属氢氧化物,是一种具有层状结构的阴离子黏土,化学表达式为Mg6A12(OH)16CO3·4H2O[9]。它的焙烧产物,焙烧水滑石(CLDH)的层状结构塌陷,若将CLDH放入到含有某些阴离子的环境中时,这些阴离子会插入到层间进而恢复LDHs原有的层状结构,即“记忆效应”[10]。利用这种独特的结构记忆效应CLDH可用作Cl-吸附剂。
目前利用焙烧镁铝水滑石吸附去除氯离子的研究取得良好进展,但多集中于Cl-为100~1 000 mg/L的低浓度研究[11-14],且对于实际脱硫废水的氯离子去除鲜有研究。因此,以脱硫废水为研究对象,系统研究了CLDH对高浓度5 000~20 000 mg/L Cl-的吸附特性,并进一步考察了在实际脱硫废水中的脱氯效果及吸附剂再生性能,为焙烧镁铝水滑石脱除脱硫废水中的Cl-提供参考。
1 实验材料与方法
1.1 实验材料
本实验制备LDH采用分析纯(AR)试剂:Mg(NO3)2·6H2O,Al(NO3)3·9H2O,Na2CO3,NaOH。
本实验采用的废水为NaCl模拟废水及某电厂脱硫废水。模拟废水采用固体NaCl(AR)加入去离子水配制Cl-浓度为100~20 000 mg/L的溶液。脱硫废水为某电厂经“三联箱”处理后脱硫废水出水,送至北京理化测试中心检测,其主要化学成分见表1。
1.2 实验方法
(1)CLDH的制备方法。
采用pH值共沉淀直接法、双滴法、高压反应釜法分别制备LDH,控制镁铝物质的量比为3∶1,4∶1,分别采用去离子水及蒸馏水进行制备实验,不同方法得到CLDH脱氯效果如图1所示。可以看出去离子水与蒸馏水去除效果相似,镁铝物质的量比为4∶1时脱除效果更佳,直接法制备吸附剂脱除效率略大于双滴法,高压反应釜法制备的吸附剂可提高脱除率约21%。但本文采用直接沉淀法制备水滑石,其操作简单、水滑石产量较大。
表1某电厂“三联箱”处理后脱硫废水出水成分
Table1CompositionsofFGDwastewaterinapowerplant

pHSO42-/(mg·L-1)Cl-/(mg·L-1)F-/(mg·L-1)Ca2+/(mg·L-1)Mg2+/(mg·L-1)SS/(mg·L-1)TDS/(mg·L-1)6.8549 80018 64019567318 20019189 000
注:SS为固体悬浮物,TDS为可溶解性固体总量。

图1 不同制备方法的CLDH脱氯效果对比Fig.1 CLDH dechlorination by different preparation methods

(2)CLDH吸附实验。
取CLDH吸附剂于250 mL锥形瓶中,加入Cl-溶液,一定温度下恒温水浴震荡4 h,震荡速度为200 r/min,然后抽滤,测定上清液Cl-的浓度。根据吸附前后Cl-的浓度变化,按式(1)计算脱氯率η,式(2)计算吸附量q[16]为
η=(c0-c)/c0
(1)
式中,η为脱氯率,%;c0和c为吸附前后溶液中Cl-离子的浓度,mg/L。
qt(qe)=(c0-c)V/m
(2)
式中,qt为吸附时间t时的吸附量,mg/g;qe为单位质量的最大吸附量,mg/g;V为溶液的体积,L;m为吸附剂质量,g。
每项实验设置两组平行实验,实验结果为其平均值。
(3)CLDH再生和重复使用性。
CLDH吸附脱硫废水中Cl-实验后,过滤、洗涤,滤饼80 ℃下烘干,后于450 ℃下焙烧3 h,得到再生吸附剂,重复操作。
(4)测定及表征方法。
Cl-浓度采用GB11869—89硝酸银滴定法测定。采用Quantatech Co Auto-sorb-iQA3200-4型进行BET比表面积测试。采用Buker D8advance型X射线衍射仪(XRD)确定水滑石物相,XRD扫描范围为5°~90°,扫描速度为4°/min,X射线管工作工作电压为30 kV,管流为20 mA。采用美国Perkin Elmer Spectrum 100型傅立叶变换红外光谱仪(FT-IR)进行红外分析,波数400~4 000 cm-1。
2 结果与分析
2.1 反应时间的影响
CLDH投加量为2 g/L时、温度25 ℃时,吸附时间0~9 h时CLDH吸附Cl-的结果,如图2所示。从图2可以看出,随反应时间的增大,吸附量及脱氯率先快速增加后缓慢增加,吸附平衡后发生缓慢脱附反应。图中在Cl-的吸附平衡时间为4 h,Cl-浓度为10 000 mg/L溶液中CLDH平衡吸附量为373.91 mg/g,Cl-浓度为15 000 mg/L溶液中CLDH平衡吸附量为539.68 mg/g。
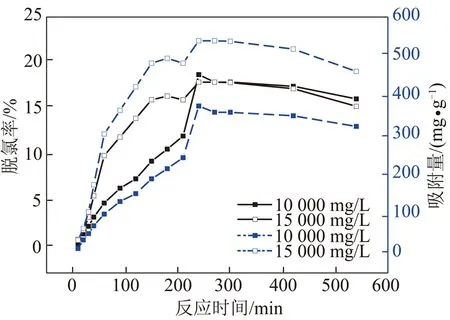
图2 反应时间对CLDH吸附Cl-的影响Fig.2 Effects of contact time on adsorption of Cl- by CLDH
按一级动力学方程ln(qe1-qt)=lnqe2-kt对图2实验数据进行拟合,其中qe1为实验值,qe2为理论值,以ln(qe-qt)对t作图[17]得到图3,根据斜率和截距得到25 ℃下的动力学参数qe2和k,见表2。图3中相关性系数R2>0.95,表2中理论值与实际值接近,说明CLDH吸附Cl-符合一级动力学模型。
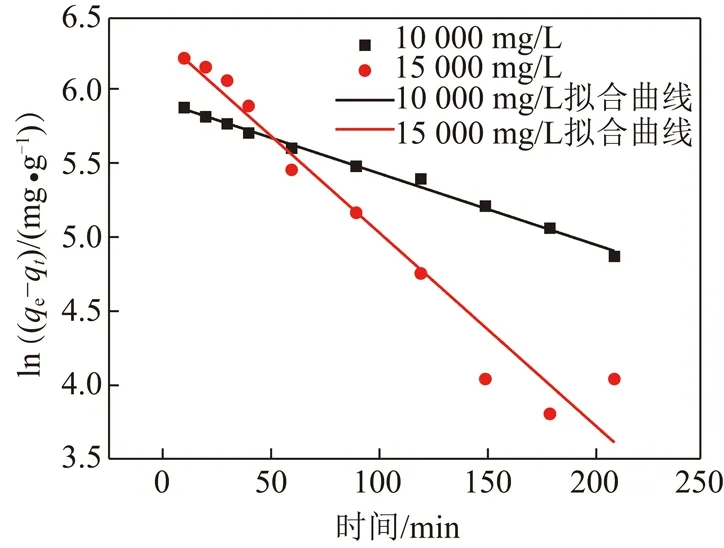
图3 CLDH吸附Cl-的一级动力学方程拟合Fig.3 First-order kinetic model of adsorption of Cl- by CLDH

浓度/(mg·L-1)qe1/(mg·g-1)qe2/(mg·g-1)kR210 000373.91375.820.004 80.994 315 000539.68576.230.013 10.952 8
2.2 初始浓度的影响
CLDH投加量为2 g/L时、温度25 ℃时,改变Cl-初始浓度100~20 000 mg/L对Cl-的吸附规律,如图4所示。由图4可以看出,平衡吸附量随着Cl-浓度提高而增大,但脱氯率在Cl-浓度为5 000 mg/L时最大,之后随着氯离子浓度增大,由于吸附点位数量一定,脱氯率降低。

图4 Cl-初始浓度对CLDH吸附Cl-的影响Fig.4 Effects of initial concentration of Cl- on adsorption of Cl- by CLDH

图5 CLDH吸附Cl-的Freundlich等温方程拟合Fig.5 Adsorption isotherm of Cl- by CLDH
2.3 反应温度的影响
CLDH投加量为2 g/L时,改变反应温度35~85 ℃对吸附Cl-的影响,如图6所示。由图6可知随着温度的增加,CLDH对吸附Cl-的脱除率及吸附量增加,当达到65 ℃时,脱氯率及吸附量最大,当温度继续升高,CLDH对Cl-的吸附效果大幅下降。这是因为CLDH的表面吸附及离子交换吸附是吸热反应,提高温度加快反应进行,但过高温度破坏了吸附剂部分晶体结构,降低吸附性能[19]。

图6 反应温度对CLDH吸附Cl-的影响Fig.6 Effects of temperature on adsorption of Cl- by CLDH
2.4 溶液初始pH的影响
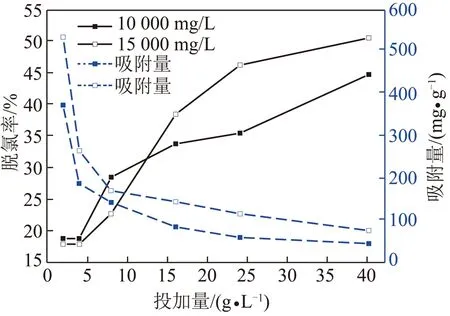
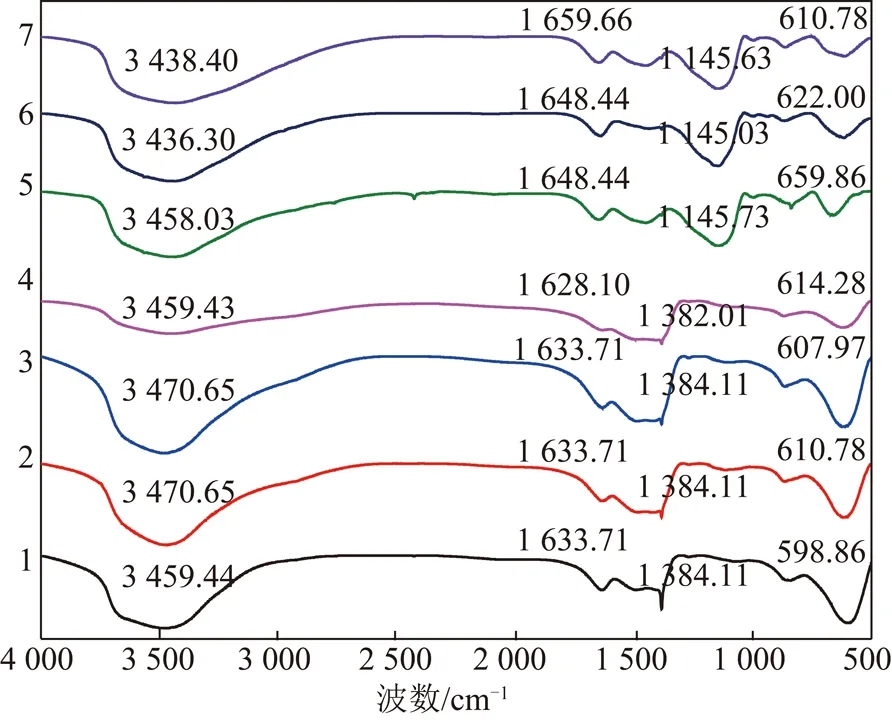
CLDH投加量为2 g/L时、温度25 ℃时,改变溶液初始pH值2~12对吸附Cl-的影响,如图7所示。可以看出改变pH值,CLDH对Cl-的吸附效果差别较小,但当pH=8时达到脱氯率及吸附量的最大值,4 图7 溶液初始pH对CLDH吸附Cl-的影响Fig.7 Effects of initial pH on adsorption of Cl- by CLDH 温度25 ℃时,改变CLDH投加量2~40 g/L对吸附Cl-的影响,如图8所示。由图8可知随着CLDH投加量的增加,脱氯率从18.8%递增到50.6%,吸附量从374.2 mg/g递减到75.8 mg/g;两曲线相交于8 g/L处,此时脱氯率及吸附量均较高,脱氯率为28.5%,吸附量为142.6 mg/g。可以看出,增加吸附量可提高脱氯效率,但吸附剂的吸附量则逐渐降低,最佳投加量为8 g/L。这是因为随着CLDH投加量增大,吸附点位增多,吸附Cl-的量增大,故脱氯率升高,但单位质量吸附剂的脱氯量减少,故吸附量降低。 图8 投加量对CLDH吸附Cl-的影响Fig.8 Effects of dosage on adsorption of Cl- by CLDH CLDH投加量为2 g/L时、温度65 ℃、pH=8时,CLDH对脱硫废水实际体系中浓度为18 640 mg/L的Cl-随时间的脱除率及吸附量变化,如图9所示。由图9可以看出,在最佳反应温度及最佳pH条件下,CLDH对成分复杂的脱硫废水中的Cl-有较好的吸附效果,在180 min时达到吸附平衡,脱氯率达50.90%,吸附量为1 866.6 mg/g。由表3看出,一次再生脱氯率为46.15%,是原始脱除效率的90.70%,二次再生脱氯率为29.00%,是原始脱除效率的56.90%。说明直接煅烧再生的CLDH,对于脱硫废水脱氯具可再生重复使用性,一次重复再生基本恢复吸附容量,二次重复再生脱除效率降低一半。 图9 CLDH对脱硫废水中Cl-的吸附Fig.9 Adsorption of CLDH for Cl- of FGD wastewater 名称脱氯率/%吸附量/(mg·g-1)平衡反应时间/h吸附剂50.901 866.63一次再生46.151 698.34二次再生29.001 067.24 2.7.1 BET比表面积分析 以BET法测算CLDH吸附剂的比表面积为48.8 m2/g,空隙容积为0.218 cm3/g,与以物理吸附为主的活性炭相比,其比表面积高达为500~5 000 m2/g,空隙容积为0.25~0.90 cm3/g,由此可以看出CLDH吸附原理不是以表面吸附为主,而是由于LDH结构的记忆效应,这与文献[10]结论一致。 2.7.2 XRD衍射分析 图10为CLHD不同的Cl-吸附实验前后XRD谱图。5~7号图谱在2θ为43.30°,62.56°处出现明显的CLHD的镁铝氧化物的特征衍射峰[22-24]。5号图谱基线平稳无杂峰,衍射峰对称性好,说明制备的CLHD纯度及结晶度较高,6~7号图谱说明煅烧再生使吸附剂恢复原来的层状结构。2θ为43.30°处峰高209(5号)>204(6号)>154(7号),2θ为62.56°处峰高104(5号)>96(6号)>64(7号),5~7号峰形变宽、强度减弱,说明再生CLHD结晶度降低,部分结构未恢复,因此未再生CLHD脱氯效率最大,二次再生CLHD脱氯效率最低。 图10 不同CLDH的XRD谱Fig.10 XRD patterns of different CLDH1—温度65 ℃下吸附实验后的CLHD;2—pH=8.06时吸附实验后的CLHD;3—pH=4.14时吸附实验后的CLHD;4—pH=12.00时吸附实验后的CLHD;5—镁铝物质的量比4∶1的CLHD;6—脱硫废水吸附实验后一次再生的CLHD;7—脱硫废水吸附实验后二次再生的CLHD 1~4号图谱在2θ为11.20°,22.65°,34.30°处出现了明显的LHD的特征衍射峰[21],CLHD说明吸附Cl-后,部分恢复了LHD的层状结构,结合BET比表面积测试结果,CLHD的吸附Cl-机理主要为层间阴离子的交换,即“记忆效应”。2~4号峰型相似,均是在改变pH条件吸附实验,说明改变pH对脱氯效果影响较小,而1号在最佳反应温度下的吸附后的CLHD图谱特征峰比2~4号的更窄更高,说明吸附更多Cl-、恢复LHD的层状结构更好,因此最佳温度下脱氯效率更好,同实验结果一致。 图11 不同CLDH的FT-IR谱Fig.11 FT-IR spectra of different CLDH 2.7.3 FT-IR红外光谱分析 5~7号图谱中以上特征峰仍然存在,但羟基的伸缩振动、弯曲振动和碳酸根的吸收振动峰减弱,说明部分CO32-部分转化为CO2气体[27-28]。6~7号碳酸根的弯曲振动较5号发生了红移,这可能是氯离子进入层间与碳酸根的相互作用引起的。 (1)发现CLHD对Cl-吸附符合一级动力学模型,吸附等温线符合Freundlich方程模型。吸附平衡时间在4 h;吸附量随Cl-初始浓度的增加而增大,脱氯率在5 000 mg/L浓度Cl-时最大;随着反应温度的升高脱氯效果明显提高,但当温度超过65 ℃时,吸附效果大幅度降低;溶液pH值对吸附效果影响较弱,pH=8时,脱氯效果最佳;随着投加量增大,吸附量降低,脱氯率增大,最佳投加量为8 g/L。 (2)在CLDH投加量为2 g/L时、最佳反应温度65 ℃、最佳pH为8时,CLDH对脱硫废水中Cl-脱除率达50.90%,吸附量为1 866.6 mg/g;直接煅烧再生的CLDH对脱硫废水脱氯具有可再生重复使用性,一次再生脱氯率为46.15%,二次再生脱氯率为29.00%。 (3)通过BET,XRD,FT-IR表征分析,CLDH的主要吸附机理不是表面吸附,而是层间阴离子被Cl-取代,恢复了LDH的层间结构,即“结构记忆”机理。吸附脱硫废水后重复再生的吸附剂仍具有CLDH结构。
2.5 CLDH投加量的影响
2.6 脱硫废水去除效果及再生重复使用性


2.7 表征分析


3 结 论

