婴幼儿动脉导管未闭合并中-重度肺动脉高压28例的介入治疗*
舒悦, 郭义龙, 王天光, 陈泽伦, 何书武
海南医学院第二附属医院心血管外科(海南海口 570102)
动脉导管未闭(patent ductus arteriosus,PDA)是由于某种原因导致出生后动脉导管持续不闭合,是最常见的先天性心脏病之一,多见于早产儿。PDA发病率占先天性心脏病发病率的10%~21%[1]。本研究回顾性分析28例PDA合并中-重度肺动脉高压且伴有重度生长发育不良的婴幼儿介入治疗和随诊的情况,探讨该类患儿介入治疗的可行性、安全性及有效性。
1 资料与方法
1.1 一般资料 选择2011年12月至2017年1月在我院成功接受PDA介入治疗的108例患儿作为备选研究对象。纳入标准:(1)年龄小于36个月;(2)单发PDA;(3)合并肺动脉高压[婴幼儿肺动脉压力评估以心导管直接测量肺动脉平均压(PAS)与主动脉平均压(SAS)比值来判断其程度更为准确即轻度:0.25~0.45,中度:0.46~0.75,重度:>0.75[2]];(4)左室射血分数(LVEF)>50%。
排除标准:(1)合并其他需要同期处理的心血管畸形;(2)心功能不全或艾森曼格综合征。最终有28例患儿被纳入本研究。
分别将各患儿的身高、体重与“2006版WHO儿童生长发育标准[3]”相对比,结果显示全组患儿均处于生长发育迟缓状态(均P<0.05);由于婴幼儿年龄小,血管内径小,故单纯采用“PDA最窄处直径”来描述PDA的大小难免不够准确,故本研究尝试采用“PDA最窄处直径”与“PDA/DA(descending aorta,DA,降主动脉直径)”这两个指标相结合的方式来描述PDA的大小,见表1。
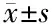
项目数值性别(例) 男10 女18年龄(月)25.50±10.54体重(kg)9.73±3.04身高(cm)81.23±10.77PDA最窄处直径(mm)3.86±1.44PDA/DA(%)43.30±15.90PDA类型(例) 管型3 漏斗型25左房直径(mm)23.57±3.74左室舒张末期直径(mm)37.21±6.07LVEF(%)55.46±1.95
PDA直径:PDA最窄处直径;DA:PDA主动脉开口处降主动脉直径
1.2 治疗方法
1.2.1 术前准备 术前常规行心电图、胸片、经胸超声心动图、血气分析等检查。
1.2.2 手术方法 本组患儿均在局部麻醉+基础麻醉下接受治疗。常规行右侧股动静脉穿刺置管,测量肺动脉、升主动脉及降主动脉的压力后行降主动脉造影,确定PDA位置、大小、类型及是否合并主动脉缩窄等畸形。依据造影结果选择合适的PDA封堵器(国产Amplatzer型)和相应的鞘管封堵未闭动脉导管,封堵器放置到位后监测肺动脉、升主动脉及封堵器以远降主动脉压力,约10 min后重复降主动脉造影,观察封堵器的位置、形态及是否有残余分流等。
释放封堵器前确认:(1)肺动脉压较术前降低;(2)封堵器部位主动脉近、远心端无压力阶差;(3)微少量残余分流(微量:PDA的肺动脉端有云雾状的造影剂外渗;少量:肺动脉显影但肺动脉瓣未显影;中量:肺动脉及肺动脉瓣均显影[4]);(4)治疗过程中患儿的生命体征平稳。
1.2.3 术后随访 术后24 h行经胸超声心动图、胸片、心电图、血尿常规等检查。术后6个月经胸超声心动图随访,均由我院指定的医生完成。
1.3 数据收集与处理
1.3.1 术前资料 分别收集患儿的性别、年龄和体重等资料,其中后两者用于患儿生长发育的评估。超声心动图测量PDA的大小、左房及左室舒张末期直径、LVEF,肺动脉压力和有否合并畸形。心电图作为术中和术后对比。胸片除外有否合并胸肺疾患,综上各项以便手术适应证选择。
1.3.2 术中情况 介入治疗前后的肺动脉、胸主动脉压;观察有无周围血管损伤、残余分流、血尿、主动脉或左肺动脉狭窄、封堵器移位等并发症。
1.3.3 术后随访资料 术后6个月返院行心脏彩超检查,记录左室舒张末期直径、左房直径、肺动脉收缩压及LVEF。
1.4 统计学方法 采用SPSS 19统计软件,计量资料以均数±标准差的方式表示,两两比较采用两独立样本t检验;对于非正态分布的资料通过计算中位数,采用秩和检验进行比较;以P<0.05为差异有统计学意义。
2 结果
2.1 术中情况 封堵后肺动脉平均压降低,升主动脉平均压升高,差异均有统计学意义(P<0.05,P<0.01),见表2。封堵后升主动脉与降主动脉平均压差异无统计学意义[(119.54±19.31)mmHg、(123.57±18.616)mmHg,P=0.429];除2例患儿术后即刻合并微量残余分流(术后6个月内消失)外,无其他介入相关并发症发生。封堵效果见图1。

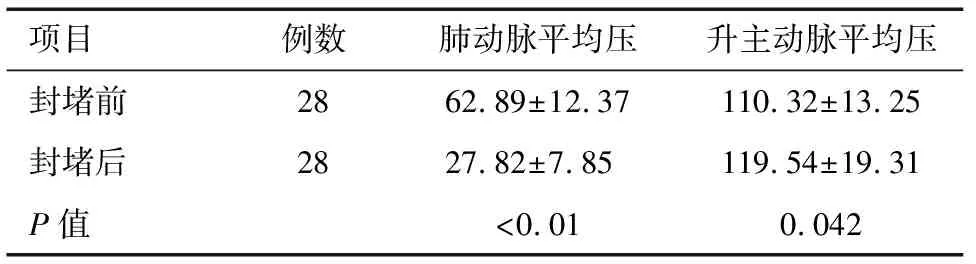
项目例数肺动脉平均压升主动脉平均压封堵前2862.89±12.37110.32±13.25封堵后2827.82±7.85119.54±19.31P值<0.010.042
2.2 术后随访资料 全部患儿的心脏大小、肺动脉收缩压及左室运动情况于术后6个月内恢复至正常范围,见表3。本组1例患儿术中24 h复查心脏彩超提示肺动脉收缩压为65 mmHg,予以口服波生坦规律治疗(2 mg/kg,2次/d)6个月后肺动脉收缩压降至30 mmHg。
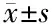

指标术后24 h术后6个月左房(mm)20.21±4.6318.04±2.15左室舒张末径(mm)32.84±5.3729.82±4.39肺动脉收缩压(mmHg)27.82±7.8525.57±5.17LVEF(%)55.43±1.7154.18±9.46
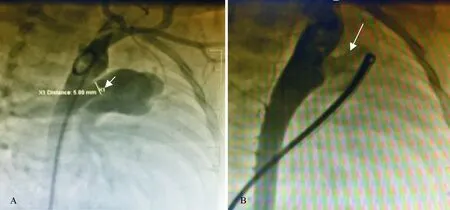
A:封堵前,箭头所指为动脉导管,白色直线所指为动脉导管直径,约5.09 mm;B:封堵后,箭头所指为动脉导管封堵器
图1封堵前后降主动脉造影结果
3 讨论
动脉导管由胚胎期左侧第六主动脉弓的背侧部分演变而来,连接于主肺动脉与主动脉弓远端之间,是胎儿期血液循环的主要通路。通常于出生后10~20 h功能性闭合,多数新生儿期闭合后退化为动脉导管韧带。出生后由于肺膨胀,肺循环阻力减低,肺动脉血流直接流入肺部,导管逐渐由功能而致解剖的闭合。典型的动脉导管位于主动脉弓峡部与主肺动脉分叉的左肺动脉起始部。未闭的动脉导管按形态分为漏斗型(导管的主动脉端扩张至肺动脉端逐渐变细,形似漏斗,此型最为多见)、窗型(导管短而粗,形成间隔缺损;管状:导管的主动脉端和肺动脉端粗细相等)。由于主、肺动脉间的左向右分流,造成左心回心血量增加,左心房室扩大。肺循环血量增加,导致肺动脉压力升高,肺循环阻力加大,最终至右心房室扩大乃至右心功能衰竭。
患儿临床表现为反复的呼吸道感染,乃至肺炎,重症者喂养困难,生长发育迟缓。合并重度肺动脉高压时形成右向左分流,出现分界性紫绀,故而确立诊断后应及早治疗[5]。相较于传统的外科手术,介入治疗主要有以下5大优势:(1)创伤小,非体外循环,不开胸;(2)基础麻醉,无需气管插管;(3)恢复时间短;(4)封堵时可以直接、有效地除外阻力性肺动脉高压,决定进一步治疗方案;(5)减少治疗费用。本研究的28例PDA合并有中-重度肺动脉高压的婴幼儿患者,由于PDA粗大,患儿均生长发育迟缓,身高、体重低于同龄儿,且重度营养不良。故而针对该类患儿的临床治疗应注意以下各项。
3.1 术前评估 术前行胸片、经胸彩超心动图、心电图、血气分析等检查[6]。如符合下述条件则可行介入封堵治疗。(1)胸片:排除合并有肺炎等不适合介入治疗的合并症;(2)经胸彩超心动图:左房、左室增大(说明容量负荷增加,仍以左向右分流为主),LVEF>50%;排除其他需要同期处理的心脏病;(3)心电图:排除恶性心律失常;(4)经股动脉抽血行血气分析:SpO2>95%,排查“差异性紫绀”。
3.2 术中诊疗要点 (1)靶血管穿刺。本组患儿年龄小、体重低、靶血管穿刺困难。为提高靶血管穿刺的成功率,我们建议:所有操作均在良好的麻醉状态下进行、减少禁食时间(术前禁食水4 h)、术前适当静脉补液、必要时在超声引导下穿刺。(2)术中操作规范、轻柔:患儿年龄小、体重低、血管及心脏组织脆弱,手术应严格按照操作流程进行;操作轻柔,避免因血管或心脏破裂导致的大出血或恶性心律失常等。(3)慎重选择封堵器及输送鞘管。患儿的靶血管内径小,如选择较大的输送鞘管或封堵器不但无法送达指定位置,而且还有可能造成严重的靶血管及心内膜损伤。而既往的研究表明,婴幼儿可采用输送鞘管外径与体重大小成正比,即最大静脉输送鞘管外径(F)约等于体质量指数[7];合并有中-重度肺动脉高压的患儿,由于主动脉-肺动脉的压力阶差减少导致左向右分流也随之减少,且动脉导管仅为肌性组织,在婴幼儿时期相对弹性更大,故在选择封堵器时要比实际测量值大(我们选择封堵器的标准:比PDA测量值大4~6 mm)[8-9]。(4)试封堵实验。每例患儿均应接受试封堵实验,试验过程中注意以下4点:①监测患儿生命体征变化,如生命体征不稳定则及时终止试验,撤回封堵器;②判别肺动脉高压的性质:既往针对合并有中-重度肺动脉高压的PDA患者,首先要进行右心导管吸氧试验检查判断肺动脉高压的性质。甚至还要进行肺血管舒张试验及肺组织活检来进一步明确诊断。术前超声心动图提示左房室大,股动脉血氧饱和,均提示肺动脉高压为动力性。故在本研究中简化了评估流程,直接通过试封堵实验来判别肺动脉高压的性质。如试封堵后肺动脉平均压下降>25%,则认为是动力性肺动脉高压,可行介入封堵治疗[2,10];③避免医源性降主动脉缩窄:试封堵后要监测升主动脉压及降主动脉压。研究表明,如两者之间的压差<20 mmHg,则释放封堵器后不会造成医院性降主动脉缩窄[11];在试封堵后的主动脉造影中应仔细观察封堵器的形态与位置,如降主动脉的血流明显受阻,则应撤回封堵器;④试封堵15~20 min后行主动脉造影,观察封堵器的形态、位置,是否合并残余分流,如合并大于微量的残余分流则应撤回封堵器。
3.3 术后处理要点
3.3.1 术后并发症的防治 PDA介入封堵术后常见的并发症为下肢静脉闭塞、下肢缺血坏死、溶血、血小板减少、封堵器移位或脱落、残余分流等[12]。本研究中仅有2例患儿出现微量残余分流(术后6个月内消失),均无其他介入相关并发症发生。为有效减少并发症的发生率应做到以下3点:(1)选择封堵器要综合考虑PDA大小、类型,封堵器的形态、位置,是否合并残余分流等;(2)术后下肢制动及加压包扎时间不宜过长,密切关注足背动脉搏动情况及是否水肿,及时予以松解;(3)术后24 h查尿常规,观察尿颜色,判断是否溶血,以便对症予以激素、碱化尿液等治疗,严重的情况下需要行外科手术取出封堵器[13-14]。介入治疗后特别是术前合并有肺动脉高压者,肺循环血流量减少、体循环血量增加,术后应注意左室运动情况,观察尿量,监测血钾、钠、氯等电解质的变化。
3.3.2 术后随访 介入治疗后24 h行经胸超声心动图、胸片、心电图、血常规、尿常规等检查。术后6个月复查经胸超声心动图。既往研究表明,大部分PDA患儿的肺动脉收缩压、左房直径、左室舒张末期直径在术后3~6个月内基本恢复正常[15-16]。本组研究结果与既往研究结论一致。其中有1例患儿术后24 h复查心脏彩超提示肺动脉收缩压为65 mmHg,规律予以波生坦降压治疗6个月后基本恢复正常。
综上所述,PDA合并中-重度肺动脉高压婴幼患儿病情重、体质差、长期呼吸道感染及生长发育不良等给临床治疗带来挑战。针对该类患儿术前做好认真评估,选择合适的适应证行介入治疗,术中严格按照规范操作,术后密切随访可取得满意的即刻及中期疗效。

