高糖对H9C2心肌细胞miR⁃26b表达的影响
周雨森,赵亚萍,赵 超,徐广峰,张乃键,汪春晖
0 引 言
高血糖能够导致糖尿病心肌病(diabetic cardio⁃myopathy,DCM),最终引起心力衰竭,是心血管疾病的独立危险因素。目前,DCM发病的分子生物学机制尚不明确。近年来,有研究发现微小RNA(mi⁃croRNA,miRNA)的改变与DCM的发生发展有关[1],miR⁃26b是一条与糖脂代谢密切相关的RNA,但其在DCM中的变化与作用目前鲜有报道。本研究小组首先探讨了野生型C57BL/6J小鼠体内多组织中miR⁃26b表达水平,随后检测了ob/ob小鼠心脏组织中miR⁃26b表达的变化,并利用不同浓度葡萄糖干预H9C2心肌细胞,观察葡萄糖浓度对心肌细胞miR⁃26b表达水平的影响。
1 材料与方法
1.1 实验材料12周龄SPF级雄性ob/ob小鼠8只,体重(65.08±3.19)g,12周龄雄性 C57BL/6J小鼠 8只,体重(30.75±1.73)g,实验动物合格证号:SCXK⁃20150001,均购买于南京大学动物模型研究中心,每4只小鼠放置于一个鼠笼内,每周消毒鼠笼1次,环境温度22℃,湿度50%,12 h明暗交替,进水无限制。H9C2心肌细胞株购自中国科学院上海生命科学研究院细胞资源中心。DMEM(25 mmol/L葡萄糖)细胞培养基、DMEM(5.5 mmol/L葡萄糖)细胞培养基、PBS缓冲液、胎牛血清、含0.1%EDTA的胰酶购自加拿大Wisent公司;CCK⁃8溶液购自日本DOJINDO公司;RNA抽提试剂盒、TRIzol试剂购自德国QIAGEN公司;逆转录试剂盒、Tanman gene ex⁃pression master MixⅡ、miRNA⁃26b探针及内参购自美国ABI公司。ABI7500定量PCR仪购自美国ABI公司,荧光显微镜购自日本Olympus公司,Nano⁃drop2.0核酸测定仪购自美国Thermo scientific公司,HF151UV细胞培养箱购自力康生物医疗科技控股有限公司,DKB⁃2006水浴箱购自上海精宏实验设备有限公司。
1.2 方法
1.2.1 H9C2细胞培养将H9C2心肌细胞复苏后,在含10%胎牛血清的DMEM(5.5 mmol/L葡萄糖)细胞培养基中培养(37℃,5%CO2培养箱)。待细胞贴壁生长至80%时,采用含0.1%EDTA的胰酶消化收集铺板进行后续实验。
1.2.2 CCK⁃8法检测细胞增殖将生长状态良好的H9C2心肌细胞以1×105个/mL接种于96孔板中,待细胞贴壁生长,采用无血清培养基饥饿12 h,予以不同浓度葡萄糖(5.5、15、25和35 mmol/L)干预 0、24、48、72、96、120h,更换为含10%CCK⁃8溶液的培养基,在37℃的CO2温箱内继续孵育培养50 min,酶标仪(Bio⁃Rad,iMark)上测定各孔吸光值(450 nm)。每组细胞设置6个复孔,并进行3次重复实验。
1.2.3 RNA抽提将ob/ob小鼠及C57BL/6J小鼠麻醉下处死,心、肝、脂肪组织、肾、骨骼肌、肺、脾、肠组织离体,分别PBS清洗各组织内血液,取适量组织,加入700 μL TRIzol液,电动匀浆机冰上匀浆15 s后,按照RNA抽提试剂盒中所述方法进行RNA抽提,并用Nanodrop 2.0核酸测定仪测定RNA浓度。H9C2心肌细胞予以不同浓度葡萄糖干预,分为4组(5.5 mmol/L葡萄糖组、15 mmol/L葡萄糖组、25 mmol/L葡萄糖组和35 mmol/L葡萄糖组),干预96 h收集细胞,其中5.5 mmol/L及25 mmol/L 组细胞于干预0、24、48、96和120 h收集,细胞收集后RNA抽提方法同上。
1.2.4 RT⁃PCR法检测miRNA⁃26b表达将已抽提好的RNA逆转录为cDNA,操作严格按说明书进行。使用Taqman荧光定量PCR探针在ABI7500定量PCR仪上检测miR⁃26b表达。荧光定量PCR反应体系及条件:Taqman MixII 10 μL,cDNA 1 μL,Taqman miR⁃26b探针 1 μL,灭菌双蒸水8 μL;50℃ 2 min,95℃ 10 min,(95℃ 15 s,60℃ 1 min)40个循环。使用ΔCT法计算miR⁃26b相对表达量。
1.3 统计学分析采用SPSS 16.0软件进行统计分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用q检验。以P≤0.05表示差异有统计学意义。
2 结 果
2.1 C57BL/6J小鼠组织miR⁃26b表达特征miR⁃26b在胰岛素靶器官心脏、脂肪、肝中表达水平均较高,其中在心脏中表达丰度最高,见图1。
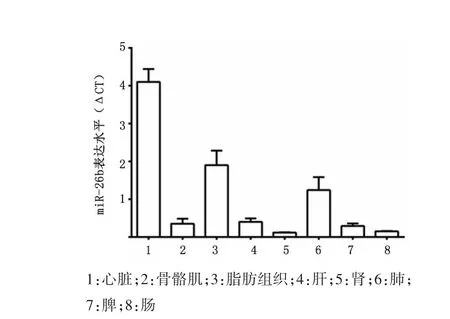
图1 C57BL/6J小鼠组织中miR⁃26b的表达水平Figure 1 Expression of miR-26b in the tissues of the C57BL/6J mouse
2.2 ob/ob小鼠心脏及胰岛素靶器官中miR⁃26b的表达变化与野生型C57BL/6J小鼠相比,ob/ob小鼠心脏及白色脂肪组织中miR⁃26b水平明显降低(P<0.05),而在肝中无明显变化,见图2。
2.3 不同浓度葡萄糖干预对H9C2心肌细胞增殖的影响与5.5mmol/L葡萄糖组比较,15、25及35 mmol/L 3组细胞 24、48、72、96、120 h增殖速度均显著增快(P<0.05);与15 mmol/L 葡萄糖组比较,25mmol/L 葡萄糖组24 h增殖速度较快(P<0.05),35 mmol/L 葡萄糖组48h增殖速度稍有降低(P<0.05),96h 25、35mmol/L葡萄糖组增殖速度稍有降低(P<0.05),35mmol/L 葡萄糖组 120h 增殖速度稍有降低(P<0.05);与25mmol/L 葡萄糖组比较,35mmol/L 葡萄糖组24、48h增殖速度均降低(P<0.05),见表1。
表1 不同浓度葡萄糖组不同时间H9C2心肌细胞增殖速度的比较(±s)Table 1 Proliferation of the H9C2 cardiomyocytes of the mice after treated with different concentrations of glucose for dif⁃ferent hours(±s)
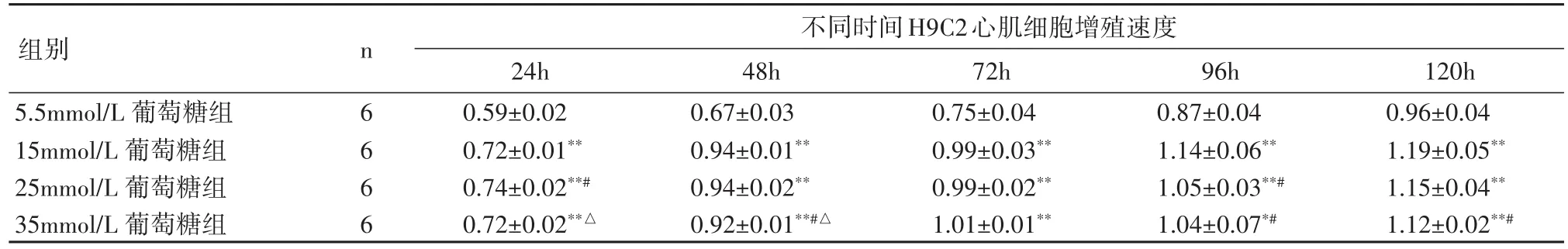
表1 不同浓度葡萄糖组不同时间H9C2心肌细胞增殖速度的比较(±s)Table 1 Proliferation of the H9C2 cardiomyocytes of the mice after treated with different concentrations of glucose for dif⁃ferent hours(±s)
与5.5mmol/L 葡萄糖组相比,*P<0.05、**P<0.01;与15mmol/L 葡萄糖组相比,# P <0.05;与25mmol/L 葡萄糖组相比,△P <0.05
组别5.5mmol/L 葡萄糖组15mmol/L葡萄糖组25mmol/L葡萄糖组35mmol/L葡萄糖组n 6 6 6 6不同时间H9C2心肌细胞增殖速度24h 0.59±0.02 0.72±0.01**0.74±0.02**#0.72±0.02**△48h 0.67±0.03 0.94±0.01**0.94±0.02**0.92±0.01**#△72h 0.75±0.04 0.99±0.03**0.99±0.02**1.01±0.01**96h 0.87±0.04 1.14±0.06**1.05±0.03**#1.04±0.07*#120h 0.96±0.04 1.19±0.05**1.15±0.04**1.12±0.02**#
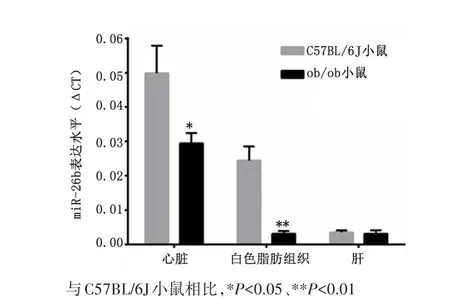
图2 ob/ob小鼠心脏及胰岛素靶器官中miR⁃26b的表达变化Figure 2 Expression of miR-26b in the heart and insulin target organs of the ob/ob mouse
2.4 不同浓度葡萄糖对心肌细胞中miR⁃26b表达的影响与5.5 mmol/L葡萄糖组比较,25、35 mmol/L葡萄糖组细胞中miR⁃26b水平显著下调(P<0.05),而15 mmol/L葡萄糖组差异无统计学意义(P>0.05),见图3。
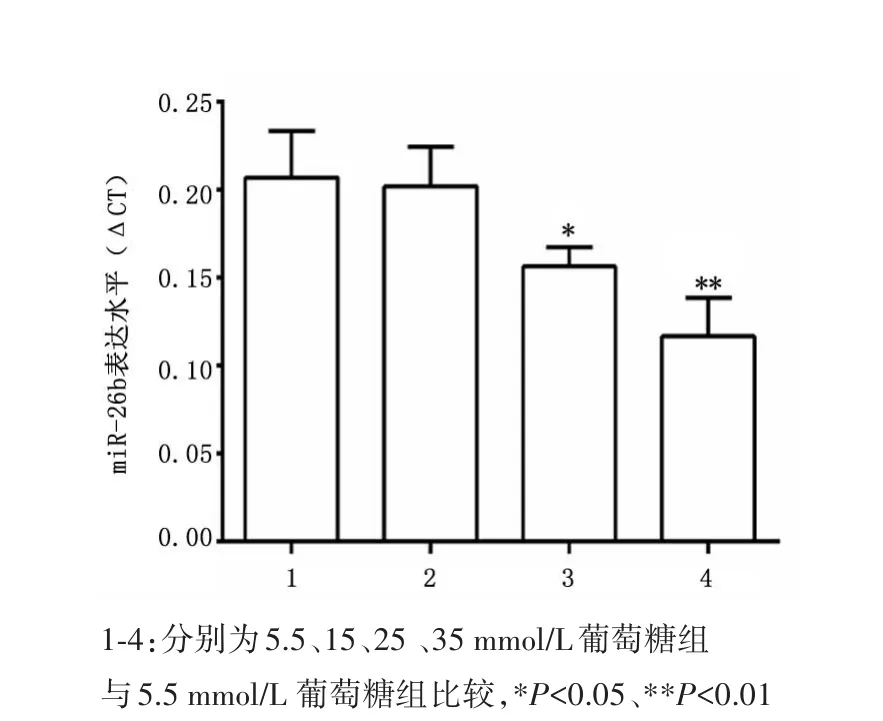
图3 不同浓度葡萄糖干预对H9C2心肌细胞中miR⁃26b表达的影响Figure 3 Expression of miR⁃26b in the H9C2 cardiomyo⁃cytes of the mice after treated with different con⁃centrations of glucose
2.5 25 mmol/L葡萄糖干预不同时间对心肌细胞miR⁃26b表达的影响与0 h的miR⁃26b表达水平比较,96、120 h的miR⁃26b表达水平明显降低(P<0.05),见图4。
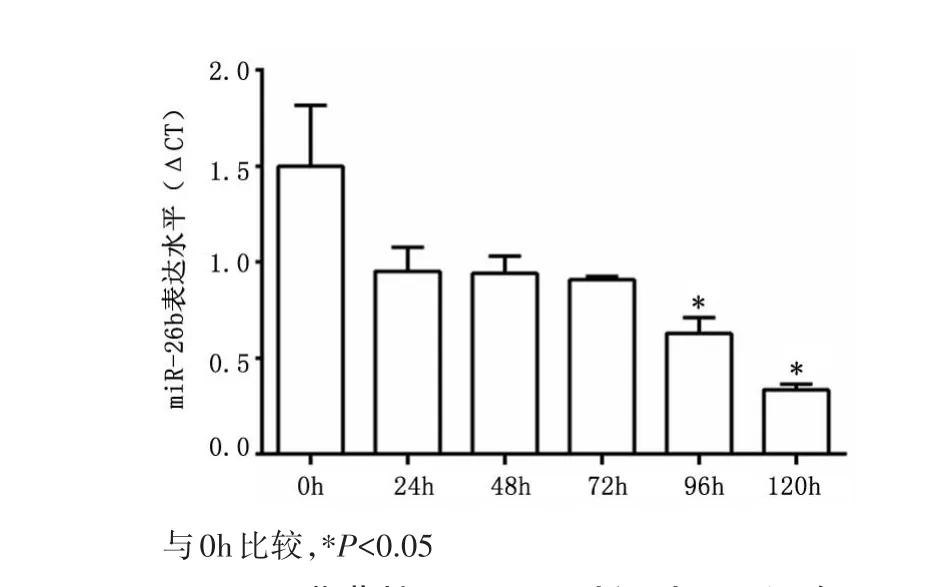
图4 25 mmol/L葡萄糖干预不同时间对心肌细胞miR⁃26b表达的影响Figure 4 Expression of miR⁃26b in the H9C2 cardiomyo⁃cytes of the mice after treated with 25 mmol/L glucose for different hours
3 讨 论
DCM是指糖尿病患者在排除冠状动脉疾病或高血压等心血管疾病后,所发生的特异性心肌结构与功能的异常,其特点是心室扩张、心肌肥厚,左心室舒张及收缩功能降低,最终发展为心力衰竭[2-3]。大量的研究发现,糖脂代谢紊乱、微循环病变、胰岛素抵抗、间质纤维化、心脏自主神经病变等均参与了DCM的发生发展,但有关DCM发病的具体机制仍尚不明确。近年来,越来越多的研究发现miRNA在DCM的发病过程中发挥着重要的作用[4⁃5]。miR⁃NA是广泛存在于真核生物体内的一类长度约为19~22 nt的非编码 RNA[6],在转录后水平参与调节生长发育、细胞增殖、细胞凋亡、糖脂代谢等生命进程。有研究发现,缺氧诱导的心肌细胞损伤模型中,miR⁃455表达水平增高,且过表达miR⁃455可引起心肌细胞内 caspase⁃12等凋亡相关指标上调[7]。在高糖环境下培养的小鼠心肌细胞miR⁃30c和miR⁃181a表达下调,激活p53/p21通路,可诱导心肌细胞凋亡[8]。在药物诱导的糖尿病小鼠心脏中,miR⁃195表达上调,通过沉默miR⁃195,可减弱氧化应激、抑制心肌肥厚、改善冠状动脉血流量,从而改善心脏功能[9]。在高血糖条件下,人心室肌细胞内ELAVL1表达增加,同时伴随着caspase⁃1及白细胞介素1β的水平增加,通过过表达miR⁃9可降低高血糖诱导的ELAVL1,并抑制心肌细胞凋亡[10]。本研究发现,在C57BL/6J小鼠脂肪组织、肝、心脏等多个器官中均有miR⁃26b的表达,且在心脏中表达丰度最高,提示miR⁃26b可能参与心肌细胞代谢生理病理过程。
miR⁃26b是miR⁃26家族中的一个亚型,在不同细胞的病理生理过程中发挥着重要的作用。有研究表明,葡萄糖可诱导人脂肪细胞内miR⁃26b的表达下调[11]。在压力负荷诱导的心肌细胞肥大模型中,miR⁃26b表达下调,且 miR⁃26b可通过抑制GSK3β信号通路,改善心肌细胞肥大[12⁃13]。有研究表明,DCM所呈现的心室扩张、心肌收缩功能障碍与扩张性心肌病的临床表现相似,扩张性心肌病患者心肌纤维变性与循环中miR⁃26的改变有关[14],而长期高血糖所导致的DCM心肌功能障碍是否与miR⁃26有关尚有待研究。另有研究发现,miR⁃26b能够显著增加糖尿病模型鼠体内的胰岛素敏感性[15]。这些研究表明,miR⁃26b参与了心肌细胞病理过程的发展,且与胰岛素敏感性密切相关,而高血糖可能影响胰岛素靶器官中miR⁃26b的表达。糖尿病患者机体通常处于胰岛素抵抗状态,而ob/ob小鼠是一类肥胖、高血糖、胰岛素抵抗模型鼠,故本研究采用了ob/ob小鼠作为实验对象,探讨其胰岛素靶器官中miR⁃26b表达水平的变化,结果发现与野生型C57BL/6J小鼠比较,ob/ob小鼠心脏、白色脂肪组织miR⁃26b的表达显著下调,据此,我们推测高糖可能会引起心肌细胞内miR⁃26b降低。
在本研究中,H9C2心肌细胞在15 mmol/L葡萄糖培养24 h即出现明显的增殖加快、活力增强,这种变化趋势与DCM所呈现的心肌肥厚是一致的。我们同时发现高浓度葡萄糖可显著下调心肌细胞中miR⁃26b表达水平,干预24 h后即有变化,以25mmol/l葡萄糖干预96h变化最为显著。有学者发现,miR⁃26b参与了人前体脂肪细胞增殖过程,沉默miR⁃26b可促进前体脂肪细胞增生,而过表达miR⁃26b可以抑制脂肪细胞增生[16⁃17]。提示miR⁃26b可能参与了心肌细胞增殖过程,这是否与DCM心肌肥厚的发生有关尚待进一步研究。
综上所述,在小鼠心脏组织中存在较高丰度的miR⁃26b表达,而ob/ob小鼠心脏中miR⁃26b表达水平显著降低,高浓度的葡萄糖可显著下调H9C2细胞中miR⁃26b表达水平。提示高糖诱导的心肌细胞miR⁃26b表达下调可能参与DCM的发病过程。

