人主动脉平滑肌细胞感染甲型和乙型流感病毒后细胞因子表达的变化
朱紫衣,王文博,江忠勇,刘 媛,常 凯,叶雨笙,熊 杰
0 引 言
流感病毒是呼吸道感染的重要病原体,在全球范围内流行,既往爆发的流感病毒感染对全球人类的生命安全造成了极大的危害[1]。流感病毒宿主范围广,感染发病率高、传染性强,加之流感病毒自身易于变异的特点,使其成为了目前全球难以治疗的病原之一[2⁃3]。既往研究表明,流感病毒感染是急性心肌梗死以及心血管疾病发生的重要诱因[4],且在动脉粥样硬化(Atherosclerosis,AS)患者颈动脉斑块中检出了流感病毒RNA,是影响心血管系统的重要证据[5]。血管平滑肌细胞为AS病变组织的主要细胞之一,流感病毒感染人主动脉平滑肌细胞(hu⁃man aortic smooth muscle cells,HASMCs)及对其细胞因子的表达影响报道较少。因此本研究采用甲型流感病毒(Influenza A Virus,IAV)、乙型流感病毒(Influenza B Virus,IBV)刺激HASMCs,检测病毒在细胞内的感染及复制能力,并检测病毒感染是否会引起平滑肌细胞细胞因子表达改变。
1 材料与方法
1.1 材料HASMCs购于美国ScienCell公司,培养于SMCM全培养基,内含2%胎牛血清、1%生长因子、100 μL/mL链霉素和 100 U/mL青霉素,置于37℃、5%CO2相对饱和湿度的细胞培养箱中进行培养,待细胞生长至融合,按1∶2进行传代,取对数生长期的3~5代细胞进行实验。流感病毒由本实验室保存,分离自流感感染者咽拭子标本。SMCM培养基、胎牛血清、胰蛋白酶、100U/mL青霉素和100μL/mL链霉素均购自美国ScienCell公司,CCK8细胞增殖和毒性检测试剂盒及Trizol试剂盒购自北京全式金生物技术有限公司,实时定量PCR试剂盒购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 免疫荧光检测流感病毒对HASMCs的感染情况HASMCs按1×104个/孔接种96孔板,24 h后分别加入IAV、IBV,分别为甲型组、乙型组,另设对照组(不加病毒)。感染24 h后弃上清,PBS洗涤2遍,加入甲醇100 μL/孔,置于-20℃冰箱固定20 min,PBS洗1遍,加入3%BSA,室温封闭2 h,加入100μL抗流感病毒核蛋白抗体(1∶1000),室温孵育2 h后,PBS洗涤3次,加入二抗,避光孵育40 min,PBS洗2遍,荧光显微镜观察并拍照。
1.2.2 流感病毒对HASMCs生长增殖的影响采用CCK8法。将HASMCs按1×l04个/孔接种96孔板,贴壁后分别加入0.5、1.0、2.0MOI流感病毒,继续培养至预定时间点,每孔加入培养基总体积10%的CCK8溶液,在培养箱中继续培养2h,用酶标仪测定450 nm处的吸光值。并用结晶紫对细胞进行染色拍照。
1.2.3 流感病毒感染HASMCs的复制情况以及对细胞生长状态的影响IAV、IBV感染HASMCs,24h后去上清,用PBS洗3遍,加入新鲜的培养基,分别收集第2、3、4天的培养上清50μL,用Real⁃time PCR检测上清中的病毒RNA水平,并用其中10 μL上清液感染MDCK细胞,免疫荧光检测流感病毒核蛋白。此外,甲型组、乙型组在病毒感染细胞24h后取上清液,PBS洗2遍,分别加入流感病毒生长液及普通培养基,检测上清液中的病毒水平。
1.2.4 流感病毒感染HASMCs后细胞因子表达的检测采用Rea1⁃time PCR法。将HASMCs细胞按1×l04个/孔接种96孔板,培养24 h后,以0.5 MOI病毒刺激HASMCs,以未加流感病毒作为对照,培养24 h后,用Trizol试剂抽提细胞总RNA,进行PCR扩增。
1.2.5 Real⁃time PCR按照Trizol试剂盒说明书操作,提取待测细胞总RNA,并以之为模板采用Taqman探针法进行qPCR扩增反应。以GAPDH作为内参基因,反应条件为:42℃15 min,95℃1 min,94℃ 5 s,60℃ 20 s,循环进行 40次。基因的表达水平采用2⁃ΔΔCt法表示。所用引物均由上海生工生物工程技术服务有限公司合成,GAP⁃DH引物序列正向:5′⁃CCACTCCTCCACCTTTGAC⁃3′,反向:5′⁃ACCCTGTTGCTGTAGCCA⁃3′,探针:5′⁃FAM⁃TTGCCCTCAACGACCACTTTGTC⁃BHQ1⁃3′。IAV引物序列正向:5′⁃GACCRATCCTGTCACCTCTGAC⁃3′,反向:5′⁃AGGGCATTYTGGACAAAKCGTCTACG⁃3′,探针:5′⁃FAM ⁃TGCAGTCCTCGCTCACTGGGCACG ⁃BHQ1⁃3′。IBV引物序列正向:5′⁃TCCTCAACT⁃CACTCTTCGAGCG⁃3′,反 向 :5′⁃CGGTGCTCTT⁃GACCAAATTGG⁃3′,探针:5′⁃FAM⁃CCAATTCGAG⁃CAGCTGAAACTGCGGTG⁃BHQ1⁃3′。IL⁃6引物序列正向:5′⁃CTGCAGAAAAAGGCAAAGAATCTAG⁃3′,反向:5′⁃CGTCAGCAGGCTGGCATT⁃3′,探针:5′⁃FAM⁃TGCAATAACCACCCCTGACCCAACC ⁃BHQ1⁃3′。TNF⁃α 引物序列正向:5′⁃GCTGCACTTTGGAGT⁃GATCG ⁃3′,反向:5′⁃GTTTGCTACAACATGGGCTA⁃CAG⁃3′,探针:5′⁃FAM⁃CCCAGGCAGTCAGAT⁃CATCTTCTCGA⁃BHQ1⁃3′。MCP⁃1引物序列正向:5′⁃CCCTTCTGTGCCTGCTGCTC⁃3′,反向:5′⁃GGA⁃CACTTGCTGCTGGTGATTCT⁃3′,探针:5′⁃FAM⁃CAGCCACCTTCATTCCCCAAGGGCT⁃BHQ1 ⁃3′。
1.3 统计学分析采用SPSS 19.0软件进行统计学分析。定量资料用均数±标准差(±s)表示,组间比较采用独立样本t检验,多组间均值比较采用方差分析,组间两两比较采用LSD法。以P≤0.05为差异有统计学意义。
2 结 果
2.1 流感病毒对HASMCs感染和增殖的影响HASMCs感染不同滴度的IAV、IBV,细胞内流感病毒蛋白表达均为阳性,见图1。CCK8实验结果显示,HASMCs感染流感病毒后第1、2天,甲型组、乙型组细胞增殖与对照组比较差异无统计学意义(P>0.05);第3、4天,甲型组、乙型组细胞增殖较对照组明显减慢(P<0.05)。见图 2。结晶紫染色发现,HASMCs感染IAV、IBV后细胞分泌物明显增多,细胞形态紊乱。免疫荧光法显示2种流感病毒感染HASMCs的上清后,仍能感染新的HASMCs,产生新的感染性病毒颗粒。
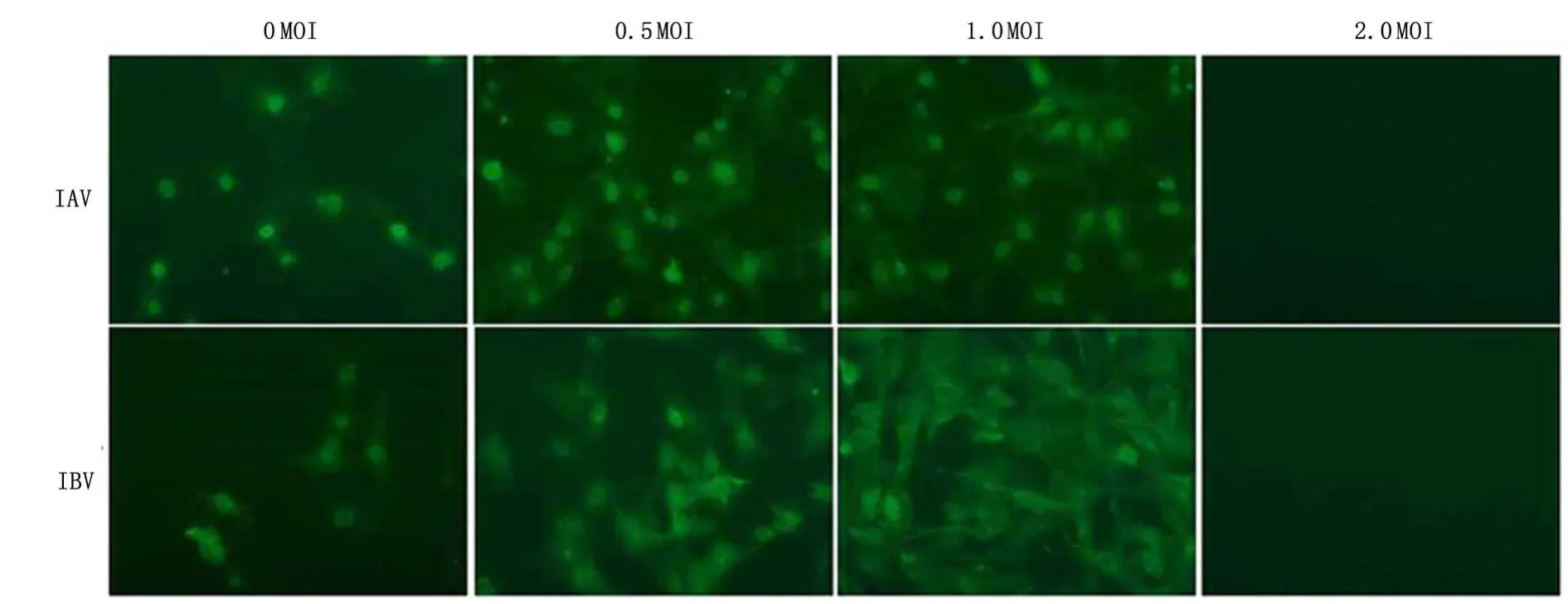
图1 免疫荧光法检测HASMCs中的流感病毒核蛋白(×100)Figure 1 Nucleoprotein of the influenza virus in the human aortic smooth muscle cells detected by immunofluorescence as⁃say(×100)
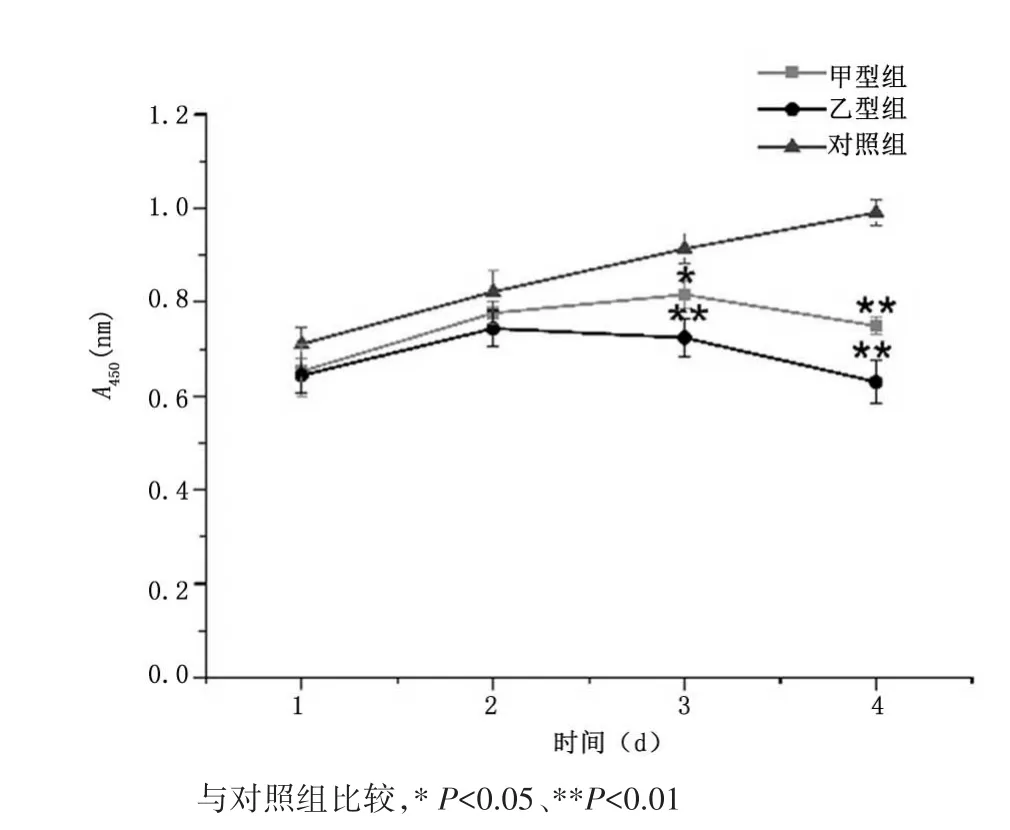
图2 HASMCs感染流感病毒后各组细胞增殖随时间的变化比较Figure 2 Proliferation of the human aortic smooth musclecells at different days after infection
2.2 流感病毒感染HASMCs后的复制及产毒情况第3天,甲型组RNA表达量较第2天明显增加(P<0.05),第 4天 RNA 表达量较第 3天明显下降,(P<0.01)。第3、4天,甲型组RNA水平较第2天升高,差异无统计学意义(P>0.05),见表1。不同时间点收集的上清液感染的MDCK细胞内可以检测到流感病毒核蛋白的表达,再次证明新产生的病毒颗粒具有感染性,见图3。
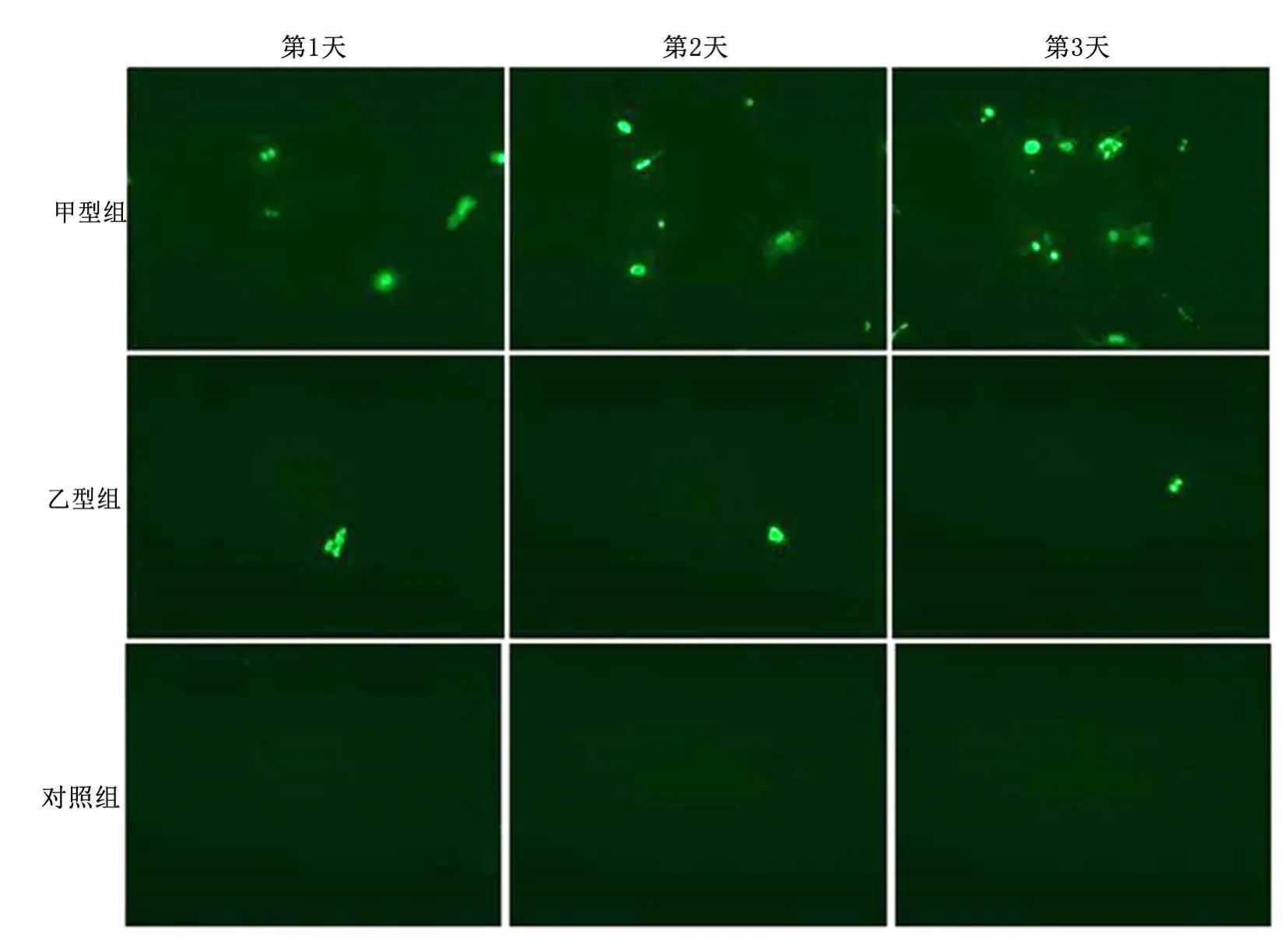
图3 免疫荧光法检测不同时间点感染上清液对MDCK的感染情况(×100)Figure 3 Infection of the Madin⁃Darby canine kidney(MDCK)cells at different days after infection of the supernatant(×100)
表1 不同时间点上清液中病毒RNA水平(±s)Table 1 Expression of virus RNA in the supernatant at different days after infected with IAV or IBV(±s)
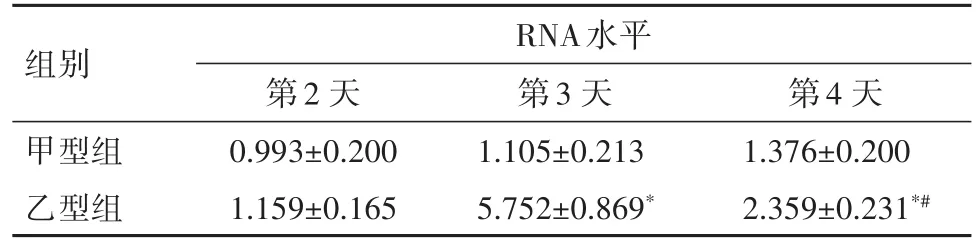
表1 不同时间点上清液中病毒RNA水平(±s)Table 1 Expression of virus RNA in the supernatant at different days after infected with IAV or IBV(±s)
与组内第2 天比较,*P<0.05,与组内第3天比较,#P<0.05
组别甲型组乙型组RNA水平第2天0.993±0.200 1.159±0.165第3天1.105±0.213 5.752±0.869*第4天1.376±0.200 2.359±0.231*#
2.3 不同生长条件对流感病毒复制的影响甲型组正常培养基、病毒生长液IAV RNA水平分别为0.842±0.148、15.182±1.932,差异有统计学意义(P<0.01)。乙型组正常培养基、病毒生长液IBV RNA水平分别为0.962±0.033、4.029±0.681,差异有统计学意义(P<0.01)。
2.4 流感病毒对HASMCs细胞因子表达的影响甲型组、乙型组IL⁃6、TNF⁃α、MCP⁃1表达较对照组均明显增高(P<0.05)。见表2。
表2 流感病毒感染HASMCs对细胞因子表达的影响(±s)Table 2 Expressions of the cytokines IL⁃6,TNF⁃α and MCP⁃1 in the human aortic smooth muscle cells in different groups(±s)
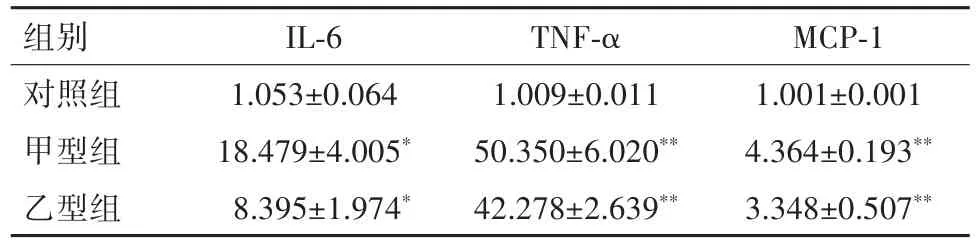
表2 流感病毒感染HASMCs对细胞因子表达的影响(±s)Table 2 Expressions of the cytokines IL⁃6,TNF⁃α and MCP⁃1 in the human aortic smooth muscle cells in different groups(±s)
与对照组比较,*P<0.05、**P<0.01
组别对照组甲型组乙型组IL⁃6 1.053±0.064 18.479±4.005*8.395±1.974*TNF⁃α 1.009±0.011 50.350±6.020**42.278±2.639**MCP⁃1 1.001±0.001 4.364±0.193**3.348±0.507**
3 讨 论
流感病毒属于正粘病毒科,是有包膜的单负链分节段的 RNA 病毒[6⁃8],大量流行病学调查证明流感病毒感染与AS存在相关性,流感病毒感染可以促进AS的发生发展[9⁃10]。AS作为一种慢性疾病,血管平滑肌细胞的增殖、泡沫化以及炎症反应在其发生发展中发挥了重要作用[11]。本研究发现流感病毒可以感染HASMCs,且抑制细胞增殖,流感病毒对平滑肌细胞有明显的细胞毒性。
本研究显示流感病毒感染HASMCs 24 h后,更换新鲜培养基,上清均可检测到2种病毒,且病毒水平呈增高趋势,尤其是IAV。而上清液可以感染MDCK细胞,说明流感病毒感染HASMCs后产生了新的感染性病毒颗粒。进一步的研究证明流感病毒感染HASMCs后,将培养基更换为含TPCK⁃胰酶的病毒生长液能够显著提高上清液中IAV、IBV RNA水平。TPCK⁃胰酶可使胰凝乳蛋白酶失活,提高胰蛋白酶活性和稳定性,裂解新产生的病毒血凝素,有利于流感病毒在宿主细胞的释放。本研究发现使用含TPCK⁃胰酶的病毒生长液维持细胞生长时,上清中IAV、IBV RNA水平显著提高。说明流感病毒不仅可感染HASMCs,且可以产生新的病毒颗粒,但可能由于平滑肌细胞不分泌或极少分泌这种胰蛋白酶,导致病毒不能完全释放至上清液。
AS的发生与心血管和脑血管疾病密切相关,如急性心肌梗死、脑卒中等[12]。近年来,Ross提出的炎症假说逐渐被认同,慢性炎症贯穿于AS发生、发展的各个环节[13]。血管壁慢性炎症是导致AS的重要因素[14],既往研究表明TNF⁃α能促进极低密度脂蛋白表达、降低高密度脂蛋白水平并导致胰岛素抵抗以及糖脂类代谢异常;引发内皮细胞功能障碍;还可发挥促炎作用,促进炎症因子生成,从而加速AS的形成和发展[15]。IL⁃6可刺激血小板聚集,促进粘附因子的表达,参与AS炎症过程,促进斑块的发展和破裂[16];临床研究也表明IL⁃6表达增高与AS的发生有关[17]。趋化因子MCP⁃1可通过趋化外周血中的巨噬细胞向动脉壁内膜损伤部位迁移、聚集,并促进平滑肌细胞增殖、迁移,加重动脉损伤[18]。本研究中IAV、IBV感染HASMCs后,炎症因子IL⁃6、TNF⁃α、MCP⁃1表达均明显增高,这也说明流感病毒感染可能通过引起细胞因子表达增高,参与AS的发生发展。
综上所述,本研究发现IAV、IBV可以感染HASMCs,抑制细胞增殖,并产生新的感染性病毒颗粒,引起细胞因子表达增加,但其导致细胞毒性和炎性改变的机制还有待于进一步研究说明。

