Designing an Organic Acceptor with Unsymmetrical Structure Based on Rhodanine and Thiazolidine-2,4-dione Units to Study the Structure-Property Relationship
YANG Yang , JIANG Xiu , ZHAN Xiaowei , CHEN Xingguo ,*
1Hubei Key Laboratory on Organic and Polymeric Opto-electronic Materials, College of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430072, P. R. China.
2 Department of Materials Science and Engineering, College of Engineering, Peking University, Beijing 100871, P. R. China.
Abstract: As reported previously, rhodanine and thiazolidine-2,4-dione units have been widely used as the terminal group to construct the efficient non-fullerene small molecular acceptors with the structure of A1-A2-D-A2-A1.Compared with the acceptor using thiazolidine-2,4-dione unit as the terminal group, the acceptor with rhodanine unit as the terminal electron-withdrawing group usually showed the improved short circuit current density (Jsc) and fill factor (FF) as well as the higher power conversion efficiency (PCE), regardless of the lower open circuit voltage (Voc). However, the causes of difference are still not very clear. Therefore, in this work, an unsymmetrical organic acceptor(IDT-2) has been designed and synthesized with rhodanine and thiazolidine-2,4-dione units as the electron-withdrawing terminal groups to connect an indacenodithiophene (IDT) central core,respectively. By comparing with the two analogues of the symmetrical organic acceptors based on rhodamine unit (IDT-1)or thiazolidine-2,4-dione unit (IDT-3) as the terminal group, the structure-property relationship has been investigated for this series of acceptors. It is found that as two rhodamine terminal groups are replaced step by step with the thiazolidine-2,4-dione unit from IDT-1 to IDT-3, the ICT absorption of these small molecular acceptors is significantly blue-shifted from 633 (soln)/656 (film), 618/645 to 603/625 nm, and the corresponding optical band gap (Egopt) is also gradually widened from 1.68, 1.71 to 1.77 eV for IDT-1, IDT-2 and IDT-3, respectively, which can be attributed to the introduction of thiazolidine-2,4-dione unit to reduce the stability of quinoid structure of the conjugation backbone. At the same time, the LUMO/HOMO (the lowest unoccupied molecular orbital/the highest occupied molecular orbital) energy levels of the molecules are gradually uplifted to be -3.62/-5.58, -3.60/-5.56, and -3.57/-5.53 eV, respectively, which is generally beneficial for the improvement of the Voc due to the upshifted LUMO energy levels of the acceptors. Considering the complementary absorption and well-matched energy levels of the donor and acceptor, the regioregular poly(3-hexylthiophene) (P3HT) has been chosen as a donor to fabricate the devices with three small molecular acceptors,respectively, and the corresponding photovoltaic performances have been evaluated and compared. The device based on IDT-1 with two rhodamine terminal groups gives the best PCE of 4.52% with the lowest Voc of 0.87 V, the highest FF of 70.66% and Jsc of 7.37 mA∙cm-2, while the device based on IDT-3 with two thiazolidine-2,4-dione terminal groups shows the poorest PCE of 3.40% with the highest Voc of 0.98 V but the lowest FF of 59.70% and Jsc of 5.82 mA∙cm-2. As for IDT-2 with an unsymmetrical structure, it contains a thiazolidine-2,4-dione terminal group and a rhodamine terminal group at the two sides of the molecule. It can be seen that the IDT-2 based device just shows a PCE of 4.07% with a Voc of 0.91 V, a FF of 64.65% and a Jsc of 6.81 mA∙cm-2, all of which are between those of the devices based on IDT-1 and IDT-3.These results indicate that the thiazolidine-2,4-dione unit is an effective terminal group to enhance the Voc of the device but is not beneficial to the improvement of the Jsc and FF. Furthermore, when designing the structure of the acceptors, it is very important to maintain the balance of all the three parameters to maximize the PCE in the OSCs.
Key Words: Unsymmetric structure; Rhodanine unit; Thiazolidine-2,4-dione unit; Small molecule acceptor;Organic solar cells
1 引言
有机太阳能电池具有质量轻、成本低以及可大面积柔性制备等优点,在未来的清洁能源领域具有十分广阔的应用前景1-5。最近几年来,对于非富勒烯受体的研究成为了有机太阳能电池领域的研究热点,这是因为非富勒烯小分子受体的电化学性质以及光伏性能可以通过结构的修饰得到有效的调整。得益于新型非富勒烯受体的快速发展,有机太阳能电池的能量转化效率(PCE)取得了巨大的进步6-13。与此同时,基于聚(3-己基噻吩)(P3HT)的有机太阳能电池具有价格低廉、性能稳定等特点,也是有机太阳能电池研究领域的热点之一。作为一种被大众所熟知并被广泛应用于有机光伏的有机聚合物给体材料,P3HT有许多的优点。P3HT能用一系列简单的方法合成,并且是目前唯一一例合成量超过10 kg的聚合物,这使其在大面积有机太阳能电池中的应用成为可能14,15。另外,P3HT具有良好的空气稳定性,能在空气下制备器件,并保持高的效率16。然而P3HT的最高占据分子轨道(HOMO)能级较高,以富勒烯衍生物(如PC61BM)作为受体时,器件的开路电压(Voc)仅为0.6 V左右,不利于器件PCE的提高。为获得较高的Voc和PCE,设计高性能非富勒烯受体至关重要。
最近,通过设计合成新型非富勒烯小分子受体,使基于P3HT为给体的有机太阳能电池效率有了很大的提高。例如,陈红征课题组17以螺芴为核、苯为端基、吡咯并吡咯二酮为π-桥合成了一例具有高的最低未占据分子轨道(LUMO)能级的非富勒烯小分子受体SF(DPPB)4。以P3HT为给体,SF(DPPB)4为受体制备的有机太阳能电池,不仅获得了较高的PCE,高达5.16%,同时获得了1.14 V的Voc17。2016年,陈永胜课题组18同样以螺芴为核、以绕丹宁或2-(1,1-二氰基亚甲基)绕丹宁为端基合成了两例具有3D结构的小分子受体SF-OR和SF-ORCN。这种新的受体拥有可逆的电化学反应以及较高的吸光系数。以P3HT为给体,SF-OR和SF-ORCN为受体的电池器件都具有较高的PCE,分别为4.66%和4.48%18。
目前,在众多基于P3HT为给体的非富勒烯太阳能电池中,研究较多并且性能较好的受体体系是以IDT为核,以经典的受体单元如苯并噻二唑或苯并三氮唑为π-桥、绕丹宁为端基的A2-A1-D-A1-A2结构体系。2015年,占肖卫课题组19设计并合成了一例新的平面小分子受体IDT-2BR,并以其为受体,与P3HT为给体构建活性层,相应太阳能电池器件的光电转化效率(PCE)达到了5.12%,远高于以富勒烯PC61BM为受体的电池效率19。2016年,McCulloch等16报道了一例新的非富勒烯受体IDTBR。其吸收光谱与P3HT能形成良好的互补,因此以IDTBR为受体,P3HT为给体制备的有机太阳能电池器件的光电转化效率能达到6.4%且展现了良好的空气稳定性16。另外,他们以P3HT为给体,两个小分子IDTBR和IDFBR为受体,制备的三元共混太阳能电池器件的效率高达(7.7 ±0.1)%,是迄今为止以P3HT为给体的太阳能电池的最高效率20。周二军同样以IDT为核,以苯并三氮唑为桥连单元,绕丹宁封端,设计的小分子受体BTA1,具有较高的LUMO能级,其电池器件不仅获得了较高的开路电压,同时PCE值也达到了5.24%21。
与此同时,端基结构的修饰与调整是一种调节分子能级和光伏性能的简单有效的方法之一。众所周知,S原子与O原子相比,S原子的电子云更加松散,更容易被极化8。同时,S原子空的3d轨道能与C=C双键的p轨道形成pπ(C)-dπ(S)轨道重叠,所以S原子与O原子相比,S原子具有一定的π电子接受能力22,23。因此,若将分子中某些基团的S原子换为O原子,共轭分子的光电性能会发生较大的变化。例如,将绕丹宁基团中的硫羰基(C=S)替换成羰基(C=O)后形成的噻唑烷-2,4-二酮基团,以其作为端基能有效抬高分子的LUMO能级,光伏性能也发生相应的变化。例如,周二军等24以IDT为核,以苯并三氮唑为桥连单元,以噻唑烷-2,4-二酮为端基代替绕丹宁合成的小分子受体BTA2,与绕丹宁作为端基的小分子BTA1相比,BTA2拥有更高的LUMO能级和HOMO能级,电池器件取得了更高的Voc,高达1.22 V。随后,他们同样以噻唑烷-2,4-二酮作为端基,以苯并噻二唑为π-桥,以直链烷基为侧链的IDT为核,设计的小分子受体BT2b,电池效率得到进一步提高,达到了6.08%,同时开路电压也能达到0.92 V25。总之,噻唑烷-2,4-二酮作为端基能有效地提高小分子受体的LUMO能级,从而使相应太阳能电池器件的Voc得到提升。但是,由于各种未知的原因,以绕丹宁为端基的小分子受体均具有更高的短路电流密度(Jsc) 16,19,21,24,25。
因此,本文中我们以IDT为核,苯并噻二唑为π-桥,一端键连绕丹宁基团,另一端则键连噻唑烷-2,4-二酮单元,合成了一种新型不对称结构小分子受体IDT-2。同时,合成了两端均为绕丹宁基团(IDT-1)或噻唑烷-2,4-二酮基团(IDT-3)的两个对称结构分子与之进行对比,较系统地研究了这一系列分子中作为端基的绕丹宁与噻唑烷-2,4-二酮结构单元的变化对受体分子的光物理性质、电化学性能的影响。同时,进一步探究了以这一系列IDT-X分子为受体、P3HT为给体的有机太阳能电池器件的光伏性能差异。
2 实验部分
2.1 仪器与方法
核磁共振谱(1H-NMR和13C-NMR)采用Bruker AVANCE III HD 400MHz型核磁共振波谱仪测定。ESI-MS和MALDI-TOF质谱分别采用Varian 320-MS (EI)和Applied Biosystems 4700 proteomics Analyzer 155质谱仪器测得。小分子的热重分析(TGA)在氮气气氛下并使用试验设备NETZSCH STA449C且升温速率为每分钟10 °C测试得到。元素分析的结果通过73 CARLOERBA-1106测试得到。紫外-可见吸收光谱仪(UV-Vis)的仪器型号为Shimadzu UV-2500型,分子光学带隙()的计算公式为= 1240/λ (λ为小分子薄膜吸收的吸收边)。循环伏安(CV)采用三电极体系,在CHI760型电化学工作站进行测量。三电极分别为玻碳电极(工作电极),Ag/AgCl电极(参比电极),Pt电极(对电极)。电解质为0.1 mol·L-1Bu4NPF6的乙腈溶液。二茂铁为标准物。
文中太阳能电池器件结构为ITO/PEDOT:PSS/P3HT:IDT-X/Ca/Al。铟锡氧化物(ITO)玻璃片(10 Ω,85%透明度)通过超声波清洗机清洗。清洗所使用的溶剂顺序为洗涤剂水溶液、超纯水、丙酮和异丙醇。ITO玻璃片放在恒温烘箱中烘干(150 °C,5 min)。清洗后的玻璃片放在紫外臭氧清洗机(42-220,Jelight Co. Inc.)中处理25 min。将PEDOT:PSS (Baytron PVP AI 4083, 德国) 旋涂在ITO玻璃片上作为空穴传输层,转速为4000 r·min-1,膜厚为30 nm。完成后,玻璃片放在烘箱中退火,150 °C,20 min。P3HT与小分子受体(IDT-X)按一定的质量比(如最佳质量比为1 : 0.6)共混后,以邻二氯苯(o-DCB)为溶剂,总浓度为25 mg·mL-1,制备成共混溶液。在手套箱中,将溶液旋涂在PEDOT:PSS作为活性层。活性层旋涂完成后,玻璃片转入真空室中,真空度大约为5.0 × 10-5Pa。钙和铝先后蒸镀在活性层上,作为负极。钙和铝的厚度分别为20和80 nm。J-V曲线是通过计算机控制的安捷伦 B2912A精密源表测量单元测试得到。以太阳光模拟器(日本三永有限公司,AAA级,70 mm × 70 mm)加上AM1.5G太阳光谱过滤器用作光源,光功率为100 mW·cm-2,以多晶硅为标准电池(SRC-1000-TC-QZ,VLSI Standards Inc.),器件面积为 4 mm2。EQE谱是用太阳能电池光谱响应测量系统 QE-R3011 (台湾光炎有限公司)测试得到的,每个波长的光强度都是由标准多晶硅太阳能电池校正。载流子迁移率测试使用的是空间限制电流法。小分子受体与P3HT共混膜的迁移率测试过程:将小分子受体与P3HT共混后,溶于o-DCB制成共混溶液,在手套箱中,分别将溶液旋涂在PEDOT:PSS (空穴) (30 nm)与氧化锌(电子) (30 nm),测试空穴时,各活性层的厚度分别为P3HT/IDT-1:114 nm,P3HT/IDT-2:107 nm,P3HT/IDT-3:70 nm,测试电子时,各活性层的厚度为P3HT/IDT-1:114 nm,P3HT/IDT-2:200 nm(由于在107 nm时,电子迁移率不能测试得到,因此采用增大活性层厚度的策略),P3HT/IDT-3:70 nm。最后在真空室中,分别蒸镀Au (空穴) (80 nm)和Al (电子) (100 nm)。空穴和电子二极管的器件结构分别为ITO/PEDOT:PSS/P3HT:IDT-X/Au (空穴)和ITO/ZnO/P3HT:IDT-X/Al (电子)。载流子迁移率的计算使用的是Mott-Gurney公式J =(9εrε0μV2)/(8d3),εr为活性层的相对介电常数,有机材料的εr一般位于2-4之间,本文取值3,ε0为真空介电常数,μ为活性层电荷迁移率,d为活性层膜厚,V = VApplied - VBuilt-in - VSeries-resistane,VApplied为器件外加电压,VBuilt-in为器件两电极间的功函差(空穴和电子器件的VBuilt-in分别为0.2与0 V),VSeries-resistane为串联和接触电阻引起的电位降,在本文中可忽略不计。将Mott-Gurney公式取对数后,得到ln(Jd3/V2) ≅ 0.89(1/E0)0.5(V/d) + ln(9εrε0μ/8)。以V/d为横坐标,ln(Jd3/V2)为纵坐标,作图后,对曲线的线性区域做切线,切线的延长线与纵坐标的交 点即 为ln(9εrε0μ/8)。 原子 力显 微镜 (AFM)(Cypher ES, Asylum Research)测试是通过轻敲模式进行的。
2.2 化合物合成
2.2.1 化合物3的合成
在50 mL圆底烧瓶中加入化合物1 (265 mg,0.215 mmol),2 (62.0 mg, 0.430 mmol)和两滴三乙胺。以15 mL 氯仿做溶剂,于50 °C下反应12 h后冷却至室温。将反应液倒入水中,氯仿 (30 mL ×3)萃取后分出有机相,用无水硫酸钠干燥剂干燥45 min后抽滤,滤液通过旋转蒸发去除溶剂,所得粗产品经过柱层析分离纯化,最后得到目标产物为蓝色固体,称重85.3 mg,产率约为29.2%。1H-NMR (400 MHz, CDCl3, δ): 10.66 (s, 1H),8.70(s, 1H),8.22 (s, 1H),8.16 (m, 2H),7.94 (m, 2H),7.69 (d, J = 8 Hz, 1H),7.60 (d, J = 4 Hz, 2H),7.27(m, 8H),7.13 (m, 8H),3.88 (m, 2H),2.59 (m, 8H),1.61 (m, 10H),1.31 (m, 39H),0.87 (m, 17H)。13C-NMR (100 MHz, CDCl3, δ):188.50,167.46,165.98,157.45,157.39,154.67,154.31,154.21,153.76,152.10,151.53,146.51,145.04,141.09,141.85,141.47,141.41,141.29,136.04,135.47,133.66,132.92,129.86,129.73,128.58,127.92,127.61,125.90,125.00,124.88,124.55,124.02,123.31,122.97,118.29,118.14,63.22,63.20,37.27,35.62,31.75,31.41,29.75,29.19,22.64,14.15,13.21。MS (MALDI-TOF):C83H83N5O3S5,计算值:1357.5;实测值:1357.4 (M+)。
2.2.2 IDT-1的合成
在50 mL圆底烧瓶中加入化合物1 (120 mg,0.0970 mmol),4 (157 mg,0.970 mmol)和两滴三乙胺。以15 mL氯仿作为溶剂,在65 °C下反应过夜后冷却至室温。将反应液倒入水中,氯仿(30 mL× 3)萃取后分出有机相,用无水硫酸钠干燥45 min后抽滤,滤液通过旋转蒸发去除溶剂,所得粗产品经过柱层析分离纯化,最后得到目标产物为深蓝色固体,称重76.6 mg,产率52.0%。1H-NMR (400 MHz, CDCl3,δ):8.44 (s, 2H),8.18 (s, 2H),7.89(d,J = 8 Hz, 2H),7.61 (m, 4H),7.28 (d, J = 8 Hz, 8H),7.12 (d, J = 8 Hz, 8H),4.22 (m, 4H),2.58 (m, 8H),1.62 (m, 10H),1.37 (m, 35H),0.87 (m, 14H)。13C-NMR (100 MHz, CDCl3, δ):192.91,167.51,157.48,154.43,154.26,151.56,145.48,141.85,141.81,141.47,135.77,131.16,130.01,128.57,127.94,127.06,125.13,124.68,124.50,124.03,118.19,63.20,39.93,35.62,31.75,31.42,29.20,22.64,14.16,12.36。MS (MALDI-TOF):C88H88N6O2S8, 计算值:1516.5;实测值:1516.3(M+)。元素分析C88H88N6O2S8,计算值(%):C,69.62;H,5.84;N,5.54。实测值(%):C,69.90;H,5.74;N,5.61。
2.2.3 IDT-2的合成
在50 mL圆底烧瓶中加入化合物3 (85.0 mg,0.0630 mmol),4 (101 mg,0.630 mmol)和两滴三乙胺。以15 mL氯仿作为溶剂,在65 °C下反应过夜后冷却至室温。将反应液倒入水中,氯仿(30 mL ×3)萃取后分出有机相,用无水硫酸钠干燥45 min后抽滤,滤液通过旋转蒸发去除溶剂,所得粗产品经过柱层析分离纯化,最后所得目标产物为深蓝色固体,28.6 mg,产率30.2%。1H-NMR (400 MHz, CDCl3, δ):8.71 (s, 1H),8.47 (s, 1H),8.18 (d,J = 8 Hz, 2H),7.93(m, 2H),7.70 (d, J = 8 Hz, 2H),7.65 (d, J = 8 Hz, 2H),7.58 (s, 1H),7.57 (s, 1H),7.27 (d, J = 8 Hz, 8H),7.12 (d, J = 8 Hz, 8H),4.25(m, 2H),3.88 (m, 2H),2.59 (m, 8H),1.62 (m, 13H),1.30 (m, 42H),0.88 (m, 18H)。13C-NMR (100 MHz,CDCl3, δ):192.87,167.49,167.43,165.96,157.47,157.41,154.67,154.42,154.26,154.22,151.50,145.47,145.10,141.84,141.77,141.52,135.83,135.69,131.14,129.99,129.87,129.73,128.57,127.95,127.57,127.03,125.19,124.97,124.64,124.46,124.01,123.21,118.16,63.21,39.92,37.26,35.63,31.76,31.43,29.75,29.20,22.65,14.17,13.22,12.37。MS (MALDI-TOF):C88H88N6O3S7,计算值:1500.5;实测值:1500.9 (M+). 元素分析C88H88N6O3S7,计算值(%):C, 70.36;H,5.91;N,5.59。实测值(%):C,70.68;H,5.72;N,5.64。
2.2.4 IDT-3的合成
在50 mL圆底烧瓶中加入1 (212 mg,0.160 mmol),2 (236 mg, 1.63 mmol)和两滴三乙胺。以15 mL氯仿作为溶剂,在65 °C反应过夜后冷却至室温。将反应液倒入水中,氯仿(30 mL × 3) 萃取后分出有机相,用无水硫酸钠干燥45 min后抽滤,滤液通过旋转蒸发去除溶剂,所得粗产品经过柱层析分离纯化,最后所得目标产物为深蓝色固体,127.1 mg,产率为53.5%。1H-NMR (400 MHz,CDCl3, δ):8.71 (s, 2H),8.16 (s, 2H),7.94 (d, J = 8 Hz, 2H),7.71 (d, J = 8 Hz, 2H),7.57 (s, 2H), 7.26(d, J = 8 Hz, 8H),7.12 (d, J = 8 Hz, 8H),3.88 (m,4H),2.59 (m, 8H),1.62 (m, 10H),1.32 (m, 31H),0.88 (m, 12H)。13C-NMR (100 MHz, CDCl3, δ):167.46,165.98,157.35,154.68,154.18,151.52,145.13,141.82,141.75,141.52,135.73,129.88,129.76,128.56,127.94,127.61,124.95,124.47,123.97,123.23,118.31,63.20,37.26,35.62,31.75,31.42,29.20,22.64,14.16,13.22。MS (MALDITOF):C88H88N6O4S6,计算值:1484.5;实测值:1484.4 (M+)。元素分析C88H88N6O4S6,计算值(%):C,71.13;H,5.97;N,5.66。实测值(%):C,71.34;H,5.82;N, 5.70。
3 结果与讨论
3.1 IDT-X的合成及结构表征
三个小分子受体的合成路线如图1所示,其中原料1的合成参考文献的合成方法19。2和4为直接购买的市售分析纯中间产物,未经过进一步的纯化。目标受体小分子IDT-2的合成采用分步反应完成。首先,通过控制噻唑烷-2,4-二酮与化合物1的投料比,得到单边缩合噻唑烷-2,4-二酮单元的中间体3,然后再利用绕丹宁与3缩合,从而实现两端分别为绕丹宁和噻唑烷-2,4-二酮单元的不对称受体分子的控制合成。而对称结构的受体分子IDT-1和IDT-3为文献报道的化合物,其合成按文献方法完成19,25。所合成化合物的结构均通过1H-NMR,13C-NMR以及元素分析和质谱等确证。
这三个小分子受体在三氯甲烷、二氯甲烷、氯苯等有机溶剂中均具有较好的溶解性能。此外,通过热重分析(TGA)对它们的热稳定进行了表征,结果表明这三个受体分子都具有良好的热稳定性,热分解温度(以5%的失重为标准)都在350 °C以上。
3.2 IDT-X的吸收光谱和能级
小分子受体的溶液和薄膜吸收见图2,其最大吸收波长以及相应光学带隙的数据列于表1中。如图2a所示,三个小分子受体在溶液中有相似的吸收光谱,均具有两个主要的吸收峰,350-450 nm和500-700 nm。其中350-450 nm的吸收归因于分子共轭骨架的π-π*电子跃迁,而500-700 nm范围强而宽的吸收来源于分子内的电荷转移(intramolecular charge transfer,ICT)吸收。比较三个分子的吸收光谱可以发现,如果将IDT-1分子中的两个绕丹宁端基同时替换为噻唑烷-2,4-二酮基团而形成IDT-3,后者的最大ICT吸收位置较前者出现了约30 nm的蓝移,这与许多文献报道的结果基本一致24,25。而对于具有不对称结构的小分子IDT-2而言,其分子中含有一个绕丹宁端基和一个噻唑烷-2,4-二酮端基,其最大的ICT吸收峰位置则恰好介于IDT-1和IDT-3之间,表明这三个分子的吸收与端基结构的不同密切相关,并呈现一定的规律。
图2b是三个分子在薄膜状态的吸收光谱。较之在溶液中的吸收,三个分子在薄膜中的吸收出现了明显的红移,且在长波段区域的肩峰更加明显,说明在薄膜状态下分子之间具有较强的相互作用并呈现出较有序的堆积26。与溶液状态的吸收光谱相似,从IDT-1到IDT-3,随着分子中的绕丹宁基团逐步被噻唑烷-2,4-二酮基团所取代,ICT吸收光谱也出现了逐渐的蓝移,相应的光学带隙(Egopt)也逐渐增大,由1.68 eV增大到1.77 eV。其中具有不对称结构的小分子IDT-2,因分子中的两个端基分别为绕丹宁基团和噻唑烷-2,4-二酮基团,所以最大ICT吸收仍然介于IDT-1和IDT-3之间,而由薄膜吸收边估算得到的光学带隙为1.71eV,也是介于IDT-1 (= 1.68 eV)和IDT-3 (= 1.77 eV)之间。

图1 小分子受体的合成示意图Fig. 1 Synthetic route for the small molecular acceptors.
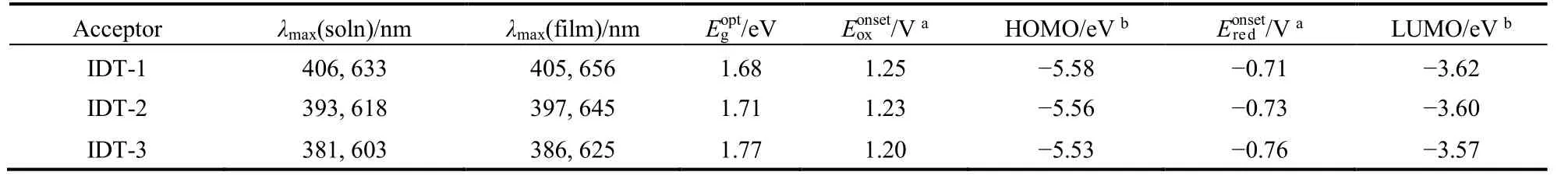
表1 小分子受体的光物理和电化学性能Table 1 Photophysical and electrochemical data of the small molecular acceptors.

图2 小分子受体在氯苯(a)和薄膜(b)中的吸收光谱Fig. 2 Absorption spectra of the small molecular acceptors in chlorobenzene (a) and in thin film (b).
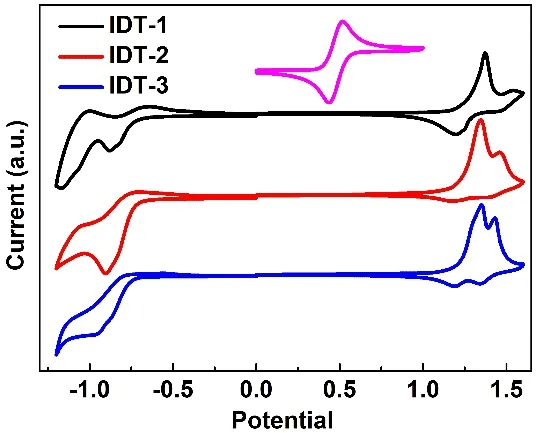
图3 小分子受体的循环伏安曲线Fig. 3 The CV curves of the small molecular acceptors.
为了确定三个分子的HOMO和LUMO能级,我们通过循环伏安法测试了它们的电化学性质,其循环伏安曲线如图3所示,由此推算得到的HOMO-LUMO能级数据见表1。比较表中数据可以看到,IDT-1、IDT-2和IDT-3的LUMO能级分别为-3.62、-3.60和-3.57 eV。显然,在这一系列分子中,当噻唑烷-2,4-二酮替代绕丹宁后,能显著抬高分子的LUMO能级,这与许多文献中报道的实验现象基本一致24,25。同样,从IDT-1到IDT-3,HOMO能级分别为-5.58、-5.56和-5.53 eV,也呈现逐渐抬升趋势,与其LUMO能级的大小顺序一致。
总体而言,当分子的两端均以绕丹宁为端基(IDT-1)时,吸收光谱红移最大,并具有较深的LUMO-HOMO能级,而分子的两端均为噻唑烷-2,4-二酮(IDT-3)时,吸收光谱蓝移最大,LUMO-HOMO能级明显抬升,而IDT-2的吸收光谱以及LUMO-HOMO能级均介于前两者之间,这可能与S原子空的dπ轨道具有更强电子接受能力有关22,23。
另外,对于有机共轭体系而言,稳定的醌式结构往往有利于π-电子的离域以及提高分子的平面性,增强分子内电荷转移(intramolecular charge transfer,ICT)从而减小分子的带隙28。图4是三个分子相应的芳香结构和醌式结构示意图。在醌式结构中端基绕丹宁单元和噻唑烷-2,4-二酮单元均能以五元芳香杂环的形式存在,这对稳定醌式结构是有利的。比较以绕丹宁和噻唑烷-2,4-二酮为端基的五元芳杂体系可以发现,噻唑烷-2,4-二酮的氧负离子较之绕丹宁单元的硫负离子,其与五元芳环的p-π共轭效应更为有效,因而供电子能力更强,导致端基受体单元的拉电子效应减弱,不利于ICT;此外,对于芳香体系而言,相对高的π-电子云密度往往稳定性会下降,由此推测端基五元芳杂体系的稳定性下降将不利于稳定醌式结构。因此在这一系列分子中,从IDT-1到IDT-3,当分子的端基由绕丹宁逐步替换为噻唑烷-2,4-二酮后,醌式结构稳定性下降,由此导致吸收光谱蓝移,同时端基较强的供电子能力也会抬升分子HOMO-LUMO能级,这正好与上面实验测试获得的吸收光谱和电化学测试结果相吻合。不过,LUMO能级的抬升通常有助于太阳能电池获得更高的Voc24,25,27,这也为后面的电池器件测试结果所证实。
3.3 基于IDT-X的光伏器件性能
如前所述,P3HT是一类经典的太阳能电池给体材料,具有价格低廉、性能稳定等特点。同时考虑到给受体材料的吸收光谱的互补性以及HOMO-LUMO能级的相对匹配,因此我们以这一系列的三个分子(IDT-1-IDT-3)为受体与P3HT给体共混构建活性层,制作了相应的聚合物太阳能电池器件,并对器件性能进行了评估,同时对分子结构与器件性能的关系进行了探讨。相应器件结构为ITO/PEDOT:PSS/P3HT:IDT-X/Ca/Al,活性层制作采用溶液旋涂法完成,溶剂为邻二氯苯(o-DCB),添加剂为1-氯萘(CN)。首先,对给受体比例(D/A)以及添加剂的比例进行了较细致优化。经过优化发现,基于IDT-1、IDT-2和IDT-3的太阳能电池器件的最佳给受体质量比(D/A)均为1 : 0.6,而添加剂CN的最优比例分别为5%、5%和6%。经过优化后的最佳电流-电压曲线(J-V)以及外量子效率曲线(EQE)如图5a,b所示,相应的器件光伏性能数据见表2。
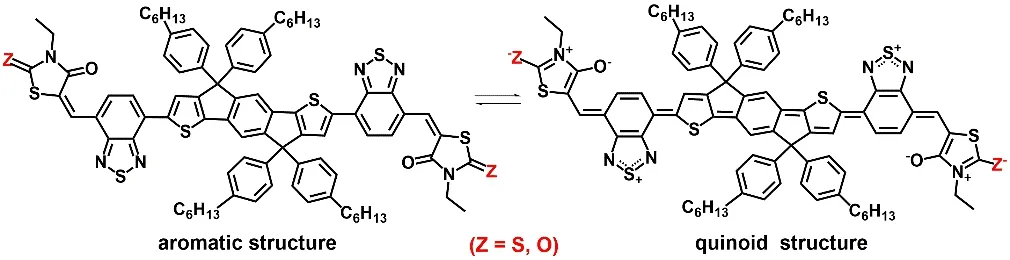
图4 小分子受体的芳香结构与醌式结构比较Fig. 4 The aromatic structure and quinoid structure of the small molecular acceptors.
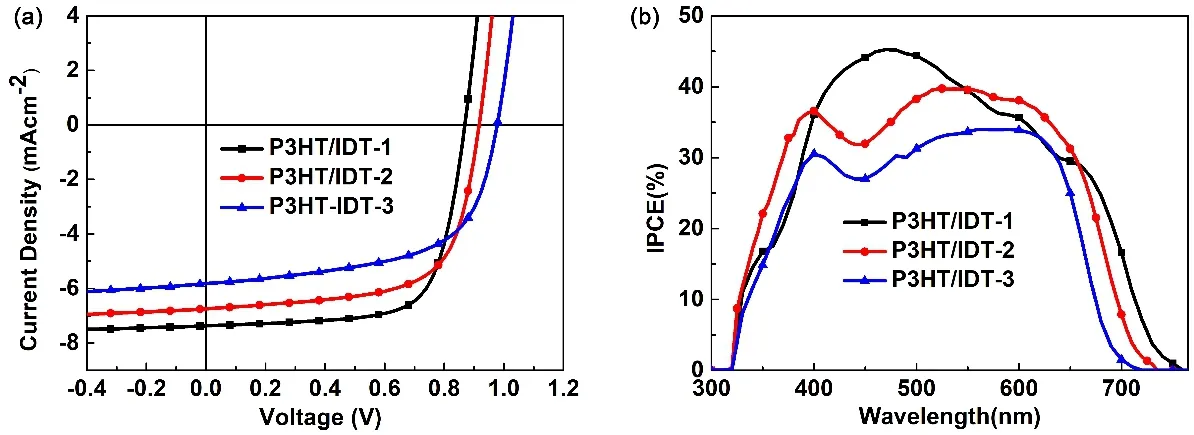
图5 太阳能电池的电流-电压曲线(J-V) (a)和外量子效率曲线(b)Fig. 5 The J-V curves (a) and the EQE curves (b) of the OSCs.
从图表数据分析可以发现,基于IDT-1-IDT-3的太阳能电池器件性能变化呈现一定的规律性。从IDT-1到IDT-3,随着端基的绕丹宁基团逐步被噻唑烷-2,4-二酮基团所取代,太阳能电池器件的开路电压(Voc)逐渐增大而短路电流密度(Jsc)和填充因子(FF)则逐渐降低。其中基于IDT-3的电池器件的Voc最大,达到了(0.97 ± 0.005) V,不过却具有最小的Jsc和FF,分别为(5.49 ± 0.25) mA·cm-2和(56.64 ± 1.90)%,相应的光电转换效率(PCE)也最低,仅为(3.03 ± 0.20)%。基于IDT-1的电池器件虽然Voc最小,但却有最高的Jsc和FF,分别为(7.13 ±0.21) mA·cm-2和(70.08 ± 1.84)%,相应的PCE也最高,为(4.32 ± 0.21)%。而对于IDT-2而言,其两端端基分别为绕丹宁基团和噻唑烷-2,4-二酮基团,相应的吸收光谱和能级介于IDT-1和IDT-3之间,因此相应的电池器件的光伏性能参数也是介于IDT-1和IDT-3之间。其中Voc为(0.91±0.005) V,比IDT-1高约0.05 V,而比IDT-3低约0.06 V;Jsc和FF分别为(6.52 ± 0.18) mA·cm-2和(64.53 ± 1.30)%,比IDT-1略低但却高于IDT-3;相应最大PCE为4.07%,也是介于IDT-1 (4.52%)和IDT-3 (3.40%)之间。
通常,器件的Jsc大小可以通过测试其EQE曲线来体现。如图5b所示,所有器件的光电响应范围与给受体的吸收光谱范围一致。IDT-1的光电响应最宽,在400-550 nm之间的响应最大,因此其Jsc最大。IDT-3的光电响应无论是在宽度还是强度都最小,因此Jsc值也最低。IDT-2的光电响应在宽度和强度都高于IDT-3,但相应宽度以及在400-550 nm处的响应强度却不如IDT-1,这也解释了其Jsc值的大小处于IDT-1与IDT-3的原因。
总之,对于这三个受体分子而言,若以噻唑烷-2,4-二酮单元取代绕丹宁单元作为端基,随着绕丹宁逐步被噻唑烷-2,4-二酮所取代,基于相应受体分子的电池器件的Voc逐渐增大,但Jsc和FF逐渐降低,最终导致器件的PCE也逐渐降低。其Voc变化趋势与其LUMO能级高低顺序一致,而Jsc大小顺序则与其吸收光谱范围一致,同时也与上面所讨论的相应分子醌式结构的稳定性相互关联,这说明在这一系列受体分子结构中,如果将绕丹宁单元替换为噻唑烷-2,4-二酮单元虽能有效抬高分子的LUMO能级,进而提高器件Voc,但由于其对稳定共轭体系醌式结构不利而导致器件电流密度下降,最终影响器件效率。因此对于受体分子的设计,如何实现器件的短路电流密度和开路电压的平衡将是提高电池器件光电转换效率的关键。

表2 基于P3HT/IDT-X的光伏性能参数Table 2 Photovoltaic performance parameters of the PSCs based on P3HT/IDT-X.

图6 太阳能电池的光电流密度-有效电压特性曲线Fig. 6 Photocurrent density (Jph) versus effective voltage(Veff) characteristics of the solar cells.
此外,为进一步解释本文中器件的Jsc和FF的变化趋势,我们还测试了器件的光电流密度-有效电压(Jph-Veff)特性曲线(如图6)。通过对曲线进行分析可以总结器件的电荷的产生和抽取效率,其中Jph= JL- JD,JL和JD分别为光电流密度和暗电流密度,Veff= V0-Vbias,V0是Jph为0时的电压值,Vbias为外加电压29。在高的外加电压条件下,Jph达到饱和后,可利用Jph与Jsat的比值(Jph/Jsat)大小来判断激子的解离与电荷的抽取效率。经过计算,在短路条件下,共混膜P3HT/IDT-1、P3HT/IDT-2和P3HT/IDT-3的Jph/Jsat值分别为95.4%、92.5%和88.0%,表明基于IDT-1的太阳能电池器件具有最高的激子解离和电荷收集效率,而基于IDT-3的器件的激子解离和电荷收集效率最低,所以,IDT-1的FF最高,IDT-3的FF最低。同时,基于IDT-2的激子解离效率为92.5%,介于IDT-1与IDT-3之间,这与其FF值的大小一致。
同时,活性层的电荷迁移率也能有助于解释电池器件的Jsc和FF变化趋势。我们采用空间电荷限制电流法(SCLC)测试了器件活性层的空穴迁移率以及电子迁移率,相应结果如图 7所示,具体数据列于表 2。P3HT/IDT-1、P3HT/IDT-2和P3HT/IDT-3共混膜的空穴迁移率大小比较接近,分别为 2.4 × 10-4、2.2 × 10-4和 1.5 × 10-4cm2·V-1·s-1,但其电子迁移率分别为 1.5 × 10-4、7.5 × 10-5和 2.3 × 10-5cm2·V-1·s-1,呈现出较大的差距。通过计算得到 P3HT/IDT-1、P3HT/IDT-2和 P3HT/IDT-3共混膜的空穴迁移率与电子迁移率的比值(μh/μe)分别为 1.6、2.9 和 6.5。其中P3HT/IDT-1共混膜具有最高的空穴迁移率、电子迁移率以及较佳的 μh/μe比值,这与其电池器件具有最高的Jsc和FF基本一致。而对于P3HT/IDT-3共混膜而言,由于其较低的电子迁移率导致了μh/μe的失衡,因此 Jsc和 FF显著下降,器件的光电转换效率最差。P3HT/IDT-2共混膜虽与P3HT/IDT-1共混膜的空穴迁移率十分接近,但其电子迁移率较之 P3HT/IDT-1明显降低,因此其2.9 的 μh/μe值大于 P3HT/IDT-1 的 1.6 的 μh/μe值,不过却大大低于P3HT/IDT-3的μh/μe= 6.5的比值,这正好与其电池器件的Jsc和FF以及PCE值介于IDT-1与IDT-3之间相吻合。

图7 共混膜P3HT/IDT-X的J-V曲线:空穴(a)和电子(b)及相应空穴迁移率曲线(c)和电子迁移率曲线(d)Fig. 7 The J-V curves of the blend of P3HT/IDT-X for hole mobility (a) and electron mobility (b) and the ln(Jd3/V2) vs.(V/d)0.5 of plot of the blend for (c) the hole mobility measurement and (d) electron mobility measurement.

图8 (a) P3HT/IDT-1,(b) P3HT/IDT-2和(c) P3HT/IDT-3共混膜的高度图以及(d)P3HT/IDT-1,(e) P3HT/IDT-2和(f) P3HT/IDT-3共混膜的相图Fig. 8 Height images of (a) P3HT/IDT-1, (b) P3HT/IDT-2 and (c) P3HT/IDT-3 blend films and phase images(a) P3HT/IDT-1, (b) P3HT/IDT-2 and (c) P3HT/IDT-3 blend films.
我们知道,电池器件的性能(包括电流密度、开路电压、填充因子等)与活性层中给体与受体分子间的相互作用而形成的相分离尺度及其形貌密切相关,适宜的相分离尺度往往有利于激子的形成、解离和传输,为此我们通过原子力显微镜(AFM)测试了基于不同受体分子与给体分子共混形成的活性层形貌,相应的高度图和相图见图8。共混膜P3HT/IDT-1、P3HT/IDT-2和P3HT/IDT-3的粗糙度分别为9.2、5.3和7.2 nm。如图8d-f所示,比较三个受体分子与 P3HT的共混膜相图可以发现,较之P3HT/IDT-2和P3HT/IDT-3的共混膜相图,P3HT/IDT-1共混膜的相分离状态具有更好的连续性和相对适宜的相分离尺度,从而更有助于激子的传输和解离,因此其相应的电池器件展示了更好的光伏性能。尽管P3HT/IDT-3共混膜的相分离状态也比较明显,有助于激子的解离,但是其相对较小的相分离尺度会大幅降低电荷的传输性能,进而影响器件的 Jsc和 FF;而P3HT/IDT-2共混膜虽也有明显的聚集相,有利于其电荷传输,但是其相分离尺度太大,容易增加激子再复合几率,不利于 Jsc和 FF的进一步提高30,31,因此基于IDT-2和IDT-3的电池器件的整体性能并不理想。
4 结论
在本文中,我们分别以绕丹宁和噻唑烷-2,4-二酮结构单元为端基设计合成了一种新型不对称结构小分子受体IDT-2,同时制备了两端均为绕丹宁或噻唑烷-2,4-二酮单元的对称结构小分子受体IDT-1和IDT-3,较系统地研究了分子结构的变化对其性能的影响。在这一系列的受体分子中,从IDT-1到IDT-3,随着分子中绕丹宁基团逐渐被噻唑烷-2,4-二酮基团所取代,受体分子的吸收光谱逐渐蓝移,光学带隙逐渐增大,同时LUMO能级和HOMO能级则逐步抬升。基于这一系列受体材料与 P3HT给体材料构建的太阳电池器件研究表明,分子中引入噻唑烷-2,4-二酮基团能有效提高电池器件的Voc,但是它降低了共轭体系的醌式结构稳定性,由此引起吸收光谱蓝移,电子迁移效率下降,不利于改善电池器件的Jsc和FF,从而导致器件光电转换效率大幅降低,由此说明,分子结构基元的合理微调有可能实现几种不同性能的协调进而改善其电池器件的整体性能。

