铁盐对制备MIL-100(Fe)的影响及其光催化性能
张 宇,刘湘粤,毛会玲,王 晨,杜 嬛,程 琥,庄金亮
(1 贵州师范大学 化学与材料科学学院 贵州省功能材料化学重点实验室,贵阳 550001;2 中国科学院过程工程研究所 中国科学院绿色过程与工程重点实验室,北京 100190)
随着全球工业化的不断发展,水污染已经成为环境污染中面临的最严峻的问题之一。当今中国社会的快速发展,水污染问题尤其突出,水污染治理已刻不容缓。工业废水具有污染物成分复杂、毒性强以及难以生物降解等特点[1];特别是印染、造纸、皮革、塑料和医药行业,废水含有大量难以生物降解的有机染料污染物,严重危害水生动植物以及人类的健康[2]。全世界每年生产的商品化有机染料高达七百万吨之多,其中将近2%的有机染料被直接排放到水体系中[3]。因此,如何高效、节能治理上述产业排放的工业废水是水污染治理面临的重要挑战。太阳能取之不尽、用之不竭、安全可靠,是人类最理想的绿色清洁能源。利用太阳能实现对废水中有机染料的光催化降解具有绿色、低成本等特点,是水污染治理行之有效的方法之一,得到越来越广泛的关注[4]。TiO2光催化体系是发现最早的可用于光催化降解有机污染物的催化剂[5]。此后,多种金属氧化物如ZnO,WO3以及硫化物如CdS,ZnS等无机半导体材料被开发应用于有机污染物的光催化降解。然而,上述无机半导体材料仍然面临量子产率低和光转化效率低等问题,且价格相对较高,限制了其在废水领域的应用范围。此外,多数无机半导体材料不具有多孔性,比表面积较低,对有机染料污染物的吸附性能较差。因此,开发高效、价廉、稳定的有机染料光催化剂仍具有重要的研究意义。
金属-有机骨架化合物(metal-organic frameworks,MOFs)是一类由金属离子或团簇与有机配体通过配位键连接而成的具有立体网络状结构晶体材料[6-7]。相比于分子筛和多孔碳等传统多孔材料,MOFs具有种类丰富、高比表面积、高孔隙率以及孔道易于功能化等优点,被广泛应用于气体存储、分离、异相催化、分子识别、化学传感和废水处理等领域[8-9]。特别是在废水处理领域,MOFs超高的比表面积,不仅可实现对水中污染物的高效吸附,功能化的骨架结构还可实现对污染物的选择性、特异性吸附,在废水处理领域具有独特的优势[10-11]。此外,由于MOFs的金属团簇和(或)有机配体能够吸收紫外和(或)可见光,产生光生电子/空穴对,在合适条件下,能够实现光生电子/空穴对有效分离,表现出与TiO2传统半导体相似的性质,有望成为新型光催化剂,应用于水处理领域,特别是光催化降解有机染料方向[12-13]。然而发展MOFs在废水处理领域的应用也面临巨大挑战。首先,应用于水处理的MOFs应具有优异的水稳定性。然而,大多数基于Cu2+,Zn2+和Cd2+与羧酸类配体构筑的MOFs水稳定性能较差,在水溶液或水蒸气中骨架发生坍塌,难以应用于水处理领域[14]。其次,大多数MOFs采用溶剂热法合成,高温、高压以及使用高沸点有机溶剂,难以实现大量、低成本工业化合成[15]。因此,发展MOFs的工业化应用,特别是水处理领域的应用,前提是解决上述两大问题。
近年来,水稳定MOFs得到了极大发展。其中性能最为优异一类水稳定MOFs是由法国凡赛尔大学的Férey课题组合成的MIL(materials institute lavoisier)系列,包括MIL-53(Al),MIL-101(Cr),MIL-100(Cr),MIL-100(Fe), MIL-110(Al)等[16-19]。特别是MIL-100(Fe),由廉价铁(Ⅲ)盐与均苯三甲酸配位而成,具有孔径大、比表面积高、路易斯酸位点丰富以及水稳定性和化学稳定优异等特点,具有极大的工业应用前景[19]。MIL-100(Fe)常规水热法通常采用三价铁盐,在高温高压,硝酸和氢氟酸辅助下,与均苯三甲酸反应,可获得高结晶度MIL-100(Fe)[20]。Jeremias等[21]将Fe(NO3)3和均苯三甲酸在DMSO/H2O混合溶剂中130℃下回流12h,可获得高结晶度MIL-100(Fe)。该方法的优点是避免使用硝酸和氢氟酸,但仍需高温以及使用高沸点有机溶剂。Duan等[22]报道了在无HF辅助下,FeCl3和均苯三甲酸在乙醇/水混合溶剂中140℃加热12h,可获得无定形Fe-BTC纳米颗粒。Zhang等[23]发现将Fe(NO3)3和均苯三甲酸在水中加热回流条件下,能够获得结晶度较高的MIL-100(Fe)。上述研究结果表明在无HF辅助和室温条件下合成高结晶度MIL-100(Fe)仍面临挑战,且上述研究所使用的铁源大多为三价铁盐,目前暂未使用亚铁盐作为铁源。为此,本课题组研究了不同价态铁盐(三价铁盐和亚铁盐)对室温水相合成MIL-100(Fe)的形貌和结晶度的影响。X射线粉末衍射(XRD)和扫描电子显微镜(SEM)结果表明MIL-100(Fe)不同价态铁盐对获得的MIL-100(Fe)具有决定性作用。此外,利用紫外-可见漫反射光谱(UV-Vis DRS)、紫外-可见吸收光谱(UV-Vis)等系统研究了不同价态铁盐对获得的MIL-100(Fe)纳米颗粒对罗丹明B有机染料的吸附和光催化降解性能。
1 实验
1.1 实验仪器及药品
实验仪器:扫描电子显微镜(S-4800,SEM);紫外-可见光分光光度计(UV-Vis);X射线粉末衍射仪(Ultima Ⅳ XRD);比表面积测定仪(BET)。
实验药品:四水合氯化亚铁(FeCl2·4H2O),三氯化铁(六水)(FeCl3·6H2O),均苯三甲酸(H3btc),罗丹明B染料(RhB)和氢氧化钠(NaOH)均为分析纯,水(实验室二次蒸馏水)。
1.2 室温合成MIL-100(Fe)
MIL-100(Fe)的制备采用的是室温水相合成法。将NaOH(1.158g, 28.8mmol)加入圆底烧瓶中,加入27.0mL H2O,超声5min使溶解;再分多次加入均苯三甲酸(H3btc,1.592g,7.5mmol),超声使之溶解,得到澄清溶液;然后另取1个250mL圆底烧瓶,称入FeCl2·4H2O(2.376g,12mmol)或FeCl3·6H2O(3.240g, 12mmol),加入105mL H2O,超声溶解;最后,在室温下(RT,(25±2)℃)将配制好的均苯三甲酸与氢氧化钠的混合溶液缓慢滴加入FeCl2或FeCl3溶液中,边滴边搅拌,溶液呈黄绿色且逐渐有固体析出,在室温下搅拌反应24h,悬浊液呈红棕色。将所获得的悬浊液离心分离,得到橙色固体,将橙色固体用去离子水超声洗3次,再用热水、热乙醇洗涤,110℃下烘干过夜。以FeCl2为铁源获得固体粉末2.26g,以FeCl3为铁源获得固体粉末2.12g。
将得到的固体粉末用热水和乙醇萃取,再用稀NH4F水溶液洗涤[24]。具体如下:将样品(2.0g)置于100mL热水中(70℃),搅拌3h,静置冷却,离心分离;然后用100mL热乙醇(65℃)搅拌3h,离心分离,直至上清液无色。NH4F水溶液可进一步纯化样品,将上述烘干样品置于100mL NH4F水溶液(38mmol·L-1)中70℃下搅拌3h,离心分离得到纯化后的固体,常压100℃烘干。
1.3 MIL-100(Fe)表征
利用XRD(X射线粉末衍射分析)表征所合成的样品的结晶度;利用SEM(扫描电子显微镜)分析样品的形貌和晶粒尺寸;利用比表面积测定仪测定样品的BET比表面积;采用紫外-可见漫反射光谱仪(UV-Vis DRS)表征样品吸光性能;采用紫外-可见光分光光度计(UV-Vis)表征MIL-100(Fe)光催化降解有机染料性能。据标准工作曲线(c=0.033x+0.015,R2=0.9999)确定罗丹明B液浓度。
1.4 MIL-100(Fe)对罗丹明B的吸附及光降解性能测试
将10mg催化剂投入50mL罗丹明B溶液中(50mg·L-1)溶液,避光搅拌,每隔特定时间进行取样,离心分离,取上清液用紫外-可见分光光度计测定其在400~700nm区间内的吸光度。称取10mg催化剂加入到50mL的罗丹明B溶液中(50mg·L-1),加入25μL H2O2,光照下搅拌(300W氙灯),隔一定时间取样离心,测定罗丹明B的浓度,评价MIL-100(Fe)对RhB光降解效率。
2 结果与讨论
2.1 不同铁盐制备的MIL-100(Fe)表征结果

扫描电子显微镜结果(图2)表明以不同价态铁盐为原料,合成的MOFs在形貌上具有很大差异。以FeCl2为铁源获得的MIL-100(Fe)样品由聚集状的纳米晶体组成(图2(a)),从高倍SEM图中可以看出,该MIL-100(Fe)具有规则的八面体形貌,尺寸在300~1000nm,晶体颗粒呈现交互共生(intergrowth)。相反,以FeCl3为原料获得的Fe-BTC样品无明显的结构特征(图2(b)),样品由100nm左右的纳米颗粒聚集而成。值得注意的是,该聚集态的Fe-BTC表面含有明显孔道结构。
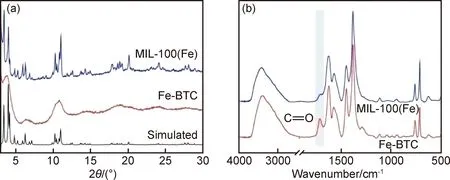
图1 以FeCl2和FeCl3为铁源合成的样品XRD (a)和FTIR谱图(b)Fig.1 XRD patterns (a) and FTIR spectra (b) of synthesized particles from FeCl2 and FeCl3

图2 不同铁盐为原料合成MIL-100(Fe)(a)和Fe-BTC(b)纳米颗粒SEM图Fig.2 SEM images of MIL-100(Fe)(a) and Fe-BTC(b) nanoparticles synthesized from different ferric salts
为了研究所合成样品的比表面积,测试了样品的氮气吸附-脱附曲线。如图3所示,三角形代表MIL-100(Fe),NH4F活化;圆形代表Fe-BTC,NH4F活化;五角星代表MIL-100(Fe),未经NH4F活化;菱形代表Fe-BTC未经NH4F活化。经过简单的热水和热乙醇洗涤,样品的比表面积较小,MIL-100(Fe)和Fe-BTC的比表面积分别为620m2/g和330m2/g。将上述样品经过NH4F洗涤活化后,两者的比表面积分别提升到1100m2/g和940m2/g,比表面积均有很大提高(提高了2~3倍)。可能原因是在材料的合成过程中,反应前驱体(如均苯三甲酸)堵塞孔道,经过NH4F的洗涤,堵塞的前驱体被释放,从而增加材料比表面积。MIL-100(Fe)由于结晶度高,尽管晶体颗粒较大,但材料孔道内部结构丰富,因此比表面积较大;相反,Fe-BTC由于结晶度差,材料内部孔道结构较少,比表面积主要来源于尺寸较小的纳米颗粒外表面。

图3 MIL-100(Fe)和Fe-BTC的N2吸附-脱附等温线图Fig.3 N2 adsorption-desorption isotherm diagram of MIL-100(Fe) and Fe-BTC
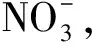
为了考察所合成MOFs材料的光吸收性能,测试了MIL-100 (Fe)和Fe-BTC紫外-可见漫反射光谱(UV-Vis DRS)图。如图4(a)所示,MIL-100(Fe)和Fe-BTC在紫外光区和可见光区均具有相似的吸收峰。由于两者都含有BTC3-有机配体,因此在200~400nm紫外光区域具有强吸收带(π-π*跃迁)。可见光区部分主要是由于Fe(Ⅲ)O6八面体(图1(a)蓝色八面体)3d-3d跃迁[27]。利用(αhν)2=A(hν-Eg)1/2,可以估算MIL-100(Fe)的半导体的禁带宽度,其中α为光吸收系数,cm-1;h为普朗克常数,eV·s;ν为光频率,Hz;A为常数,Eg为禁带宽度,eV。根据上述公式可以计算MIL-100(Fe)和Fe-BTC的禁带宽度数值,分别为2.3eV和2.5eV,与文献值较吻合[28]。尽管MIL-100(Fe)和Fe-BTC在晶体结构上有明显区别,但两者的光吸收性能几乎相同,表明两者的化学组成基本相似,其吸光基团主要为BTC3-有机配体和Fe(Ⅲ)O6八面体。
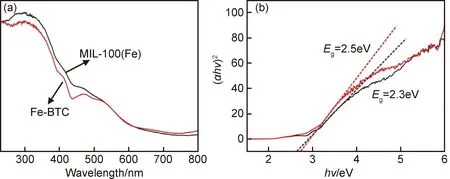
图4 MIL-100(Fe)(黑色)和Fe-BTC(红色)的吸光性能(a)紫外-可见漫反射光谱;(b)(αhν)2-hν曲线Fig.4 Photo-absorption properties of MIL-100(Fe) (black) and Fe-BTC (red)(a)UV-Vis-DRS spectra;(b)(αhν)2-hν curves
2.2 MIL-100(Fe)和Fe-BTC对有机染料RhB的吸附性能
以200mg·L-1罗丹明B溶液作为目标吸附物,在避光条件下考察MIL-100(Fe)和Fe-BTC对RhB的吸附性能。如图5所示,经过180min,Fe-BTC和MIL-100(Fe)对RhB的脱色率分别为75%和50%。在30min内,Fe-BTC对RhB的脱色效率明显高于MIL-100(Fe)。尽管MIL-100(Fe)的比表面积略高于Fe-BTC,但由于Fe-BTC纳米颗粒尺寸比MIL-100(Fe)小得多,且表面存在明显的孔道结构,有利于RhB的扩散,因此RhB在Fe-BTC的外表面吸附更快。相反,MIL-100(Fe)的高结晶度,使得内部比表面积较丰富,RhB分子必须扩散进入MIL-100(Fe)的内部孔道,才能充分发挥MIL-100(Fe)高比表面的优点。由于RhB的分子尺寸较大,通过扩散进入MIL-100(Fe)内部的微孔或介孔,阻力较大,因此在吸附初期,Fe-BTC对RhB的吸附效率明显高于MIL-100(Fe)。

图5 MIL-100(Fe)和Fe-BTC对RhB吸附性能Fig.5 Adsorption properties of MIL-100(Fe) and Fe-BTC toward RhB
2.3 MIL-100(Fe)和Fe-BTC对有机染料RhB的光催化降解性能
以超高浓度罗丹明B(RhB,200mg·L-1)为目标降解物,研究MIL-100(Fe)和Fe-BTC纳米颗粒对RhB的光催化降解能力。如图6(a),(b)所示,MIL-100(Fe)和Fe-BTC对罗丹明B均表现出超高的光催化降解能力。RhB的特征吸收峰在525~575nm之间,最大吸收峰位置为553nm,经过光照35min,RhB特征吸收峰急剧降低,直至完全消失,表明RhB被完全降解至无色。从图6(c)可以看出,Fe-BTC对RhB的光降解效率明显高于MIL-100(Fe),光催化降解一级动力学曲线表明Fe-BTC和MIL-100(Fe)对罗丹明B光催化降解动力学常数分别为0.16min-1和0.08min-1。由于两者的禁带宽度基本相同,因此两者对RhB的光催化降解效率主要取决RhB及其光降解产物的吸附和扩散速率。
2.4 MIL-100(Fe)和Fe-BTC吸附和光催化降解RhB性能差异分析
室温水相合成法根据所使用的铁盐不同,所合成的材料在晶体结构和表面形貌方面具有极大不同。如图7所示,以亚铁盐为铁源,可获得高度结晶的MIL-100(Fe);以三价铁盐为铁源,获得的是无定形的Fe-BTC。经过NH4F活化,由于MIL-100(Fe)具有较大的内表面,因此BET比表面比Fe-BTC大。但是由于Fe-BTC纳米颗粒的尺寸远小于MIL-100(Fe),使得Fe-BTC外表面积远大于MIL-100(Fe),且Fe-BTC表面具有较多大/介孔,有利于底物的扩散,因此对RhB降解效率较高。此外,从FTIR谱图中可以看出,由于Fe-BTC的无序性,使得BTC3-与Fe3+的结合存在较多错配位,导致Fe-BTC缺陷位较多,有利于RhB的吸附。同理,在光催化降解RhB方面,两者相似的化学组成使得两者的禁带宽度基本相同,因此对RhB的光催化降解性能也主要是由于两者孔道结构和表面形貌决定。Seo等[24]和Liang等[29]利用X射线电子能谱(XPS)研究了MIL-100(Fe)和Fe-BTC表面态铁的价态,在Fe2p谱图中,仅观察到结合能为725eV和712eV,两者相差13eV,与α-Fe2O3能谱结构相似,表明MIL-100(Fe)和Fe-BTC中表面态铁均以Fe(Ⅲ)形式存在。然而,他们发现MIL-100(Fe)和Fe-BTC中C/Fe比例差别较大。MIL-100(Fe)的C/Fe比例为6.9~7.5,与理论计算的C/Fe比例(6.0)较接近。而对于Fe-BTC,其C/Fe比例仅为2.5。上述结果表明Fe-BTC中存在较多以μ2-η2,η0桥联方式配位的BTC3-或游离的H3BTC,从而产生更多缺陷位,该XPS结果与FTIR结果互相吻合。在紫外-可见光的照射下,催化剂MIL-100(Fe)和Fe-BTC均可产生光生电子空穴对。由于Fe-BTC的外比表面积更高,更容易吸附RhB,因此产生的空穴能快速氧化RhB,减少光生电子空穴对复合,使得RhB高效降解。此外,Fe-BTC颗粒存在的大孔或介孔也更有利于RhB光降解产物的扩散。MIL-100(Fe)产生的光生电子空穴对需扩散到材料表面,与表面吸附的RhB接触,或者RhB需进入MIL-100(Fe)内部孔道。前者不利于光生电子空穴对的快速分离,后者受限于RhB进入MIL-100(Fe)内部孔道的扩散能力,因此,RhB的光催化降解效率较低。

图7 不同价态铁盐合成的MIL-100(Fe)和Fe-BTC结构差异及其吸附和光催化降解RhB性能差异示意图Fig.7 Scheme of different adsorption and photodegradation of MIL-100(Fe) and Fe-BTC synthesized from different iron salts
3 结论
(1)相比于常规水热合成法,室温水相法采用二价铁盐为铁源,可获得合成八面体形貌、高结晶度和高比表面积MIL-100(Fe);采用三价铁盐作为铁源只能获得结晶度低的Fe-BTC金属-有机聚合物纳米颗粒。利用氟化铵水溶液洗涤MIL-100(Fe)和Fe-BTC,有助于提高两者的比表面积。
(2)Fe2+被弱碱性溶液缓慢氧化成Fe3+,进而形成MIL-100(Fe)的无机次级结构单元u3-OFe(III)O6,是合成高结晶度MIL-100(Fe)的关键。以FeCl3为原料时,由于Fe3+与BTC3-快速反应,不利于形成m3-OFe(Ⅲ)O6次级结构单元,因此产物为Fe-BTC纳米颗粒聚合物。
(3)MIL-100(Fe)和Fe-BTC具有相似的化学组成和光吸收性能(禁带宽度分别为2.3eV和2.5eV),但两者的晶体结构、孔道结构以及表面形貌差异较大,使得两者在吸附和光催化降解RhB时表现出不同的性质。
(4)相比于MIL-100(Fe),Fe-BTC纳米颗粒具有更小的粒径,在BET比表面积相当的情况下,Fe-BTC具有更高的外比表面积,且聚集态的颗粒表面具有大孔或介孔,更有利于吸附物种以及光降解物种的扩散,因此,Fe-BTC对RhB的吸附和光催化降解性能优于MIL-100(Fe)。

