过表达lncRNA HOTAIR基因的风湿关节炎成纤维样滑膜细胞稳定株构建与筛选
丁明辉,郑 炜,王玉天,胡胜华,刘小平,侯秀娟,朱跃兰
0 引 言
类风湿关节炎(rhumatoid athritis,RA)是一种对称性多关节炎,致畸、致残率较高,并常伴有肺间质纤维化、冠心病、骨质疏松、血小板增高等合并症及并发症,严重影响着患者的生活质量[1]。RA的发病过程中参与因素较多,调控机制复杂,至今尚未完全明了。其中滑膜血管翳的形成是RA关节炎症及骨质破坏广受认可的形成原因之一[2]。HOTAIR基因是一种具有反式作用的长链非编码RNA(long non-coding RNA,lncRNA),具有对不同染色体上HOX基因簇的反式调控作用[3],从而进一步调控相关疾病基因的表达,参与了胃癌、前列腺癌等恶性肿瘤[4-5]以及RA、多发性硬化等自身免疫病[6-7]的发病过程。有报道称HOTAIR可通过对血管内皮生长因子A(Vascular endothelial growth factor A,VEGFA)启动子的靶向作用,直接促进VEGFA的转录,介导血管新生[8]。而VEGFA与RA滑膜血管翳形成相关,将HOTAIR与RA血管翳的形成紧密联系在一起。本研究拟建立lncRNAHOTAIR过表达慢病毒载体,构建与筛选过表达lncRNAHOTAIR的人类风湿关节炎成纤维样滑膜细胞(Human fibroblast-like syn⁃oviocytes of rheumatoid arthritis,HFLS-RA)稳定株。
1 材料与方法
1.1 主要材料与仪器HFLS-RA细胞株(广州吉妮欧生物科技有限公司)常规培养于37℃、5%CO2、饱和湿度、含10%胎牛血清(Gibco)的DMEM高糖培养基(Gibco)中。293T人胚肾细胞(ATCC)、Opti-MEM培养基(Gibco)、BamHI-HF-HF和XhoI(NEB)、DH5a感受态细胞(Takara)、PMT406空载体慢病毒(上海世翱)、慢病毒(表达EGFP)(伯豪生物)、包装质粒 pCMV-dR8.9、pCMV-VSV-G6363(Addgene)、0.25%胰酶-EDTA(GIBCO)、质粒抽提试剂盒(Qia⁃gen)、Taq 酶和 dNTP(Takara)、Trizol、DNA ladder、Sybr qPCR mix和反转录试剂盒(Invitrogen)、poly⁃brene(Sigma)。PCR扩增仪(Applied Biosystems)、凝胶成像仪(biorad)、核酸测定仪(Thermo)、倒置荧光显微镜及图像分析系统(Nikon)、冷冻高速离心机(Thermo)、qPCR仪(ABI)。
1.2 过表达lncRNA HOTAIR慢病毒载体的构建
1.2.1 LncRNAHOTAIR目的基因的PCR扩增LncRNAHOTAIR基因序列查找自NCBI,采用Primer Premier5.0及VECTOR NTI软件设计lncRNAHOTAIR基因的PCR扩增引物,分a、b片段。a片段正向引物:5′-TCGTTGGGGCCTAAGCCAGTACC-3′,反向引物:5′-CATAATACTAGTCTC-GAGTTTATATTCACCA⁃CATGTAAAACTTTATTTATGC-3′;b片段正向引物:5′-TGGCAAAGAATTGGATCCCCAGTTCTCAGGC⁃GAGAGCC-3′,反 向 引 物 :5′-TACTGGCTTAG⁃GCCCCAACGAGCTTATAAGGAAGGCGCC-3′。PCR反应体系:正、反向引物各1µL,5×buffer 10µL,dNTP 4µL,模板 10µL,PrimeSTAR 0.5µL,ddH2O 32.5µL;反应条件:98℃ 3 min,98℃ 10 s,55℃ 15 s,72℃ 1 min,30个循环,72℃10min。扩增完成后,经琼脂糖凝胶电泳并回收产物。
1.2.2 重组载体的构建与鉴定 采用BamHI-HFHF和XhoI对工具载体PMT406进行酶切,回收8537bp载体片段,将目的DNA片段和线性化载体以摩尔比2∶1加到试管中进行重组反应,反应体系:线性化表达载体1µL,回收的HOTAIR基因片段4µL,无缝克隆反应液 15µL,加ddH2O补充到20µL,42℃孵育30 min。取100µL DH5a感受态细胞于冰上,待溶解后加入10µL连接液,轻轻旋转混匀后置于冰上30min。42℃水浴锅热激90s,快速将管转移到冰浴中,冷却2~3min后每管加900µL LB培养液,然后将管转移到37℃摇床上温育1 h使细菌复苏,取适当菌液涂于氨苄抗性LB琼脂平板上,倒置平皿于37℃恒温培养箱中培养16h。挑取平板上长出的菌落重悬于10µL LB培养液中,从中取1µL做模板进行菌落PCR鉴定,鉴定引物。正向引物 :5′-CTCTCTGTCCCGGCTGGATG-3′,反 向 引物 :5′-CGTCGCCGTCCAGCTCGACCAG-3′。 PCR反 应 体系:正、反向引物各 0.8µL,10×buffer(含Mg2+)2µL,dNTP 1.6µL,模板1µL,Taq酶 0.1µL,ddH2O 13.7µL;反应条件:94℃ 5 min,94℃ 30 s,55℃ 30s,72℃ 1min,30个循环,72℃ 10min。扩增完成后,经琼脂糖凝胶电泳选取阳性克隆,分装100µL经上海美吉生物医药科技有限公司进行测序,之后再接种抽提质粒。
1.3 慢病毒包装、纯化及滴度测定将293T细胞接种至10cm培养皿中,待细胞融合度应大致为80%~90%并分布均匀时,准备进行慢病毒包装。转染前1 h,更换Opti-MEM培养基。加入载体质粒100µg、dR8.9包装质粒65µg和疱疹性口腔炎病毒糖蛋白G(Vesicular stomatitis virus-G protein,VSVG)质粒35µg,用Opti-MEM培养基调整体积至5 mL,加入5 mL Trans-EZ稀释液并混匀。室温孵育20 min后以每皿1mL均匀滴入293T细胞培养液中,混匀后置37℃、5%CO2培养箱6h,更换新鲜DMEM完全培养基。继续培养48 h后收集细胞上清液,于4℃、500g,离心半径10cm,2100r/min,离心10min,除去脱落的细胞碎片后,用60 mL 0.22µm PVDF过滤装置过滤,4℃、700 g,离心半径10 cm,25 000 r/min,离心2 h,充分溶解后4℃、500 g,离心半径10 cm,2100 r/min,离心1 min,重悬后收集病毒悬液分装保存于-80℃。
取24孔板以每孔5×104个接种293T细胞,当细胞融合率为40%~60%时进行病毒感染,加入的稀释病毒体积分别为10、1、0.1µL;收集细胞后用定量PCR法得到每基因组整合的病毒拷贝数并计算病毒滴度。公式如下:
病毒滴度(IU/mL)=(C×N×D×1000)/V
其中C=平均每基因组整合的病毒拷贝数,N=感染时细胞的数目(约1×105),D=病毒载体的稀释倍数,V=加入的稀释病毒的体积数。
1.4 过表达lncRNA HOTAIR慢病毒感染HFLSRA稳定转染细胞株的构建与筛选
1.4.1 最适感染复数的选择 以每孔1×105个细胞密度将HFLS-RA细胞接种于12孔板的6个孔,培养24h后加入病毒,病毒加入量(µL)=[细胞数×最适感染复数(multiplicity of infection,MOI)值/病毒原液滴度]×103,分设MOI 10、20、40、80、160共5个梯度,每孔加8µL稀释的polybrene,使细胞样品中polybrene终浓度达到8µg/mL,感染72h后观察荧光表达量并根据感染效率选择最适MOI值。
1.4.2 稳转株的构建与筛选 将处于对数生长期的HFLS-RA细胞计数后按每孔1×105个细胞密度接种至6孔板,培养12 h后分别用过表达载体和阴性对照载体慢病毒按照最适MOI值进行侵染,侵染后8h更换为完全培养基。侵染48 h后,加2µg/mL嘌呤霉素进行筛选,持续2周,得到过表达lncRNAHOTAIR的稳转株和阴性对照稳转株。
1.4.3 qPCR法检测转染后HFLS⁃RA细胞内ln⁃cRNA HOTAIR表达情况 采用Trizol法分别提取空白细胞、阴性转染细胞和过表达细胞的总RNA后,反转录得到cDNA后进行qPCR扩增。LncRNAHOTAIR引物设计:正向引物:5′-GCTTCCTT⁃GCTCTTCTTAT-3′,反向引物:5′-TGAGATAGAG⁃GTGCTTGG-3′。PCR反应体系:正、反向引物各1µL,Sybr qPCR mix 10µL,cDNA 2µL,ddH2O 6µL;反应条件:95℃ 2 min,94℃ 20 s,60℃ 20 s,72℃ 30 s,30 个循环。根据检测结果,采用 2-ΔΔCt法进行相对表达量的计算。
1.5 统计学分析采用SPSS 17.0软件进行数据分析。计量资料采用均数和标准差(xˉ±s)描述,组间均数比较采用单因素方差分析,两两比较采用LSD检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 LncRNA HOTAIR目的基因的PCR扩增LncRNA HOTAIR目的基因PCR扩增后,得到产物1836bp及590bp特异性条带,与预测HOTAIR目的基因的长度(2426bp)一致,见图1。

图1 lncRNA HOTAIR基因扩增电泳图Figure 1 Electrophorogram for the amplification of the lncRNA HOTAIR gene
2.2 重组载体的构建与鉴定 重组质粒经转化后,挑取阳性克隆菌落重悬于10µL LB培养液中,从中取1µL做模板进行菌落PCR鉴定,得到1357bp阳性克隆和0bp阴性克隆,表明过表达lncRNA HOTAIR重组质粒构建成功,见图2。图3显示过表达ln⁃cRNA HOTAIR重组载体部分测序结果与HOTAIR基因序列基本一致。
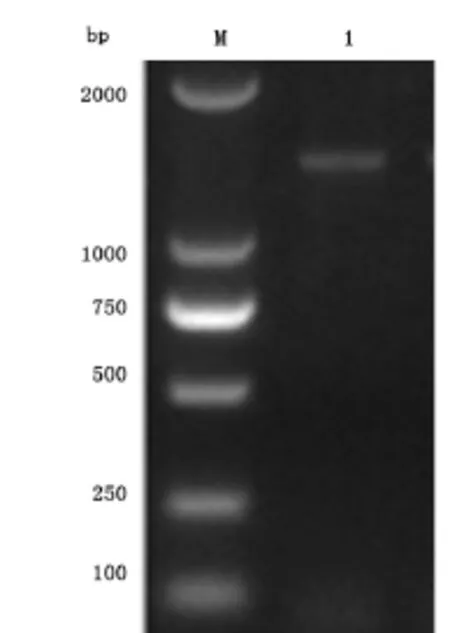
图2 重组质粒PCR产物鉴定Figure 2 PCR identification of the recombinant plasmid
2.3 过表达lncRNA HOTAIR慢病毒滴度测定构建好的过表达lncRNA HOTAIR慢病毒滴度为1.54×108IU/mL,慢病毒对293T细胞的感染情况见图4,随着加入病毒体积的增加,HOTAIR过表达慢病毒对293T细胞的感染量逐渐增大。
2.4 MOI的选择随着MOI的逐渐增加,病毒感染效率也相应提高,见图5。MOI为 10、20、40、80、160时,感染效率分别40%、70%、85%、100%、100%。由于过多的病毒颗粒会影响细胞状态,故本研究选择MOI 40进行后续实验。
2.5 过表达lncRNA HOTAIR慢病毒感染HFLSRA稳转株的构建与筛选过表达稳转株和阴性对照稳转株的荧光率均达到98%以上,且嘌呤霉素抗性明显,空白细胞无荧光显示,提示病毒感染HFLSRA细胞成功,见图6。
2.6 qPCR法检测转染后HFLS-RA细胞内ln⁃cRNA HOTAIR表达情况过表达细胞的lncRNAHOTAIR相对表达量(30.329±3.860)较空白细胞和阴性转染细胞(1.001±0.048、0.892±0.247)明显升高,差异有统计学意义(P<0.05)。空白细胞和阴性转染细胞差异无统计学意义(P>0.05)。说明过表达lncRNAHOTAIR的HFLS-RA细胞稳定株构建成功。

图3 过表达lncRNA HOTAIR重组载体部分测序结果Figure 3 Sequencing of the recombinant vector overexpressing lncRNA HOTAIR

图4 过表达lncRNA HOTAIR慢病毒对293T细胞的感染情况(×100)Figure 4 293T cells infected with lentivirus with the over⁃expression of lncRNA HOTAIR(×100)

图5 慢病毒感染HFLS-RA最适MOI测定(×100)Figure 5 HFLS-RA cells infected with lentivirus detected by optimum MOI(×100)

图6 过表达lncRNA HOTAIR及对照病毒转染的HFLSRA细胞(×100)Figure 6 HFLS-RA cells transfected with lentivirus with the overexpression of lncRNA HOTAIR or neg⁃ative control lentivirus(×100)
3 讨 论
RA是一种慢性、迁延性自身免疫性疾病,能侵蚀并造成骨质破坏,与血管、代谢、心理疾患等密切相关[9]。滑膜炎症和血管翳的形成是RA的基本病理改变,其具有很强的侵袭性,能造成骨与软骨、肌腱等的破坏[10]。作为最重要的血管生成因子之一,VEGF在RA滑膜血管翳的发生发展中起到了关键作用,能有效介导新血管产生,参与血管翳生成[11-12]。调控VEGF表达、抑制滑膜炎症及血管翳生长成为RA的研究重点,而lncRNAHOTAIR可能参与其中。因此本研究构建与筛选过表达lncRNAHOTAIR的人类风湿关节炎成纤维样滑膜细胞稳定株。
研究显示lncRNAHOTAIR表达的抑制可能与基质降解酶和NF-κB的活性上调相关,使RA成纤维样滑膜细胞的表型活化,在RA的发展中具有良性意义[13]。然而有一些研究认为HOTAIR可通过抑制miR-568来确保活化T细胞核因子的活性,从而启动钙结合蛋白S100A4的表达并激活VEGF,促进乳腺上皮细胞血管新生[14]。张聘等[15]指出HOTAIR可能通过上调骨关节内的炎症因子水平,加重软骨损伤和骨破坏。这种矛盾使得HOTAIR在RA的病理过程和以VEGF为核心的血管新生发挥着何种作用成为值得进一步研究的问题。因此为进一步探索HOTAIR在RA发病中的功能和机制,本研究采用了慢病毒转染的方式对HFLS-RA细胞进行了HOTAIR过表达。
慢病毒载体来源于人免疫缺陷病毒,能实现外源目的基因向靶细胞或动物组织的高效转染,达到对目的基因序列的长期、稳定表达[16],已被广泛用于生物学、医学等许多领域的研究。本研究用三质粒表达系统,在成功扩增lncRNAHOTAIR基因的基础上,通过基因重组手段将其导入到工具载体PSE3320上,经鉴定、测序构建了目的基因的表达载体;进一步采用含有CMV启动子的包装质粒,该质粒能降低与载体成分的同源重组,减少病毒恢复为野生型的风险,具有较高的安全性;包膜质粒含有表达VSVG蛋白的基因序列,能在提高病毒包装稳定性、降低风险的基础上,提高病毒感染宿主的范围[17],在293T细胞中成功构建了过表达HOTAIR的慢病毒载体。随后通过转染HFLS-RA细胞并用嘌呤霉素筛选,获得了稳定过表达lncRNAHOTAIR的RA成纤维样滑膜细胞及其阴性对照株。并对筛选出的细胞进行qPCR法验证表明,与空白细胞和阴性转染细胞相比,过表达的lncRNAHOTAIR表达量明显升高(P<0.05),成功对过表达HOTAIR的HFLSRA细胞株进行了建立和筛选。
综上所述,本研究成功构建了稳定过表达ln⁃cRNAHOTAIR的HFLS-RA细胞株及阴性对照稳定株,为进一步探究该RNA在RA发生发展中的作用提供了实验材料。