体重指数与胃癌根治术后预后关系
杜泽东,张 璇,王定平,余妍忻,张维汉,李 秋
0 引 言
胃癌是常见消化道肿瘤,分别位于恶性肿瘤中发病率第5位、病死率第3位[1]。目前我国胃癌5年生存率35.1%[2]。因此,需要关注胃癌术后预后因素,以提高生存。
体重指数(BMI)与胃癌的发生、发展关系密切。肥胖增加了胃癌的发病率,超重和/或肥胖与多种胃肠道癌症预后不良相关,包括食管癌、胃癌、肝细胞癌、胰腺癌和结肠癌[3]。多项研究表明,术前营养不良与手术并发症有关[4-5]。围手术期营养不良可减弱全身免疫系统。此外,术前营养不良与癌症复发和非癌症死亡风险增加有关[6-7]。BMI对于胃癌术后并发症的预测功能已有报道,但对于术后生存的预测价值尚存争议[8-9]。本研究拟分析不同分类标准的BMI与胃癌根治术预后的关系。
1 资料与方法
1.1 研究对象回顾性分析四川大学华西医院2008年12月-2013年7月行胃癌根治术患者的临床资料。纳入标准:①经过病理证实为原发胃癌;②未进行新辅助化疗;③无远处转移;④临床资料及生存时间信息完整。排除标准:①生存期间未见复发,但因胃癌外其他原因死亡;②仅在四川大学华西医院行残胃切除的患者;③合并其他类型肿瘤。
1.2 观察指标纳入分析因素包括年龄、性别、家族史、身高、体重、BMI、是否辅助放化疗;病理指标包括肿瘤部位、分化程度、肿瘤大小、Lauren分型、血管侵犯、神经浸润、浸润深度(T分期)、转移淋巴结数量(N分期)、淋巴结阳性率[10-11]、癌结节、肿瘤直径[12]。收集入组对象的生存时间(overall surviv⁃al,OS)与无病生存期(disease-free survival,DFS)。
1.3 BMI标准及分组通过查阅电子病历获取纳入研究患者的身高、体重,并计算BMI值。BMI=体重/(身高)2。分别按照WHO、亚洲及中国3种标准分为肥胖组(高BMI)、非肥胖组(正常BMI)2组以及低体重、正常、超重、肥胖表1。本组患者按不同标准分类结果见表2。

表1 BMI分类标准Table 1 BMI Classification criteria

表2 不同标准BMI分类数量Table 2 The number of different standard BMI classifica⁃tions
1.4 随访通过HIS系统病例查询、电话、门诊等方式进行随访。随访截止至患者死亡或固定日期(2017年3月7日)。至随访截止日期仍存活的患者以随访截止日作截尾处理;对失访患者或者复发信息不完整全部予以排除。
1.5 统计学分析应用SPSS 20.0软件进行统计学分析,生存分析采用Kaplan-Meier方法,计量资料采用(xˉ±s)表示,相关性分析采用 Pearson卡方检验、独立样本t检验,单因素分析采用Log-rank检验,单因素分析中P<0.05纳入多因素分析,多因素分析采用Cox比例风险模型。以P≤0.05为有统计学意义。
2 结 果
2.1 一般资料最终纳入460例具有完整术前BMI数据,且行胃癌根治术患者。其中男336例、女124例,中位年龄58岁,中位随访时间64.5个月(95%CI:9.6~93.3个月),失访率48.3%。
2.2 影响胃癌术后5年OS因素分析结果显示,文化程度、职业状态、肿瘤部位、血管侵犯、神经侵犯,手术方式、T分期、N分期、术后辅助化疗、癌结节、淋巴结转移阳性率、肿瘤直径、BMI影响患者5年OS(P<0.05),见表3。进一步行多因素分析结果显示,术后辅助化疗、T分期、N分期、职业状态是胃癌根治术后5年OS独立危险因素(P<0.05)。其中,低T分期、低N分期、给予术后辅助化疗、有工作患者成为预后的保护因素,见表4。
2.3 不同BMI标准与OS、DFS相关性分析传统4分类BMI分组中,3个不同分类标准(WHO、中国、亚洲)标准5年OS、DFS差异均无统计学意义(P>0.05),见表5、表6。采用肥胖、非肥胖2分类BMI中,亚洲分类标准的BMI中肥胖组OS延长,差异具有统计学意义(P=0.046),WHO及中国标准BMI肥胖组未见OS延长,差异无统计学意义(P>0.05)。对辅助化疗、放疗组亚组分析显示,亚洲标准BMI中非肥胖组对比肥胖组OS、DFS均未见明显延长,差异无统计学意义(P>0.05)。
2.4 亚洲标准BMI与并发症及临床病理因素的相关性460例患者中36例患者出现术后并发症。与亚洲标准BMI肥胖组对比,非肥胖组术后并发症发生情况差异无统计学意义(P=0.108);但是与术前合并疾病存在差异(P=0.018)。BMI亚洲标准与T分期、N分期、癌结节、血管侵犯、神经侵犯、Lau⁃ren分型均无显著相关性(P>0.05)。见表7。
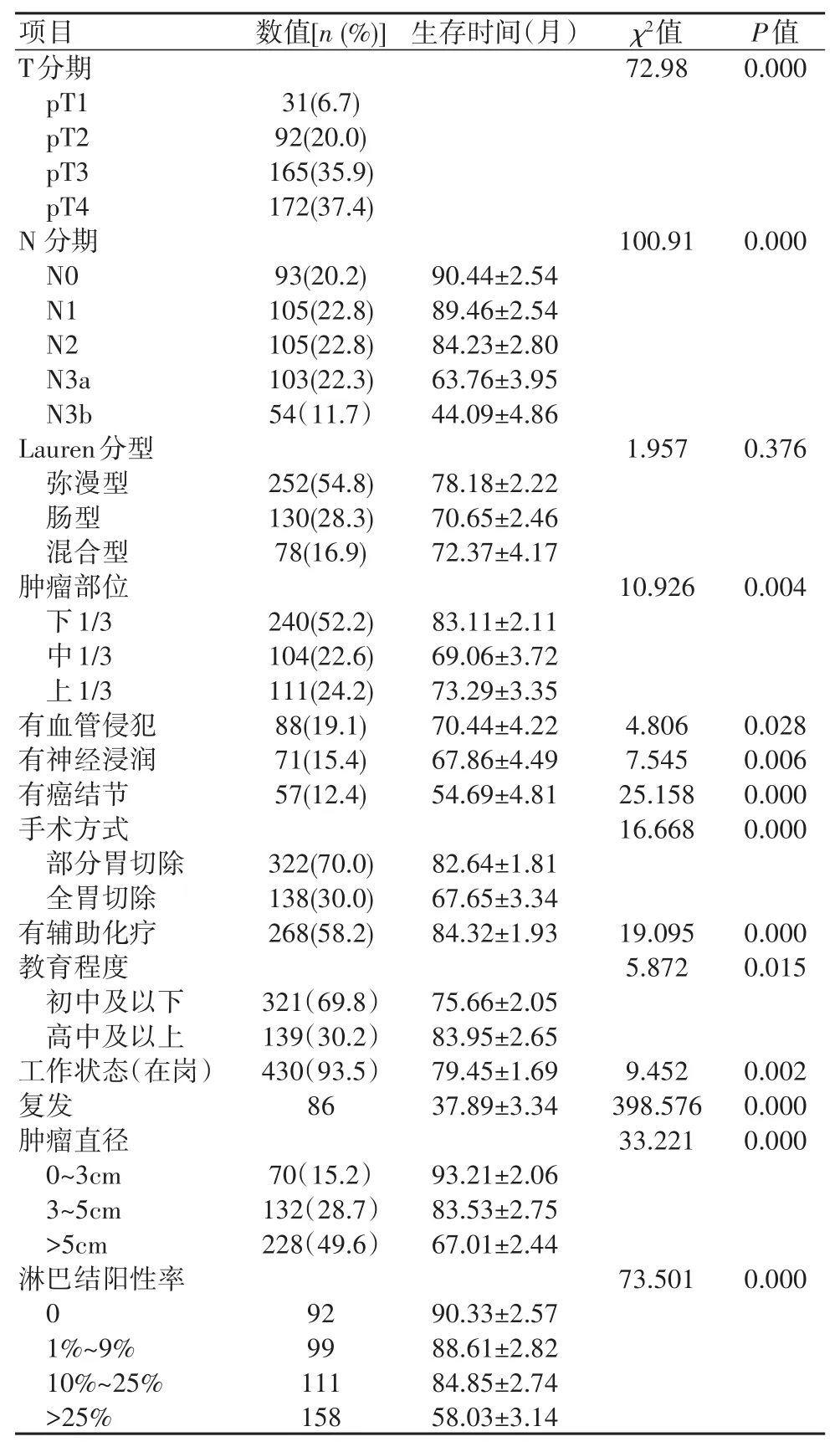
表3 基线特征及影响胃癌根治术后生存时间的单因素分析结果Table 3 Baseline characteristics and univariate analysis of survival time after radical resection of gastric can⁃cer results
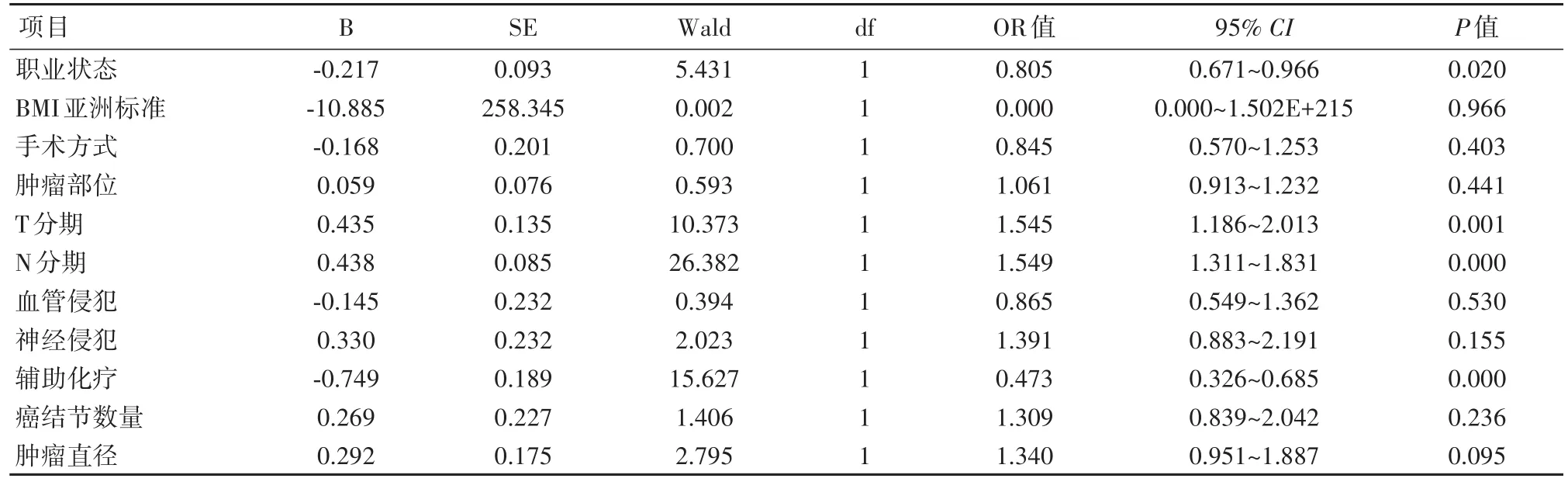
表4 本组胃癌根治术患者术后多因素分析结果Table 4 Multivariate analyses of factors associated with over survival of gastric cancer after curative resection

表5 三种BMI分类标准的胃癌根治术后总生存时间比较Table 5 Comparison of overal survival time after radical resection of gastric cancer with three kinds of BMI classification criteri
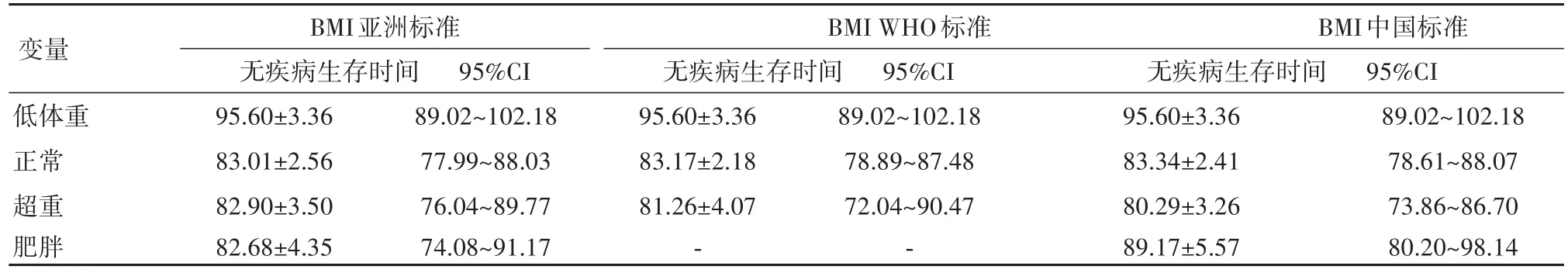
表6 三种BMI分类标准的胃癌根治术后无疾病生存时间比较Table 6 Comparison of disease-free survival time after radical resection of gastric cancer with three kinds of BMI classifi⁃cation criteri

表7 亚洲标准BMI各组临床病理变量分析Table 7 Analysis of clinicopathological variables in Asian standard BMI groups
3 讨 论
随着人民生活水平的提高,肥胖逐渐成为一个世界性的难题。根据世界卫生组织的统计,截止2012年,世界肥胖人口已经超过2亿,越来越多的证据表明,肥胖与许多疾病存在着密切的关系[13]。在肿瘤方面,国外许多研究发现,肥胖与乳腺癌、结直肠癌及胰腺癌存在密切联系,并且能够降低肿瘤患者总体生存率。然而,结肠癌、胃癌等一些消化道恶性肿瘤的生存预后与肥胖之间的联系尚不确切,胃肠道肿瘤后营养状态改变影响预后,一定程度上影响了诊疗过程中的一些干预决策。因此,本研究旨在明确BMI与胃癌根治术后生存预后的相关性,指导临床通过指导术前评估,从而通过体重干预提高临床疗效。
本研究对影响胃癌根治术后生存的指标单因素分析显示,文化程度、职业状态、肿瘤部位、血管侵犯、神经侵犯,手术方式、T分期、N分期、术后辅助化疗、癌结节、淋巴结转移阳性率、肿瘤直径、BMI(亚洲标准)与胃癌术后5年OS相关,与最新版指南中结论一致[14]。本研究结果显示,高BMI为保护性因素,高BMI患者的术后生存情况较好,而低BMI则欠佳。推测原因与胃切除术自身具有的体重变化规律有关。胃癌患者术后体重下降明显,术后3个月下降至最低,直至术后1年体重才趋于稳定,而在术后恢复的过程中患者对营养具有较高的需求。高BMI的患者具有较好的营养储备以满足患者术后的恢复及术后辅助放化疗。反之,低BMI无法满足患者术后的身体需求,从而术后恢复或预后生存状况欠佳。Lee等[15]的研究显示高BMI组胃癌术后1年OS、DFS增加,与本研究结论相似。BMI亚洲标准中高BMI(肥胖)比低BMI组(非肥胖患者)OS延长,故高BMI是胃癌根治术后的保护性因素,高BMI患者具有更好的预后。
尽管高BMI提高患者营养,延长OS,但是也增加手术难度,是否增加术后并发症存在争议。本研究提示BMI与术后并发症未见相关性,高BMI未显著增加术后并发症,但是术前合并症在高、低BMI组存在明显差异,高BMI组术前合并疾病更多。Inagawa等[16]的研究显示肥胖增加了术中血液丢失,增加手术时间,但是术后并发症未见显著差异。
BMI在放化疗、靶向治疗、免疫治疗后能否预测治疗疗效存在争议。本研究中给予辅助放化疗患者中进行亚组分析,结果发现差异无统计学意义,故BMI不能预测放化疗的疗效。在国外其他研究中得到类似的结论。McQuade等[17]的研究显示,BMI能够预测黑色素瘤免疫治疗、靶向治疗的疗效,不能预测化疗疗效。该研究在晚期黑色素瘤中,肥胖患者在接受免疫治疗和靶向治疗中期OS及PFS延长,但是在化疗中没有显示出差异。Chen等[18]的研究分析了胃癌腹膜转移患者518例,单因素分析提示,BMI是预后的因素之一,多因素分析BMI是独立预后指标,尤其接受了姑息化疗的患者。与Chen等[18]的研究比较,2项研究纳入病例存在差异。本研究中纳入I-III期胃癌;Chen等[18]研究中纳入胃癌腹膜转移IV期患者,基线标准存在差异。本研究属于术后辅助化疗;而Chen等[18]研究属于晚期一线化疗,化疗目的不同,身体耐受性也不同,得到结论自然不同。
本研究具有一定的局限性:随访率较低、无中位生存时间、DFS缺失较多,未分析手术质量控制,尤其腹腔镜下胃癌根治术可能也是影响胃癌术后并发症及预后的因素[19]。
总之,采用亚洲BMI分类标准更适合本研究人群,亚洲标准高BMI(肥胖组)是影响胃癌根治术后OS的保护性因素,高BMI组OS延长且未明显增加术后并发症。是否给与术后辅助化疗,T分期、N分期、职业状态的胃癌根治术后独立的危险因素。