内质网应激蛋白CHOP、Caspase-12在药物性肝损伤大鼠肝组织中的表达变化及作用研究
彭馨仪 罗新华
(1.贵州医科大学,贵州 贵阳 550025;2.贵州省人民医院感染科,贵州 贵阳 550002)
药物性肝损伤(drug-induced liver injury,DILI)是各种化学药物、生物制剂、传统中药等诱发的肝损伤,是最常见和最严重的药物不良反应(adverse reactions to drug,ADR)之一,占我国急性肝损伤住院比例的20%[1-2]。现阶段研究显示,DILI的发病机制主要概括为药物的直接肝毒性和特异质性肝毒性,但具体机制有待于进一步阐明[3]。内质网作为参与细胞生物合成、解毒和Ca2+储存的重要细胞器,其功能紊乱对药物性肝损伤的发生是否有影响目前少有报道。探讨药物性肝损伤发病的具体机制,对寻找更有效的防治措施有积极意义。报告如下。
1 材料与方法
1.1材料 (1)动物:SPF级Wister大鼠60只,雌雄各半,体质量(150±10) g,购于贵州医科大学动物实验中心,动物使用许可证号:SCXK(黔)2012-0001。(2)药品与试剂:异烟肼片(成都锦华药业有限责任公司)100mg/片,β肌动蛋白(β-non-muscle,β-Actin)、环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP-homologous protein,CHOP)、Caspase-12一抗抗体(英国abcam公司),辣根过氧化物酶标记的兔抗羊IgG二抗(武汉博士得生物科技公司),细胞凋亡检测试剂盒(roche In situ cell death detection kit,POS)、蛋白酶K(瑞士Roche公司),ECL发光液(北京雷根生物技术有限公司),苏木素-伊红(hematoxylin-eosin staining,HE)染料(北京鼎国昌盛生物技术有限责任公司),组织裂解液(碧云天),DAB显色液(索莱宝)等。(3)仪器:ChemiDocTMTouch Imaging System(732BR0475,美国伯乐),分光光度计(1510,美国赛默飞世尔科技),双垂直电泳仪(DYCZ-24EN型,北京市六一仪器厂),徕卡显微镜(DM500,德国徕卡),转移脱色摇床(TS-8,海门市其林贝尔仪器制造有限公司),三用水箱(600型,金坛市富华仪器有限公司),台式低速冷冻离心机(L530R,湖南湘仪实验室仪器开发有限公司),高速冷冻离心机(Microfuge 20R,德国),微量移液器(德国Eppendorf)等。

2 结 果
2.1一般情况 模型组大鼠体质量比对照组增长慢。随着给药时间的延长,模型组出现被毛蓬松、脱落,进食量减少,反应迟钝,肝指数增加,给药11 d后出现部分大鼠死亡。见表1。
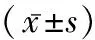
表1 各组大鼠体质量及肝脏指数
注:*与对照组比较P<0.05,△与对照组比较P<0.01。
2.2血生化变化 与对照组比较,模型组ALT、AST均增高,造模7 d后开始模型组与对照组间ALT、AST差异均有统计学意义。见表2。
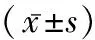
表2 各组大鼠血清生化指标改变
注:*与对照组比较P<0.05,△与对照组比较P<0.01。
2.3病理形态学变化 模型组大鼠肝组织在用药3 d后未见明显异常改变;7 d时可见肝细胞胞浆疏松化,肝小叶有炎细胞浸润;10 d时出现灶状坏死,肝窦变窄;14 d可见肝束排列紊乱,肝窦狭窄,轻至重度胞浆疏松化,坏死灶增多;21 d出现肝小叶结构破坏,肝窦狭窄,肝细胞广泛坏死,伴有肝细胞再生。见图1。

图1 各组大鼠肝组织结构变化(HE染色,100×)
2.4异烟肼对大鼠肝细胞凋亡的影响 TUNEL法检测凋亡细胞,对照组均无明显凋亡,模型组给药3 d凋亡细胞较少,给药7 d凋亡细胞增多,在14 d达到高峰,此后维持在较高水平,见图2。模型组凋亡指数与对照组比较差异有统计学意义(F=20.38,P<0.01)。见表3。

图2 各组大鼠肝组织凋亡细胞检测(TUNEL法,400×)

区组视野凋亡指数(%)NGINH3 d80.80±0.110.82±0.127 d80.62±0.103.28±0.80△10 d80.73±0.137.01±1.12▲14 d80.68±0.158.16±1.45▲21 d80.70±0.167.52±1.29▲
注:△与对照组比较P<0.05,▲与对照组比较P<0.01。
2.5异烟肼对大鼠肝组织内质网应激蛋白CHOP、Caspase-12表达的影响 运用Western blot技术检测各组大鼠肝组织中CHOP、Caspase-12的相对表达值,结果显示,对照组CHOP、Caspase-12呈低表达,但各对照组间差异无统计学意义。与对照组比较,模型组CHOP、Caspase-12明显增高,在14 d表达量最大,21 d较14 d下降,差异均有统计学意义(CHOP:F=12.36,P<0.05;Caspase-12,F=26.65,P<0.01)。见图3、图4。

图3 各组大鼠肝组织内质网应激蛋白CHOP的表达

图4 各组大鼠肝组织内质网应激蛋白Caspase-12的表达
3 讨 论
药物性肝损伤是宿主、药物及环境等多危险因素参与、多机制先后或共同作用引发的一类疾病,在临床工作中多数病例不可预测,该病无论从其诊断还是治疗上来说都是肝病领域中一个具有挑战性的疾病[4]。DILI作为药物安全性问题的重要组成部分,已成为过去半个多世纪药物撤市的最常见原因,因此,药物的肝脏毒性正日益受到医学界、社会公众和药监部门的广泛关注和重视[5]。
本课题组使用异烟肼灌胃大鼠的方法建立药物性肝损伤动物模型,通过对比对照组与模型组大鼠的血清酶学、病理形态学、凋亡指数及内质网应激相关蛋白的表达变化,证明ERS凋亡蛋白CHOP、Caspase-12的高表达可能通过诱导过度的肝细胞凋亡引发肝损伤,这与文献[6]报道的肝实质细胞的凋亡是肝损害及肝纤维化的主要动因相符。内质网(endoplasmic reticulum,ER)是由生物膜构成的互相通连的片层隙状或小管状系统,存在于除哺乳动物成熟的红细胞外的各种真核细胞中,与糖类和脂类的合成、解毒、同化作用有关,还参与运输蛋白质,能分解甾体、灭活药物和毒物并使其能被排出体外,当内外因素刺激肝脏、破坏内质网稳态时,可引发未折叠蛋白反应(unfolded protein response,UPR)和内质网应激,使蛋白质的合成受到抑制,促使未折叠或错误折叠的蛋白质降解,这有利于减轻内质网蛋白负荷,恢复其稳态,从而维持细胞的正常功能,但持续、强烈的ERS会诱导细胞凋亡,引发组织损伤[7-8]。CHOP是内质网应激发生凋亡的标志性蛋白,它主要由内质网应激凋亡通路PERK/eIF2a-CHOP途径和ATF6-CHOP途径激活。CHOP基因的大量表达,可激活其多条下游凋亡通路,可引起细胞钙超载,激活Bcl-2相关X蛋白(Bcl-2-associated X,Bax),诱导线粒体途径凋亡[9-10]。CHOP还可诱导细胞产生过量的活性氧族(reactive oxygen species,ROS),导致细胞氧化应激反应的发生,进而引起细胞损伤[11]。Caspase-12是内质网应激特异性凋亡蛋白,只与ERS 介导的凋亡有关,在外源性的死亡受体途径和内源性的线粒体凋亡途径中不被活化。激烈或/和持续的ERS可引起Caspase-12的激活,激活的Caspase-12进一步切割激活Caspase-9,继而激活Caspase-3等一系列效应Caspases,诱导细胞凋亡[12]。在本研究中,模型组给药21 d后其CHOP、Caspase-12表达较14 d下降,凋亡指数降低,但大鼠的病理损伤较重,这一现象可能与肝损伤进展中其他致损伤因素介入有关。赵雄等[10]研究证实:ERS可以通过协同活化的cAMP应答元件结合蛋白H(CREBH)调节C反应蛋白水平进而促进细胞炎症。还有研究指出,内质网应激相关的凋亡可能是肝衰的早期病因,后期以坏死为主[11]。
本研究显示,内质网应激凋亡蛋白CHOP、Caspase-12的过表达与肝脏细胞凋亡变化趋势一致,内质网应激介导的过度凋亡可能是药物性肝损伤发生的重要机制,特别是在DILI的早期,是否能通过及时缓解过激的内质网应激,减少肝细胞凋亡,进而达到改善药物性肝损伤预后的目的有待于进一步研究。
——疾病防治的新靶标

