循环microRNA对原发性肝癌诊断价值的初步研究
赵西太, 聂青和, 龙振昼, 高禄化, 王媛媛
空军军医大学(第四军医大学)唐都医院传染病科/全军感染病诊疗中心,陕西 西安 710038
原发性肝癌(primary liver cancer,PLC)是指发生于肝细胞或肝内胆管上皮细胞的恶性肿瘤,按照组织学类型分为肝细胞肝癌(hepatocellular carcinoma,HCC)、胆管细胞癌(cholangiocarcinoma,ICC)、混合细胞型肝癌,前者最为常见(占70%~90%),也是本文重点讨论的类型。PLC是全世界第6位常见的恶性肿瘤和第2位肿瘤致死病因[1],而中国国家肿瘤登记中心2015年数据表明,PLC为我国第4位常见和第2位致死的恶性肿瘤,年发病例数及死亡数约为46.6万和42.2万,约占全世界的50%,发病率和死亡率均明显高于全球平均水平[2-3]。HCC的预后与临床分期关系密切,巴塞罗那分期系统(Barcelona Clinic Liver Cancer,BCLC)0期及A期HCC采用治愈性疗法手术切除、肝移植、射频消融术等可获得60%~80%的5年生存率,B期HCC患者中位生存时间仅2年左右,而C期、D期HCC除靶向治疗药物索拉非尼可有部分疗效外,无其他治疗方法可用,预后极差[4-6]。早期发现并及时给予适当的治疗是提高HCC总体疗效的关键措施,也得到了多项临床研究的支持[7]。HCC癌结节由肝动脉及门静脉双重血供,病灶强化呈典型“快进快出”,增强CT、增强MRI和超声造影检查的准确性很高,是HCC临床诊断的主要检查方法[8-9]。不过,影像学检查不易发现2 cm以下的小肝癌,且检查费用高昂,不适合用作HCC筛查和早期诊断[10],而目前临床上常用的腹部超声和血清甲胎蛋白(alpha-fetoprotein,AFP)筛查敏感性及准确性也不尽如人意[11-12]。
寻找灵敏、可靠而简便易行的HCC早期筛查方法临床意义重大,也是目前研究热点。大量HCC血清或组织标志物陆续被发现并进行临床研究,有望成为可靠的HCC筛查和早期诊断的工具。微小RNA(microRNA,简称miRNA)是其中的重要的部分[13]。miRNA是长度为19~25核苷酸的单链非编码RNA,序列高度保守,miRNA参与调控个体发育、细胞增殖/分化、细胞死亡、代谢等生物学过程,在基本生命活动中发挥重要作用[14]。近年研究发现,miRNA与多种恶性肿瘤的发生、发展、转移、复发密切相关,miRNA用于肿瘤早期诊断、治疗监测、预后预测等的研究是热门课题[15]。本研究拟通过生物信息学分析方法寻找PLC相关的循环miRNA,并探索其在PLC中的诊断价值。
1 资料与方法
1.1研究对象及资料收集收集2016年10月至2018年2月于空军军医大学(第四军医大学)唐都医院传染病科住院确诊为PLC、肝硬化的患者,并选择部分无肝病患者作为对照。依据《原发性肝癌诊疗规范(2017年版)》和《慢性乙型肝炎防治指南(2015年更新版)》诊断PLC和肝硬化[16-17]。本研究已获空军军医大学(第四军医大学)唐都医院伦理委员会审查批准,已告知入组患者其临床样本及病历资料使用情况,并获得同意。
纳入标准:(1)PLC组患者要求年龄18~80岁,经病理活检或至少两种影像学检查(腹部超声、超声造影、平扫+增强CT、平扫+增强MRI)发现典型PLC表现,诊断明确;(2)肝硬化组患者要求年龄18~80岁,经超声、瞬时弹性成像、CT、MRI或病理学检查确诊肝硬化(失代偿期或代偿期),病因包括慢性乙型肝炎、慢性丙型肝炎、自身免疫性肝病、酒精性肝病、非酒精性脂肪性肝病等。对照组要求未患有慢性肝病及其他严重急慢性疾病。
排除标准:(1)PLC组:患有转移性肝肿瘤,合并其他部位恶性肿瘤、巨大肝囊肿/血管瘤,以及临床诊断尚不明确、处于密切随访期的患者,均排除本研究观察对象;(2)肝硬化组:合并其他部位恶性肿瘤,及不能明确排除PLC者,临床高度怀疑有肝癌倾向者,均排除本研究观察对象。
医院电子病历系统中收集入组患者基本情况,包括性别、年龄、出院诊断、治疗情况,及采血日前后辅助检查、实验室化验资料,CT、MRI、超声、AFP、HBV DNA定量、HBsAg、HBeAg、HBeAb、anti-HCV、HCV RNA定量、ALT、AST、血清白蛋白、胆红素、WBC、PLT、RBC、血红蛋白、尿素、肌酐、凝血酶原时间、INR等。
1.2PLC相关miRNA筛选利用miRNA数据库miRBase、miRNA靶点预测数据库miRWalk 2.0、肿瘤基因组数据库TCGA等收集PLC相关miRNA表达数据进行生物信息学分析,筛选出可用的目标miRNA,具体方法见文献[18]。
1.3样本收集及血浆miRNA表达水平检测
1.3.1 主要试剂:血清/血浆:miRNA提取分离试剂盒(DP503)、miRcute 增强型miRNA cDNA 第一链合成试剂盒(KR211)、miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green)(FP411)购自北京天根生化科技公司,PCR下游引物为试剂盒自带的通用引物,PCR上游引物、外参照miRNA(cel-miR-39-3p)由上海生工生物工程公司设计、合成,引物序列如表1所示。
1.3.2 样本收集及处理:5 ml乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝真空采血管晨起抽取入组患者静脉血液约5 ml,立即混匀,30 min内进行血浆分离。简要步骤如下:取得血样后离心,条件:815×g,10 min,4 ℃;上清液(血浆)转移至15 ml无菌无酶离心管中,再次离心,条件:2 500×g,10 min,4 ℃;二次离心后的上清液分装至2 ml冻存管,液氮罐速冻约30 s,随后转存于-80 ℃冰箱中保存备用。

表1 miRNA-cDNA合成正向引物Tab 1 miRNA-cDNA synthesis forward primer
1.3.3 血浆miRNA提取及cDNA合成:血浆miRNA提取:按照试剂盒说明书进行操作,大致步骤如下:(1)样品预处理:取200 μl待检测血浆,加入900 μl裂解液MZA,旋涡振荡器振荡混匀30 s至完全匀浆,加入1 nmol/L的外参溶液5 μl,颠倒混匀,室温放置5 min,加入200 μl氯仿,剧烈振荡混匀15 s,室温放置5 min,13 400×g,4 ℃,离心15 min;(2)离心后液体分层,将上层无色水相转移至新离心管中并计量转移液体积,加入2倍体积的无水乙醇,混匀后转入吸附柱miRelute,室温放置2 min,13 400×g离心30 s,弃流出液,往吸附柱miRelute中加入700 μl去蛋白液MRD,室温静置2 min,13 400×g离心30 s,弃废液;(3)去蛋白处理后的吸附柱miRelute中加入500 μl漂洗液RW,室温静置2 min,13 400×g离心30 s,弃废液,重复操作该步骤一次,再将吸附柱miRelute室温13 400×g离心2 min,置于超净工作台上通风片刻,以充分晾干;(4)干燥后的吸附柱miRelute转入新的无酶离心管中,向吸附膜中心位置加15 μl无酶ddH2O,室温放置2 min,室温13 400×g离心2 min,重复该步骤一次,得到的miRNA溶液保存于-80 ℃。
cDNA合成:按照试剂盒说明书进行操作,在冰上预冷RNase Free的PCR反应管内加入2×miRNA RT Reaction Buffer 10 μl、miRNA溶液8 μl、miRNA RT Enzyme Mix 2 μl,混匀,配制成20 μl反应体系;反转录程序为miRNA加A尾反应和逆转录反应42 ℃、60 min,酶失活反应95 ℃、3 min,得到的cDNA溶液稀释10倍,4 ℃保存备用。
1.3.4 miRNA荧光定量检测:按照试剂盒说明书操作。20 μl反应体系配制:2×miRcute Plus miRNA Premix (with SYBR&ROX)10 μl,上游引物(10 μmol/L)0.4 μl,下游引物(10 μmol/L)0.4 μl,miRNA第一链cDNA 2 μl,ddH2O 7.2 μl。PCR反应程序设置如表2所示。
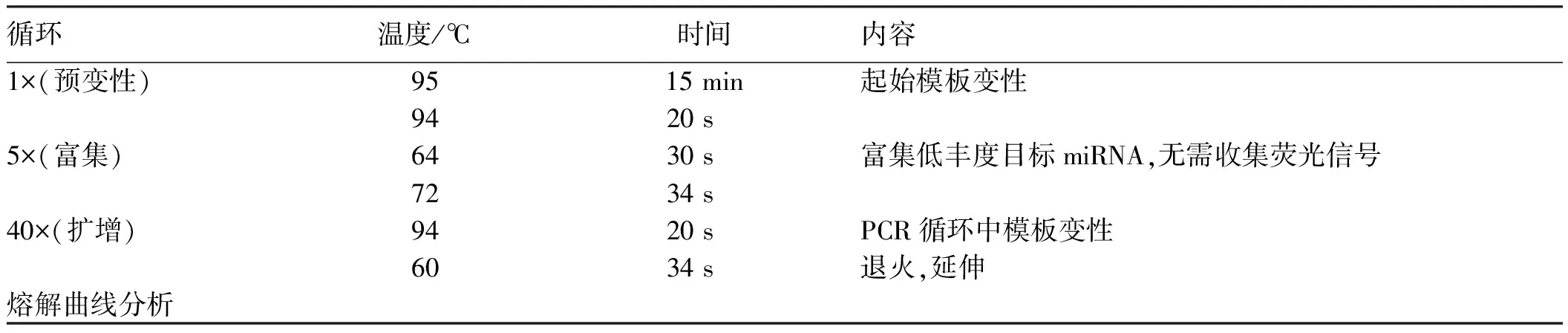
表2 PCR反应程序设置Tab 2 PCR response program setting
1.4诊断试验PLC组与肝硬化组之间血浆表达有显著差异的miRNA及AFP水平作为指标,分别绘制PLC诊断的受试者工作曲线(receiver operating characteristic curve,ROC),考察ROC曲线下面积(area under theROC,AUC)、灵敏度、特异度、约登指数;miRNA及AFP两两或多指标平行和系列诊断试验,计算其敏感度、特异度、准确度、约登指数;miRNA及AFP联合诊断PLC,经Wald逐步Logistic回归法构造回归方程,计算每个PLC、肝硬化患者的预测概率,以预测概率作为指标绘制PLC诊断的ROC曲线,计算上述诊断评价指标。
1.5统计学方法采用统计学软件SPSS 22.0进行数据分析,使用GraphPad Prism 6制作统计图。计量资料用均数±标准差或中位数(最小值~最小值)表示,计数资料(二分类及等级分类资料)表示为率或频数。计量资料两组间比较采用独立样本t检验,多组间比较采用方差分析(各样本独立、来自正态总体,且各样本的总体方差相等),或非参数方法Tamhane’sT2和Kruskal-Wallis检验,组间多重比较采用LSD或Bonferroni法检验,P<0.05为差异有统计学意义。
2 结果
2.1一般资料共纳入85例确诊患者。PLC组及肝硬化组患者病情相似,具有较好的可比性。3组白蛋白、ALT、尿素、肌酐、红细胞、血红蛋白比较,差异无统计学意义(P>0.05);其他病情指标如胆红素(P=0.466)、AST(P=1.000)、血小板(P=0.419),PLC组与肝硬化组比较,差异无统计学意义;患者年龄、性别构成及其他临床指标AFP、白细胞计数两组比较,差异有统计学意义(P<0.05)。PT、INR仅肝硬化组与对照组差异有统计学意义(P<0.05)。

表3 入组患者临床资料(1)Tab 3 Clinical data of included patients
注:(1)大部分数据样本的总体分布呈现明显偏态,统一描述为中位数(最小值~最大值),其组间比较采用非参数方法Kruskal-Wallis检验,组间多重比较采用Bonferroni法。(2)其中1例缺乏临床资料,除性别外的其他统计数据来自于7例对照。性别数据样本的总体分布呈正态性,但方差不齐,其组间比较采用非参数方法Kruskal-Wallis检验,组间多重比较使用卡方分割法。与肝硬化组相比,aP<0.05;与对照组相比,bP<0.05。甲胎蛋白(alpha fetoprotein,AFP);谷氨酸氨基转移酶(alanine aminotransferase,ALT);天冬氨酸氨基转移酶(aspartate aminotransferase,AST);凝血酶原时间(prothrombin time,PT);国际标准化比值(international normalized ratio,INR)。
2.2确定目的miRNA按照TCGA数据库中肝癌组织miRNA表达情况,miRWalk 2.0靶基因预测,及c-Bioportal上PLC相关突变基因信息,结合文献检索情况,确定4条目的miRNA(见表4)。

表4 目的miRNA概况Tab 4 Objective miRNAs survey
注:*:截至2017年10月11日。
2.3目的miRNA的血浆表达情况与肝硬化组相比,PLC患者血浆中miR-10b-5p、miR-21-5p表达水平升高,差异有统计学意义(P=0.028,0.004);而miR-1258表达水平基本相同(P=0.985),miR-1269a表达升高,但差异无统计学意义(P=0.223,见图1)。
2.4miRNA对PLC的诊断价值
2.4.1 miR-10b-5p、miR-21-5p、AFP对PLC的诊断价值:三者的AUC分别为0.651(P=0.023,95%CI:0.529~0.774)、0.730(P<0.001,95%CI:0.615~0.846)、0.731(P<0.001,95%CI:0.619~0.844);灵敏度分别为0.615(95%CI:0.446~0.766)、0.590(95%CI:0.421~0.744)、0.590(95%CI:0.421~0.744),特异度分别为0.658(95%CI:0.487~0.804)、0.868(95%CI:0.719~0.956)、0.790(95%CI:0.627~0.905);约登指数分别为0.273、0.458、0.379(见图2)。以上3个指标两两或三者一起进行平行诊断试验和系列诊断试验,可显著提高诊断的灵敏度或特异度(见表5)。
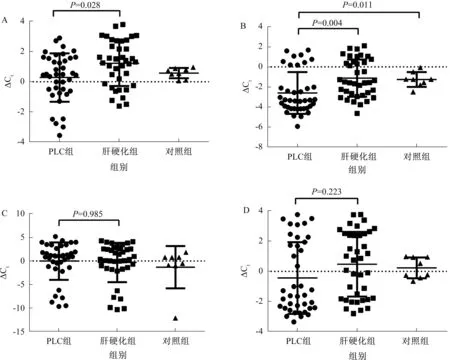
注:miRNA表达水平以目的miRNA与外参miRNA的Ct值之差,Ct表示其值越小,表达水平越高。图1 4种目的miRNA血浆表达情况 A: miR-10b-5p; B: miR-21-5p; C: miR-1258; D: miR-1269aFig 1 Expressions of four kinds of objective miRNAs in plasma A: miR-10b-5p; B: miR-21-5p; C: miR-1258; D: miR-1269a
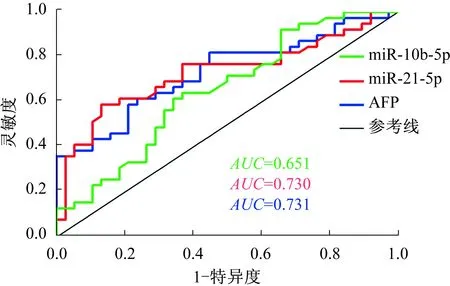
图2 miR-10b-5p、miR-21-5p、AFP诊断PLC的ROC曲线Fig 2 ROC curve of miR-10b-5p, miR-21-5p, AFP in the diagnosis of PLC
2.4.2 多指标联合显著提高诊断准确性:尝试使用miR-10b-5p、miR-21-5p、miR-1258、miR-1269a和AFP共5个变量进行PLC联合诊断。经Wald逐步Logistic回归法筛选以后,miR-1269a被排除在方程外,其余参数可用于方程构造(P<0.05)。经统计学检验,模型χ2=43.386,P<0.001,Logistic回归模型有统计学意义。Logistic回归方程如下:
logitP=-0.766ΔCt(miR-10b-5p)-0.558ΔCt(miR-21-5p)+
0.55ΔCt(miR-1258)+0.003X(AFP)
其中logitP为诊断为PLC与排除PLC(与肝硬化作对照)的概率之比的自然对数,即
logitP=ln[P/(1-P)]

表5 miR-10b-5p、miR-21-5p、AFP联合诊断试验准确性
注:OR表示平行试验,AND表示系列试验。
P为诊断试验中某一受试者被诊断为PLC的预测概率。根据以上公式,计算PLC组和肝硬化组共77例患者的预测概率,利用预测概率作ROC曲线,AUC=0.885(P<0.001,95%CI:0.811~0.960),约登指数为0.639,敏感度和特异度分别为0.718(95%CI:0.551~0.850)、0.921(95%CI:0.786~0.983)(见图3)。

图3 Logistic回归模型诊断PLC的ROC曲线Fig 3 ROC curve of Logistic regression model for diagnosis of PLC
3 讨论
PLC主要危险因素是肝硬化,其原因有慢性乙型病毒性肝炎、丙型病毒性肝炎、酒精性肝病、非酒精性脂肪性、肝病自身免疫性肝炎、慢性药物性肝损伤等[19-23],另外,致癌物如黄曲霉毒素也导致大量的PLC患者[24]。我国有庞大的慢性乙肝、丙肝患者,整体发生PLC的风险远高于世界平均水平,而预后并不理想,加强高危人群筛查、监测,早发现、早治疗PLC在我国尤其重要[2, 16]。目前每6个月至少一次的AFP和肝脏超声检查是主要的筛查手段,但敏感度较差,准确度也不令人满意,尤其对早期PLC,临床呼唤更早期、更准确的筛查方法[25]。有人尝试利用肝硬度值监测PLC的发生,但目前仅有初步观察性研究,尚需进一步高质量临床研究验证其临床应用价值[26-27]。近年来,高通量检测技术的发展催生了大量PLC血清学标志物,目前有几十种候选标志物正在进行临床研究,包括miRNA[28]。
循环miRNA广泛存在于人体多种体液(血液、尿液、唾液等)中,常包裹于外泌体内或与蛋白结合,理化性质稳定,能够抵抗血浆的内源性核糖核酸酶,经历24 h室温静置或8次冻融后丰度几乎不变,且有多种循环miRNA在PLC中表达水平发生显著变化,是十分理想的PLC血清学标志物[29-30]。大量临床研究证实,多种miRNA(miR-21、miR-122、miR-15b、miR-130b、miR-215等)表现出对HCC良好的诊断价值,具有诱人的临床前景[31]。但循环miRNA诊断HCC的准确性受多种因素影响,如miRNA表达模式(上调或下调)、截断值选择、对照人群(慢性肝病或健康对照)、qPCR内参基因(U6或其他)及样本类型(血清或血浆)等,选择特异性好、区分度好、不同PLC患者中表达水平相对稳定的miRNA,及多个miRNA联合使用,对于提高PLC诊断效能十分重要[32]。
很多研究者使用高通量检测方法(NGS和微芯片技术)从肝癌细胞系或少量临床患者癌组织、体液中筛选目的miRNA,用于后续分子机制或诊断试验等研究[33]。但该研究方法受样本量小、假阳性率高、费用高昂等因素影响,不易得到有价值的miRNA,且PLC亚型众多,小样本筛选miRNA可能代表性不强,用于分子机制研究尚可,如果用于诊断或预后预测研究则可靠性大大降低。本研究使用生物信息学方法从TCGA数据库中发掘PLC癌组织中差异表达的miRNA,在miRWalk 2.0分析其靶基因,进而与c-Bioportal上发表的PLC相关高频突变基因(>5%)相对比,靶基因与PLC相关高频突变基因重合者定位目的miRNA;随后在收集的PLC、肝硬化及对照者血浆中检测上述miRNA表达水平。本研究发现,miR-10b-5p、miR-21-5p在PLC患者血浆中表达水平偏高(P=0.028、0.004),与其他同类研究结果类似[34-35]。而miR-1258表达水平基本无变化(P=0.985),miR-1269a表达水平升高,但差异无统计学意义(P=0.223),考虑除与其本身表达水平不稳定、血浆丰度低以外,样本量偏小可能也是重要原因。
我们收集PLC和肝硬化患者血样进行检测,为使研究结论可靠,课题设计时强调排除可能患有肿瘤的病例。患有转移性肝肿瘤,合并其他部位恶性肿瘤、巨大肝囊肿/血管瘤,以及临床诊断尚不明确、处于密切随访期的患者,均排除PLC观察对象。而肝硬化组不纳入合并其他部位恶性肿瘤,不能明确排除PLC者,及临床高度怀疑有肝癌倾向者,均排除入组病例。本诊断试验结果表明,miR-10b-5p、miR-21-5p、AFP单独诊断PLC灵敏度及特异度均不甚理想,两两或三者进行平行试验或系列试验可显著提高灵敏度或特异度,但总体诊断效能无显著提高。考虑到miR-10b-5p、miR-21-5p、miR-1258、miR-1269a及AFP与PLC具有相关性,应用Logistic回归分析Wald逐步回归法筛选出可用参数miR-10b-5p、miR-21-5p、miR-1258及AFP,构造回归方程,计算预测概率作为联合诊断指标,该诊断指标的准确性大幅上升。该研究尚有不足之处,筛选得到的miRNA数量偏少,可能不利于高诊断价值miRNA的发现;纳入研究的病例较少,难以根据病情、并发症、年龄、性别等因素进行分层分析。
综上所述,生物信息学方法筛选目的miRNA是简便易行且可靠程度高的方法,但TCGA等数据库收录的数据体现的是肝癌组织的miRNA表达情况,而血浆中相应miRNA的表达水平有赖于肝癌组织产生外泌体、释放miRNA数量的多与寡,因此,血浆miRNA水平与肝癌结节大小及坏死程度、转移情况、治疗方法等因素密切相关,筛选的miRNA临床验证过程必不可少。单个miRNA诊断PLC准确性欠佳,利用Logistic回归法进行多个miRNA联合诊断可显著提高诊断准确性,可能成为miRNA诊断PLC的主要方法。

