1型传染性胸膜肺炎放线杆菌的分离鉴定及生物学特性
徐引弟 ,王治方 ,张青娴 ,朱文豪 ,李海利 ,焦文强 ,王克领
(1.河南省农业科学院畜牧兽医研究所,河南郑州450002;2.河南省畜禽繁育与营养调控重点实验室,河南郑州450002)
传染性胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)是引起猪传染性胸膜肺炎(Porcine contagious pleuropneumonia)的病原,是一种猪的高度接触性传染性呼吸道疾病,主要表现为暴发性流行,以纤维素性、出血性、坏死性肺炎为特征,发病率在8.5%~100%,死亡率在0.4%~100%,是当前导致育肥猪和种猪呼吸道疾病发病和突然死亡的主要原因,已在世界范围内造成了巨大的经济损失[1-5]。
胸膜肺炎放线杆菌血清型多达15种,且目前还有很多不能定型的临床分离菌株,其流行率因地理区域而异,不同血清的毒力和免疫原性存在差异,国内流行的血清型主要是 1,2,3,5,7 型,APP外毒素在致病与免疫中起着重要作用,APP一共有4种外毒素,即毒素ApxⅠ,ApxⅡ,ApxⅢ和 ApxⅣ,而且毒素ApxⅠ和ApxⅡ在APP毒力方面起着关键作用。不同血清型分泌的外毒素不一样。血清1型能同时分泌毒素ApxⅠ,ApxⅡ和ApxⅣ,是所有血清型毒株中毒力最强、免疫原性最好的毒株,同时也是我国流行的一种优势血清型毒株[6-10]。因此,APP的分离鉴定和准确的血清分型对于疫情诊断、疫情流行病学调查和该病的防治尤为重要。
本试验对河南省某规模化猪场突发育肥猪死亡的病例进行了传染性胸膜肺炎放线杆菌的分离鉴定和生物学特性研究,旨在为指导猪场科学及时防控该病、减少损失提供科学依据。
1 材料和方法
1.1 材料
1.1.1 病料 其来源于河南省汝州市某大型养猪场疑似病例的育肥猪,发病猪高烧、体温达42℃,口鼻流血,死亡很快,解剖肺脏充血出血严重,采集发病猪的肺脏、心血、关节及脑组织等。
1.1.2 主要试剂 动物基因组DNA抽提试剂盒,DL2000 Marker,2×PCR Mix,50×TAE 浓缩液,新生牛血清购自生工生物工程(上海)股份有限公司;TSA(胰蛋白大豆琼脂)、TSB(胰蛋白大豆肉汤)购自BD公司;NAD(辅酶Ⅰ)购自Roche公司;药敏纸片购自杭州滨和微生物试剂有限公司。
1.2 方法
1.2.1 培养基配制 TSA固体培养基和TSB液体培养基的制备参考文献[4]进行。
1.2.2 细菌的分离纯化 无菌采集病猪的肺脏、心血接种于TSA固体培养基上,37℃恒温培养箱中培养24 h,挑取圆形凸起、半透明、光滑、湿润的、侧对光线有虹光以及直径大小为1~2 mm的可疑菌落,革兰氏染色在油镜下观察细菌,挑单菌落纯化于TSA培养基上,同时将可疑菌落接种于不含NAD但含血清的TSA固体培养基上,观察菌落生长情况以及形态大小。
1.2.3 鉴定
1.2.3.1 引物设计 参考文献[11-12]报道,根据传染性胸膜肺炎放线杆菌ApxIV基因的序列设计1对通用引物P1,P2,用于传染性胸膜肺炎放线杆菌的扩增;同时根据传染性胸膜肺炎放线杆菌荚膜CPS1B基因的序列设计1对传染性胸膜肺炎放线杆菌1型的特异性引物P3,P4,用于传染性胸膜肺炎放线杆菌1型的扩增,引物由生工生物工程(上海)股份有限公司合成,引物序列列于表1。
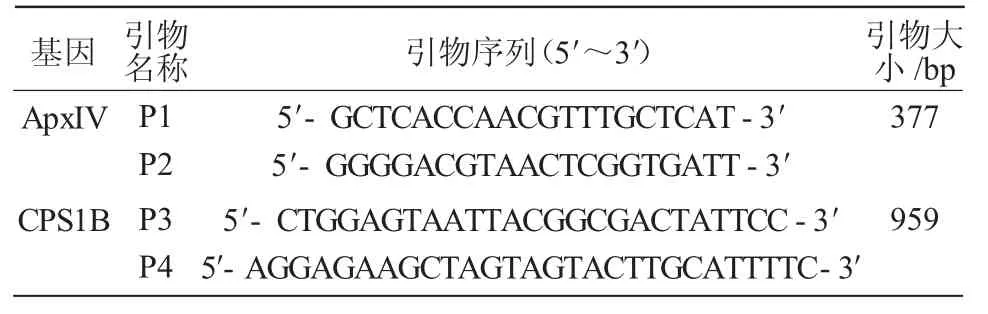
表1 PCR扩增HPS基因引物序列
1.2.3.2 APP的扩增 PCR反应体系(总体积25μL):2×PCR Mix 12.5 μL,10 μmol/L 上下游引物 P1,P2各1 μL,模板(按照DNA提取试剂盒的操作步骤提取出的 DNA)1 μL,加入 ddH2O至 25 μL。PCR 反应条件:95 ℃预变性 5 min;95 ℃ 30 s,56 ℃ 30 s,72℃30 s,35个循环后,72℃延伸10 min。取10 μL扩增产物进行电泳,观察结果。
1.2.3.3 血清型鉴定 参照1.2.3.2的方法,用APP1型的特异性引物P3,P4扩增,将扩增结果进行测序并用Blast比对。
1.2.4 毒力试验 试验动物为2月龄断奶健康的保育猪8只。试验动物分为2组:对照组4只,试验组4只。将鉴定的1型APP接种TSB液体培养基,37℃摇床培养18 h后,连续10倍稀释涂布TSA平板,活菌计数,计算原液菌体浓度,调整至108cfu/mL,试验组动物通过滴鼻感染3 mL 1型APP,对照组动物通过滴鼻接种3 mL灭菌的TSB液体培养基。连续观察14 d,并记录其发病数和死亡数等情况。
1.2.5 免疫原性试验 将分离的1型APP接种到TSB液体培养基,18 h后收取培养物,测定浓度,调整培养物中的菌数为2×109cfu/mL,每1 000 mL菌液加2 mL甲醛溶液,于37℃灭活12 h。灭活后的菌液按体积比1∶1加入氢氧化铝佐剂,混合制得传染性胸膜肺炎放线杆菌灭活疫苗。
选取2月龄健康仔猪10头,分为2组,每组5头。疫苗组注射本疫苗2 mL,对照组为未免疫组,注射2 mL灭菌生理盐水。疫苗组和对照组21 d后二免注射同等剂量的疫苗或灭菌生理盐水。二免后14 d各组用109cfu的APP菌液采取滴鼻攻毒,观察仔猪的临床表现,并每天测定体温,共观察14 d。对死亡猪肺脏等器官进行APP分离培养。
1.2.6 药敏试验 参考文献[13-14],采用K-B药敏纸片法,将纯化的菌落均匀涂布于TSA平板上,将药敏纸片贴于培养基表面,37℃培养24 h,测定抑菌环的直径,依据抑菌环直径判断标准来判定结果。
2 结果与分析
2.1 培养特性
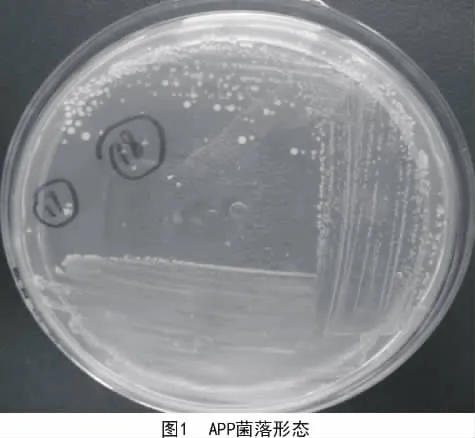

37℃恒温培养箱中培养24 h,长出一致的圆形凸起、半透明、光滑、湿润的直径大小为1.0~1.5 mm的菌落,45°折射光下观察具有明显的金红带蓝色虹光(图1);在不含NAD的TSA培养基上不能生长。革兰氏染色结果显示,该菌为革兰氏阴性菌,球杆菌、小杆菌、部分形成丝状的菌体(图2)。
2.2 菌株的鉴定
2.2.1 APP鉴定 对疑似APP的菌落进行APP的扩增,结果扩增出与预期大小一致的条带(图3),测序结果显示,与传染性胸膜肺炎放线杆菌8392株ApxIVA 基因(GenBank No.AF188867)达 99.5%同源。

2.2.2 血清型鉴定 用1型APP的特异性引物P3,P4扩增,结果扩增出959 bp大小片段(图3),测序结果显示,与1型传染性胸膜肺炎放线杆菌4074株(GenBank No.AF518558)达 100%同源,证明分离菌株为1型APP。
2.3 毒力试验
试验组动物在接种分离的1型APP 12 h后表现出呼吸困难等症状,体温升高,耳部、腹部及臀部发绀,最后卧地不起,肌肉抽搐,窒息死亡,死前口鼻流出带泡沫的血液;第2天死亡1头,2 d后死亡3头;对照组动物在试验期间正常。试验结束后,剖杀试验组动物和对照组动物,采集病料,进行APP分离。其中,试验组剖检肺紫红色,切面多汁,血色液体流出,气管、支气管充满泡沫状、血性黏液;对照组剖检均未发现病理变化,对照组的4份病料均未分离到APP,而试验组的4份病料中均分离到APP,PCR鉴定结果与分离菌一致。
2.4 免疫原性试验
结果显示,疫苗组与未免疫组存在明显的差异,攻毒后第2天,未免疫组的仔猪开始出现临床症状,体温升高,呼吸困难,开始出现死亡,死前口鼻流血,3 d内共死亡5头;剖检未免疫组死亡猪肺脏肿大出血,气管充满血性泡沫物。而疫苗组的5头仔猪没有发病,无临床症状,剖检无明显病变。
2.5 药敏试验
药敏试验结果显示,本次分离的1型APP敏感的药物有:头孢哌酮、阿莫西林、氨苄西林、头孢噻肟、头孢曲松、头孢呋辛、头孢吡肟、头孢唑肟、头孢克肟、头孢拉定、头孢噻吩、头孢唑林、头孢他定、头孢氨苄、利福平、万古霉素。耐受的药物有:多粘菌素、新霉素、复方新诺明、克林霉素、阿米卡星、环丙沙星、氧氟沙星、恩诺沙星、左氟沙星、阿奇霉素、四环素、壮观霉素、红霉素、卡那霉素、强力霉素、庆大霉素、罗红霉素、林可霉素、痢特灵、杆菌肽、呋喃唑酮、氨曲南、苯唑西林、哌拉西林、青霉素、氯霉素。
3 讨论
本试验分离的菌株1型APP分离自发生典型呼吸困难急性死亡的育肥猪的心脏,在TSA固体培养基上分离时无其他细菌生长,只有传染性胸膜肺炎放线杆菌生长,而且经鉴定为毒力最强的1型。动物回归试验显示,本试验分离的菌株1型APP对保育猪具有较强的致病力,引起保育猪发病死亡,而且具有良好的免疫原性,免疫后对强毒的攻击具有完全的免疫保护。药敏试验结果显示,本试验分离的APP主要对头孢类抗生素敏感,对其他药物多耐药,与已有研究报道结果相近[13-19]。根据以上试验结果,对未发病猪接种1型APP疫苗,对发病猪敏感药物治疗,及时地控制了疫情,减少了损失。

