核仁纺锤体相关蛋白1 在胆管癌组织中的表达及其临床意义
张善忠,付晓伟,刘芩,周毅
(1. 江西省景德镇市第一人民医院 普通外科,江西 景德镇 333000;2. 南昌大学第一附属医院 肝胆外科,江西 南昌 330006)
胆管细胞癌为来源于胆管上皮细胞的原发性恶性肿瘤[1-2],在肝胆系统肿瘤中排第2位,仅次于肝癌,约占整个消化系统恶性肿瘤的3%[3]。近年来,胆管癌的发病率及病死率都呈逐渐上升趋势,特别是在南美洲和亚洲[4-5]。胆管癌起病隐匿,恶性程度高,通常以体质量减轻、发烧,有时还可表现黄疸和疼痛为特征,并迅速恶化使患者出现恶病质[6]。与消化道其它恶性肿瘤相比,胆管癌缺乏相对理想的早期诊断标志物,只有10%~15%的胆管癌患者适合手术治疗[7-8]。大多数新发胆管癌病例诊断时已处于晚期,其治疗方案主要基于化疗[9]。但是,晚期胆管癌患者预后不良,总体中位生存时间一般不超过12个月[10]。因此,探索新的和胆管癌发生发展有关的基因,研发新型药物靶点对提高我国胆管癌治疗水平具有重要意义。
核仁纺锤体相关蛋白1(nucleolar spindle associated protein 1,Nusap1),一种新发现的微管结合蛋白,在细胞有丝分裂过程中起着不可缺少的作用,是一种重要的周期调控分子,保证着细胞周期的正常进行[11]。近年来有研究发现Nusap1在黑色素瘤[12]、肝癌[13]、胶质瘤[14]、脑膜瘤[15]、乳腺癌[16-17]等诸多肿瘤中存在过表达,且其表达水平与肿瘤细胞的增殖、迁移能力密切相关,但其在胆管癌中至今未见任何报道。本研究首先根据GEPIA数据库[18]分析Nusap1 mRNA在胆管癌组织及胆管正常组织中的表达情况;其次应用免疫组化技术检测胆管癌患者组织及癌旁组织中Nusap1蛋白的表达水平,并结合相关临床资料初步探讨该蛋白在胆管癌发生发展过程中的可能作用。
1 材料与方法
1.1 标本来源
收集2011年10月—2014年8月因胆管癌在南昌大学第一附属医院普外科行手术治疗的61例组织切片(包括癌组织及相对应的癌旁组织),患者术前均未行化疗或放疗等相关抗肿瘤治疗。所有标本均经病理证实为胆管癌,且所取癌旁组织也经病理证实为非肿瘤组织。本研究由医院伦理委员会批准,并根据美国AJCC癌症分期手册[19]进行肿瘤TNM分期。
1.2 免疫组化检测
Nusap1(A16000)抗体购于武汉ABclonal公司,工作液浓度为1:200。免疫组化试剂均购于北京中杉金桥公司。标本用4%多聚甲醛固定,石蜡包埋。然后用免疫组化检测肝癌组织中Nusap1的表达。切片常规脱蜡,复水,抗原修复,山羊血清封闭,1抗过夜,2抗孵育,DAB显色,复染,中性树胶封片,最后置于镜下观察。免疫组化染色结果判定[20]:阅片采用双盲法,Nusap1主要定位于细胞核,核内出现棕黄色代表阳性结果。染色强度:无色为0分;弱阳性为1分;中等阳性为2分;强阳性为3分。染色范围:0~10%为1分;10%~40%为2分;41%~100%为3分。最终所得分为染色强度与染色范围两者相乘,评分范围为0~9分,0~1分为Nusap1阴性组,2~9分为Nusap1阳性组。
1.3 临床随访
随访方式主要为电话随访及定期门诊复查,随访从手术日开始至2017年8月,或者以患者死亡为终止日期。
1.4 GEPIA 数据库分析
GEPIA数据库是由北京大学新研发出的网络服务器,用于分析来自TCGA和GTEx中样本的RNA测序表达数据;Nusap1 mRNA在胆管癌及正常胆管组织中的表达水平由GEPIA数据库进行分析。
1.5 统计学处理
采用χ2检验测定Nusap1的表达与临床病理参数间的关系;Kaplan-Meier生存分析评估Nusap1的表达与胆管癌患者总生存期的关系;P<0.05为差异有统计学意义;统计分析均由SPSS 17.0统计软件完成。
2 结 果
2.1 GEPIA 数据库分析胆管癌组织中Nusap1 mRNA 的表达情况
首先通过公共数据库GEPIA来明确胆管癌和正常胆管组织中Nusap1 mRNA的表达情况,采用箱式图进行比较分析。结果显示,在胆管癌组织中,Nusap1 mRNA的表达水平明显高于正常胆管组织(P<0.05)(图1)。
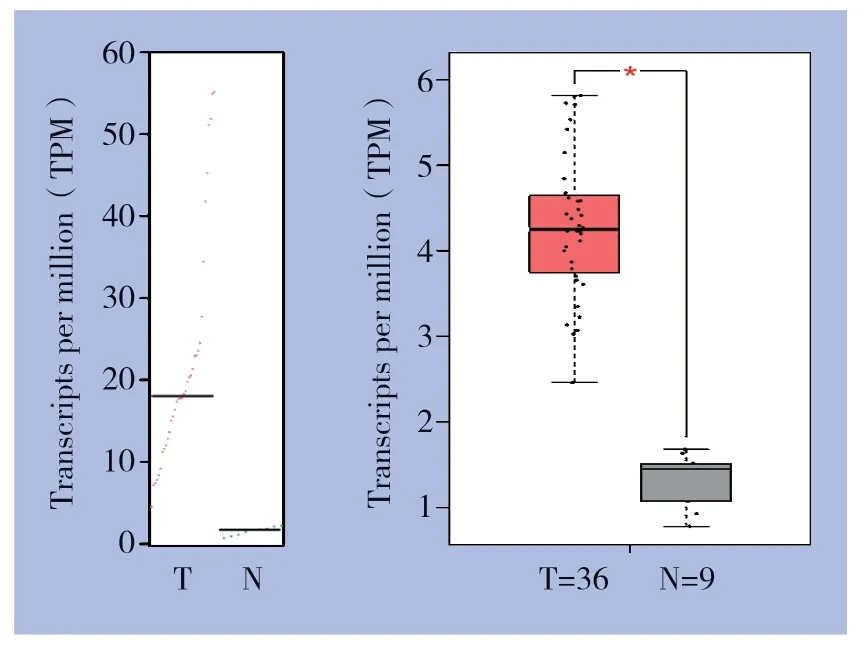
图1 GEPIA 数据库分析Nusap1 mRNA 在胆管癌及正常胆管组织中的表达Figure 1 Nusap1 mRNA expressions in cholangiocarcinoma and normal bile duct tissue based on GEPIA database analysis
2.2 胆管癌组织中Nusap1 蛋白的表达情况
免疫组化结果显示,胆管癌组织标本中,Nusap1阳性表达率为47.5%(29/61),且发现Nusap1蛋白主要定位于细胞核;而相对应的癌旁组织标本中Nusap1阳性表达率为14.8%(9/61)。胆管癌组织中Nusap1蛋白的表达水平明显高于配对癌旁组织(47.5%vs.14.8%,P<0.05)(图2)。

图2 免疫组化检测Nusap1 蛋白表达(×400) A:癌旁组织中Nusap1 蛋白的阴性表达;B:胆管癌组织中Nusap1 蛋白的阳性表达Figure 2 Immunohistochemical staining for Nusap1 expression (×400) A: Negative staining of Nusap1 in tumor adjacent tissue; B: Positive staining of Nusap1 in cholangiocarcinoma tissue
2.3 胆管癌组织中Nusap1 蛋白的表达与患者临床数据的关系
分析胆管癌组织中Nusap1蛋白的表达水平与患者临床数据的关系,结果显示,Nusap1的表达水平与患者临床TNM分期(P=0.001)、淋巴结转移(P=0.011)及术后生存状态(P=0.010)密切相关,而与患者年龄(P=0.2 0 2)、性别(P=0.124)、肿瘤大小(P=1.000)、CA19-9水平(P=0.306)、分化程度(P=0.800)无明显关系(表1)。
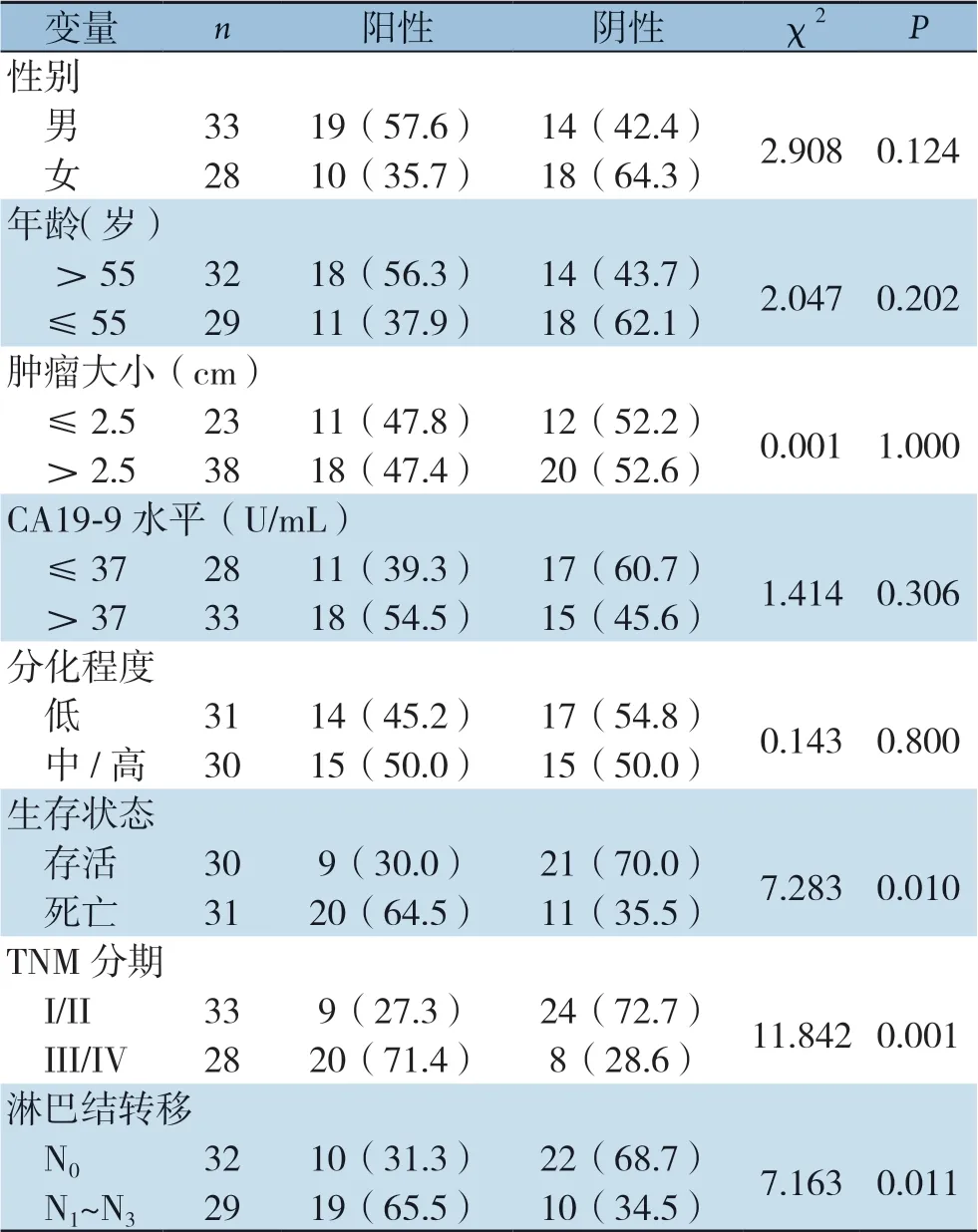
表1 胆管癌中Nusap1 的表达与临床病理参数的关系 [n(%)]Table 1 Relations of the Nusap1 expression with the clinicopathological characteristics of patients with cholangiocarcinoma [n(%)]
2.4 Nusap1 与患者预后的关系
Kaplan-Meier生存分析显示,Nusap1蛋白阳性组患者术后总生存时间较阴性组明显缩短(P=0.000)(图3)。其中Nusap1蛋白阳性组患者术后中位生存时间为23个月,阴性组患者术后中位生存时间为45个月。
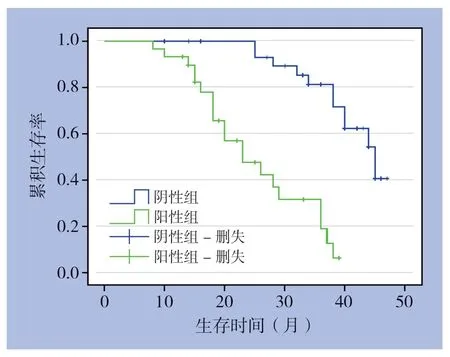
图3 Nusap1 表达与患者术后总生存时间的关系Figure 3 Relation of Nusap1 expression with postoperative overall survival time of the patients
3 讨 论
胆管癌的早期诊断及手术根治或许给患者提供了治愈的机会[21],但由于缺少有效的早期诊断方法,只有10%~15%的胆管癌患者适合手术治疗[7]。因此,探索新的和胆管癌发生发展有关的基因,研发新型药物靶点显得尤为重要。Nusap1 是一种新型微管结合蛋白,其分子量大约为55 kD。Nusap1的mRNA和蛋白水平在细胞周期G2/M期达到峰值,是一种重要的周期调控分子,主要参与纺锤体组装和染色体分离,在细胞有丝分裂过程中保证细胞周期的正常进行[22]。Nusap1表达升高使细胞核内微管聚集从而导致细胞周期停滞;相反,Nusap1的表达下降导致细胞形成异常的纺锤体,最终产生异常的胞质分裂[11],因此说明Nusap1在细胞有丝分裂过程中起着不可缺少的作用。
近年来的研究[23]发现,Nusap1 基因在多种癌细胞中存在过表达,且与肿瘤复发和侵袭密切相关。但是在正常体细胞中,如脑、肝、肾等,几乎没有发现Nusap1的表达。因此有学者[24]推测Nusap1可能参与癌症的形成,并可能成为一种高选择性的化疗靶点。在肝癌的研究中,张猛等[13]发现Nusap1 的表达水平明显高于癌旁组织,并与肝癌的侵袭性及早期复发密切相关。最近,Roy等[25]同样发现Nusap1在人肝癌组织和细胞系中表达上调,是miR-193a-5p的直接作用靶点,且肿瘤组织中Nusap1的水平升高与患者生存时间缩短密切相关;下调肝癌细胞株Huh7和Hep3B中Nusap1的表达后,其细胞增殖能力、克隆形成能力、迁移能力明显减弱,凋亡率上升,且引起细胞周期阻滞;在体外实验中同样证明抑制Nusap1的表达可以减缓肿瘤的生长。在浸润性乳腺癌中,Nusap1也呈高表达,下调Nusap1可以通过调控CDK1和DLGAP5的表达,抑制乳腺癌细胞的增殖、迁移和侵袭,增强对表柔比星的敏感性[16];在三阴性乳腺癌中,高水平的Nusap1与患者预后差相关[17]。在口腔鳞癌中,抑制Nusap1的表达,可以提高肿瘤对紫杉醇的化疗敏感性[26]。Gordon等[27-28]发现Nusap1在前列腺癌中表达上调,可作为早期前列腺癌的肿瘤标记物,并通过增强前列腺癌细胞的增殖和侵袭能力来促进前列腺癌的进展,且Nusap1的表达受到E2F1和RB1基因的调控。在脑肿瘤的相关研究中,Wu等[29]发现与正常星形细胞和脑组织相比,Nusap1在肿瘤组织和细胞系中表达上调,并通过激活Hedgehog信号通路增强肿瘤细胞侵袭性,促进星形细胞瘤的进展,可能是星形细胞瘤的潜在预后生物标志物和靶点。但是,Nusap1在胆管癌中仍未见任何相关报道。
本研究首先通过GEPIA数据库分析发现,胆管癌组织中Nusap1的mRNA表达水平明显高于正常胆管组织。然后首次通过免疫组化证明,胆管癌组织中Nusap1蛋白的表达水平显著高于对应癌旁组织。这与肝癌、乳腺癌等恶性肿瘤中的研究结果一致。同时统计分析提示,Nusap1 的表达水平与患者临床TNM分期、淋巴结转移及术后生存状态显著相关,而与患者年龄、性别、肿瘤大小、CA19-9水平、分化程度无明显关联。进一步Kaplan-Meier生存分析也显示Nusap1蛋白阳性组患者术后总生存期较阴性组显著缩短;其中Nusap1蛋白阳性组患者术后中位生存时间为23个月,阴性组患者术后中位生存时间为45个月,这些提示,Nusap1 与胆管癌患者的不良预后密切相关。但Nusap1蛋白在胆管癌细胞周期进程中的具体调控分子机制还有待进一步的研究。
综上,本研究发现,Nusap1在胆管癌组织中高表达,并与患者不良预后密切相关。Nusap1高表达患者,其术后生存时间显著缩短。本研究为更深入认识Nusap1在胆管癌中的生物学功能,寻找新的胆管癌治疗靶点提供了一定的思路。但关于Nusap1影响胆管癌发生发展的具体机制尚不明确,还需要大量的实验去研究探索。

