自噬介导的雷公藤甲素提高西妥昔单抗对SW480细胞治疗效果的实验研究
白利平,康向鹏,林 立,林伟箭,丁志杰
(厦门大学附属中山医院胃肠外科,厦门大学胃肠肿瘤研究所,福建 厦门 361004)
近年来,随着对肿瘤细胞信号转导通路研究的不断深入,以及高通量基因测序技术的进步,肿瘤药物的治疗越来越集中于针对肿瘤细胞受体、细胞周期、细胞信号转导、肿瘤血管等方向的分子靶向治疗。在结直肠癌,特别在转移性结直肠癌(metastatic colorectal cancer,mCRC)治疗方面,以表皮生长受体为靶点的西妥昔单抗(cetuximab,CET)取得了较好的临床疗效。然而,随着CET的临床应用,其耐药问题日益突出,特别是其影响的信号转导通路中K-Ras、B-Raf基因的突变,以及上皮间质转化(epithelial-mesenchymal transition,EMT)都成为导致其耐药的主要原因[1-2]。雷公藤甲素(triptolide,TP)又称雷公藤内酯醇,是雷公藤多苷的主要有效成分。早期研究表明,TP在抗炎和免疫抑制方面有较多应用。近年来在抗肿瘤方面的研究发现,TP能有效抑制肿瘤细胞的生长和转移[3]。多项研究表明,TP能诱导多种肿瘤发生自噬增强。自噬是细胞对衰老或凋亡细胞的自我消化以及维系细胞能量代谢的过程,对维持细胞内环境稳定及面临微环境压力时自我存活,均起关键作用[4]。
在肿瘤发生、发展过程中,自噬这一生理过程不仅可以表现为促癌,而且也可以表现为抑癌。近来研究表明[5-7],同样作为肿瘤发生、发展过程中重要的环节,自噬和EMT既有联系又有区别:一方面,发生EMT的细胞需要自噬激活,获取更多能量来维持其在转移扩散期间的存活;另一方面,在肿瘤发生初期,自噬通过选择性地破坏EMT过程的关键信号分子,从而抑制肿瘤的侵袭和转移。因此,本研究旨在探讨TP联合CET对人结肠癌细胞SW480生长和转移的影响,并分析其可能的作用机制,以期为结直肠癌的药物预防和治疗寻找新的方法。
1 材料与方法
1.1材料
1.1.1细胞株 人结肠癌SW480细胞系,购自中国医学科学院细胞库,由厦门大学附属中山医院中心实验室保存。DMEM高糖培养加入10%胎牛血清、100 U·L-1青霉素和100 U·L-1链霉素,放置37 ℃、5% CO2的细胞培养箱中培养, 细胞生长为单层细胞,待细胞贴壁80%~90%,以0.25%含有EDTA的胰酶消化并传代。
1.1.2药物与试剂 CET(5 g·L-1, 德国默克制药公司),用前以培养液稀释,使终浓度为100 mg·L-1;TP(Sigma公司),以二甲基亚砜(DMSO)为溶剂,稀释成100 mmol·L-1,-20 ℃保存,用前以培养液梯度稀释成终浓度。DMEM培养基(Gibco);胎牛血清(杭州四季青);p62、LC3、E-cadherin、Snail、β-actin抗体(Cell Signaling公司);Twist2、Vimentin抗体(Abcam公司); BCA试剂盒(Thermo公司)。
1.1.3仪器 CO2培养箱(Thermo Fisher公司);倒置显微镜(Olympus公司);多功能酶标仪、凝胶成像分析系统(Bio-Rad公司);紫外分光光度计(Eppendorf公司)。
1.2方法
1.2.1MTT检测细胞增殖 0.25%胰酶消化SW480细胞,计数,并按照每孔4 000个细胞接种于96孔板中,过夜贴壁培养后,加入不同浓度的TP(5、10、20、50 nmol·L-1)和CET(25、50、100、200 mg·L-1)处理SW480细胞,对照组加入PBS,培养24、48、72 h。培养终点, 每孔加20 μL MTT(5g·L-1),继续37 ℃培养4 h,吸弃培养基,每孔加入150 μL DMSO,室温振荡10 min,490 nm波长下测定各孔吸光度值。
1.2.2细胞划痕实验 细胞计数,按1×105细胞数目接种于6孔板,使用无血清培养基过夜培养后,用200 μL移液枪枪头在单层细胞上竖直划痕,用PBS清洗3次,然后按实验组和对照组加入TP单药和联合药物,分别培养24、48 h,显微镜下观察并拍照。使用Image J软件统计分析。迁移率/%=(边缘距离0 h-边缘距离24 h/48 h)/边缘距离0 h×100%。
1.2.3细胞克隆实验 细胞培养后,胰酶消化并计数,接种于6孔板中,过夜培养后,分为TP组、CET组和TP联合CET组,培养48 h后,再次消化细胞,按密度500个/孔接种于6孔板中,连续培养2周,确定集落形成后,将培养物3.7%多聚甲醛和70%乙醇固定,并用0.05%考马斯蓝染色。显微镜下计算细胞克隆数(>50个细胞的集落数)。克隆形成率/%=克隆数/接种细胞数×100%。
1.2.4Western blot实验 待细胞进入对数生长期,用0.25%含有EDTA胰酶消化,离心后细胞重悬,计数,接种于6 cm2培养皿,12 h贴壁后,加入不同浓度TP(10、20、50 nmol·L-1)处理SW480细胞,按实验设计,设置不同的终止时间点。提取蛋白前去处细胞培养液,预冷PBS清洗3次,冰上细胞刮快速刮下细胞,并转移至1.5 mL EP管,使用预冷的RIPA蛋白裂解液,加前注意按比例加入蛋白酶抑制剂,冰上裂解15~20 min,然后4 ℃、13 000 r·min-1离心20 min,将上清蛋白吸至新的1.5 mL EP管中。BCA试剂盒测定蛋白浓度,并计算所加蛋白量,加入上样缓冲液,98 ℃煮沸10 min,低温保存。SDS-PAGE电泳,分离蛋白,将蛋白转至PVDF膜上。5%脱脂奶粉孵育2 h封闭,加入稀释的一抗p62、LC3-Ⅱ、mTOR、Snail、Twist2抗体和β-actin抗体(内参),4 ℃孵育过夜;TBST洗膜3次,加入稀释的相应二抗,室温孵育1 h;TBST洗膜3次,采用Image-Pro Plus软件进行灰度值分析,以各目的条带与内参条带的平均灰度值的比值作为目的蛋白的相对表达水平。

2 结果
2.1TP及TP联合CET对SW480细胞增殖的抑制作用MTT法检测结果显示,TP和CET均可抑制SW480细胞的生长,与空白对照组比较,TP呈明显的剂量依赖性和时间依赖性,而且在5~20 nmol·L-1显示更好的剂量依赖,抑制率明显下降,20~50 nmol·L-1显示更好的时间依赖性;而CET仅显示剂量依赖性。由于TP(50 nmol·L-1)72 h抑制率近80%( Fig 1A),大量细胞死亡,而CET大于100 mg·L-1抑制效率下降(Fig 1B),因此,本研究选择TP(20 nmol·L-1)和CET(100 mg·L-1)为后续实验的浓度。进一步实验证明,与TP(20 nmol·L-1)和CET(100 mg·L-1)单药组相比, TP和CET联合处理组细胞的增殖率均明显下降(P<0.05,Fig 1C)。克隆形成实验结果显示,CET联合TP处理组的细胞集落数量和大小形态均小于CET单药处理组。两药联合组的克隆形成率明显下降(P<0.05),两药联合对于SW480细胞的克隆形成有明显交互抑制作用(Fig 1D)。
2.2TP诱导SW480细胞自噬Western blot检测结果表明, TP(0、10、20、50 nmol·L-1)作用SW480细胞24 h,随着TP浓度的增加,自噬标志蛋白LC3-Ⅱ表达水平也逐渐升高,而p62表达随TP浓度增加却逐渐下降,表现出明显的浓度依赖性(Fig 2A)。用20 nmol·L-1TP作用SW480细胞0、12、24、48 h发现,LC3-Ⅱ蛋白的相对表达水平随着作用时间的延长不断升高,p62表达则相反,均呈时间依赖性(Fig 2B)。数据显示经TP处理后,LC3-Ⅱ蛋白的表达升高, p62蛋白表达下降,表明TP诱导SW480细胞自噬加强。
2.3TP及TP联合CET对SW480细胞期迁移的影响划痕实验结果显示,与对照组比较,CET(100 mg·L-1)组细胞的迁移率无明显减小(P>0.05),而TP(20 nmol·L-1)组则明显减小(P<0.01);与单药组(CET)比较,TP(20 nmol·L-1)+CET(100 mg·L-1)联合治疗组细胞的体外迁移距离明显减小(P<0.01,Fig 3A、3B)。说明TP不仅能明显抑制结肠癌SW480细胞的体外迁移能力,而且与CET联合应用具有明显协同作用。进一步的Western blot检测结果显示,相对于CET单药组,上皮相关标志物E-cadherin在TP单药以及TP+CET联合处理组表达均上调,而间质相关标志物Vimentin表达相应下调(Fig 3C、3D)。提示TP通过上调E-cadherin和下调Vimentin的表达,逆转CET介导的EMT。

Fig 1 The effect of triptolide in combination with cetuximab on cell viability, clonogenicity in SW480 n=3)
The cell viability of human colorectal cancer SW480 cells treated with TP(0, 5, 10, 20, 50 nmol·L-1)(A) or CET(0, 25 50, 100, 200 mg·L-1) alone(B) for 24, 48, 72 h and TP(20 nmol·L-1) or CET(100 mg·L-1) alone or both together for 48 h(C) were detected by MTT assay; D: colony formation was performed with SW480(800 cells/well, 2 weeks).*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsCET
2.4TP通过mTOR信号通路诱导自噬,抑制SW480细胞的EMTFig 4的Western blot结果显示,TP(20 nmol·L-1)分别作用于SW480细胞0、12、24、48 h,不仅抑制了自噬相关蛋白p62的表达,同时明显抑制了mTOR的磷酸化,而总mTOR未发生明显改变,说明TP是通过mTOR通路诱导细胞自噬。进一步研究发现,EMT上游信号通路中Snail、Twist蛋白也随着TP处理的时间延长而表达下调,说明TP能通过mTOR信号通路诱导结肠癌SW480细胞发生自噬,而且由自噬介导通过Snail、Twist通路改变E-cadherin和Vimentin表达,抑制EMT。
3 讨论
TP具有解毒散结、活血化瘀、扶正祛邪等多种功效,近来研究表明,其对多种肿瘤具有良好的抗肿瘤活性。在本研究中,我们尝试用TP与血管靶向药物CET做平行对照研究,采用MTT法观察其对SW480细胞增殖的影响。结果显示,由低到高不同浓度TP(5~50 nmol·L-1)对SW480细胞体外增殖的抑制作用(0~72 h),显示出明显剂量和时间依赖性,48 h内IC50值在20 nmol·L-1,而CET也具有抑制细胞增殖的作用,但相对于TP抑制率不高,也无明显时间依赖性;进一步将两药联合作用发现,TP联合CET组抑制细胞增殖明显强于单药组,说明两药在抗肿瘤方面具有协同作用。在细胞克隆形成实验中,与对照组相比,两药联合组细胞克隆形成的数目明显低于单药组,差异具有统计学意义。

Fig 2 Triptolide could induce autophagy and affect the expression of autophagy-related
A: Triptolide could affect the expression of p62 and LC3 caused a dose-dependent following 24 h triptolide treatment; B: Triptolide could affect the expression of p62 and LC3-Ⅱ caused a time-dependent following triptolide(20 nmol·L-1) treatment.*P<0.05vscontrol
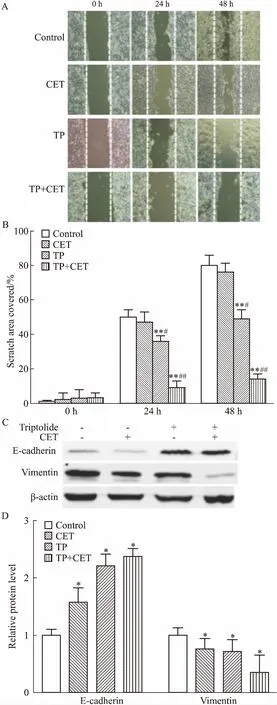
Fig 3 The effect of triptolide in combination with cetuximab on EMT and metastasis in
A: The effect of triptolide, cetuximab alone or both together on the migration in SW480 cell was detected by wound healing assay; B:Images obtained from above were analyzed the percentage of the wounded area covered by the cells from the different treatment groups; C: Expressions of E-cadiherin and Vimentin was detected by Western blot. SW480 cells were treated with 20 nmol·L-1TP, 100 mg·L-1CET.*P<0.05,**P<0.01vscontrol,#P<0.05,##P<0.01vsCET

Fig 4 The effect of triptolide on
*P<0.05,**P<0.01vscontrol
自噬具有双面性,对肿瘤来讲,有时有利于维持肿瘤存活,它可以回收营养物质和衰老的细胞器,使得能量得以重新回收和利用,但同时它也抑制肿瘤细胞的生长,激活凋亡信号通路,导致细胞发生自噬性细胞死亡(autophagic cell death,ACD)[8-9]。LC3和SQSTM1/p62是自噬中的标记蛋白质。本实验结果显示经TP处理后,无论是随作用时间延长,还是药物浓度增加,均表现为LC3-II/I比值升高,说明胞质型LC3(即LC3-Ⅰ)酶解后,转变为(自噬体)膜型(即LC3-Ⅱ),促进自噬小体的形成,自噬增强;同时检测到SQSTM1编码的泛素结合蛋白p62发生明显一致性下调,说明作为自噬的选择性底物,p62发生大量的聚集,最终进入到成熟的自噬体内,并在自噬体内降解,更进一步说明TP不仅抑制细胞活性及增殖,同时TP诱导上调LC3-Ⅱ蛋白的表达,下调p62蛋白的表达,从而诱导自噬性凋亡。赵林等[10]研究也发现,在TP联合自噬抑制剂3-MA处理HCT116细胞后,细胞凋亡率明显下降,而联合自噬诱导剂RAPA,细胞凋亡率明显上升,说明自噬的发生诱导细胞发生凋亡,也就说明引起了自噬性死亡,这种死亡是独立于caspase信号通路之外引起的细胞死亡。
EMT的发生关键标志是E-cadherin表达下降,EMT因子Twist1、Twist2、Snail、Slug、ZEB1和SIP1等都能与E-cadherin启动子的E-box结合,抑制E-cadherin的转录。CET等靶向药物主要可以抑制肿瘤组织的血管生成,进而使肿瘤组织缺氧,而在缺氧状态下,肿瘤细胞更容易发生EMT,从而迁移性和侵袭性增强。因此,EMT不仅是肿瘤耐药的重要机制,也成为靶向药物耐药的标志。逆转EMT或杀死EMT肿瘤细胞成为潜在的肿瘤治疗策略。划痕实验结果显示,与对照组相比,CET对细胞迁移能力没有明显影响,而TP不仅表现出抑制细胞发生迁移作用,而且联合CET组明显提高了单独CET组的抑制率,说明TP可能具有逆转CET的EMT作用。进一步免疫印迹实验结果显示,TP组可以上调E-cadherin蛋白表达,同时下调Vimentin蛋白,在分子水平上印证其具有抑制EMT作用。进一步实验结果显示,TP刺激细胞后,引起Twist、Snail的表达下调,因而证明,TP引起的E-cadherin过表达是由其上游Twist、Snail因子下调后,减少对E-cadherin的抑制作用,从而减少EMT的发生。虽然EMT需要潜在转移细胞以自噬的方式维持细胞的能量和代谢,但仍有证据表明,自噬的激活和增强可以逆转EMT细胞转移表型,从而抑制EMT的发生[11-12]。研究发现,在胶质瘤细胞中,通过应激或营养缺乏诱导细胞自噬增强,通过经典的mTOR途径抑制EMT,导致细胞迁移减少,侵袭力减弱[13]。本研究发现,TP作用于SW480细胞,通过mTOR通路诱导自噬,下调p62蛋白,同时相应下调Snail、Twist的表达,预示p62的下调可能与发生EMT的分子机制相关。Grassi等[14]发现,诱导自噬增强能降低p62,使得Snail发生高降解,表达水平下降,EMT的抑制增强;EMT相关蛋白Snail、Twist等的降解与p62参与的选择性自噬有关[15-16]。本实验印证了自噬标记蛋白p62与发生EMT关键分子呈正相关,至于TP是直接磷酸化Akt/mTOR通路,还是经过其上游分子或旁路分子的表达,从而进一步激活mTOR,以及p62与Snail、Twist是直接作用,还是间接作用,仍需要后续进一步验证。
综上所述,本研究发现TP抑制肿瘤细胞SW480的增殖,诱导其发生自噬性凋亡,并且可以抑制其EMT,同时联合CET具有明显协同的作用,证实了TP通过mTOR通路诱导肿瘤细胞自噬增强,在自噬与EMT的交叉对话中,发现p62可能作为调节两者通路一个关键因子。这些可以作为线索,为后续研究肿瘤细胞自噬和侵袭、转移的关系提供可能和依据。

