蛋白酶体抑制剂MG132对急性髓系白血病细胞增殖与凋亡的影响
郑晓辉,黄家福,徐淑娟,李 鑫,许雅苹,房纯正,翁乐斌,汪 洁,黄黎月
(1. 厦门医学院基础医学部生理学教研室,机能与临床转化福建省高校重点实验室,福建 厦门 361023;2. 福建医科大学附属协和医院血液科,福建 福州 350001;3. 厦门医学院基础医学部病理学教研室,福建 厦门 361023)
黏附调节分子1(adhesion regulating molecule 1, ADRM1)亦被称为 hRpnl3(human Rpn13)。ADRM1基因位于20号染色体长臂13区(20q13)上,包含9个外显子,可转录成两个转录本,编码同一种蛋白ADRM1。研究者在对多细胞真核生物内ADRM1的保守性分析中发现ADRM1高度保守,说明 ADRM1可能在生命过程中发挥重要功能[1-2]。研究显示,ADRM1蛋白是26S蛋白酶体亚单位19S调节颗粒上一个受体[3-4],决定26S蛋白酶体结构不对称性[5]。它分为3个功能性区域:N-端、C-端和插入片段。ADRM1通过N-端结合到19S调节颗粒的Rpn2和Rpn10亚基上,而通过C-端尾9个α螺旋与泛素羧端水解酶37(ubiquitin carboxy-terminal hydrolase 37, UCH37)上卷曲螺旋的C-端相互作用,募集UCH37到蛋白酶体上,并将其活化,形成 ADRM1/UCH37复合物,进入蛋白酶体泛素化路径,介导NF-κB、TGF-β I型受体、诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)等底物蛋白的降解[6-8]。
已有研究表明[9-12],ADRM1在结肠癌、肺癌、肾癌、膀胱癌、卵巢癌、肝癌、胃癌等多种恶性肿瘤中处于过表达状态,是驱动20ql3区基因高拷贝扩增的主要基因。本实验组前期研究发现,ADRM1基因在裸鼠体内不同致瘤率HL60细胞内存在表达差异(≥2倍),在急性白血病(acute leukemia, AL)细胞中表达上调[13]。因此,本实验首先通过了解ADRM1在实验室白血病细胞株中表达;其次,观察ADRM1干扰后HL60细胞增殖变化;最后,鉴于蛋白酶体抑制剂是临床多发性骨髓瘤(multiple yeloma, MM)常用药,效果明显;MG132(结构见Fig 1)也称Z-LLL-CHO、Z-Leu-Leu-Leu-CHO、Z-Leu-Leu-Leu-al或Carbobenzoxy-L-leucyl-L-leucyl-L-leucinal,是一种常用的蛋白酶体抑制剂,可抑制泛素蛋白酶体途径活性,上调caspase-3表达,诱导肝癌细胞HepG2凋亡[14],本实验拟通过观察HL60、NB4细胞在不同浓度MG132作用下增殖与凋亡,同时检测HL60细胞内ADRM1、UCH37蛋白表达,了解ADRM1在急性髓系白血病(acute myeloid leukemia,AML)中的作用。
1 材料与方法
1.1材料
1.1.1临床标本 AL患者初治骨髓标本(AL-untreated)、AL患者完全缓解骨髓标本(AL-complete remission, AL-CR)、脐带血标本来自2010年9月至2014年5月期间,福州协和医院门诊和住院收治患者。确诊根据FAB分型及张之南《血液病诊断及疗效标准》。以上样本经患者书面知情同意获得,并经中华医德委员会和福建医科大学联合医院信托基金批准使用。
Fig 1 Chemical structure of MG132
1.1.2细胞株 人急性早幼粒细胞白血病细胞NB4、人急性单核细胞白血病细胞THP1、人B淋巴细胞白血病细胞 Ball、人急性T淋巴细胞白血病细胞Jurkat、人急性淋巴母细胞性白血病细胞Molt-4、人慢性髓系白血病细胞K562、人多发性骨髓瘤细胞U266、人组织细胞淋巴瘤细胞U937,由福建省血液病重点实验室馈赠;人急性粒细胞白血病部分分化型细胞 HL60,购自上海富衡细胞公司;大肠杆菌E.coli DH5α、293T细胞为本实验室保存。
1.1.3试剂 人淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);TRIzol reagent(Invitrogen公司);逆转录试剂盒(Promega公司);Oligo Primers(上海生工);SYBR Green Master(ROX)(Roche公司);酶切酶、连接酶(NEB);质粒抽提试剂盒(碧云天);MG132(Sigma);CCK-8(Yeasen);Annexin V FLUOS Staining Kit(Roche);Western blot 抗体(CST公司);CD34+抗体(BD)。
1.1.4仪器 二氧化碳细胞培养箱2323-2(SHELLAB公司);倒置显微镜37XA(上海光学仪器厂);流式细胞分选仪FACS Aria(美国BD 公司);荧光倒置显微镜DMLB(德国徕卡公司);Gene Amp 2400 PCR 扩增仪、实时荧光定量PCR仪7500(美国应用生物系统公司);流式细胞仪EPICSXL(贝克曼库尔特公司);电泳仪PowerPac HC(Bio-Rad公司);快速Westrn blot仪器MA01821(Millipore)。
1.2方法
1.2.1qRT-PCR法检测CD34+AL细胞、造血干细胞(hematopoietic stem cells, HSCs)、AL-CR标本、血液肿瘤细胞株内ADRM1 mRNA表达 TRIzol抽提细胞内RNA,于1%琼脂糖电泳分离,EB染色,在紫外光透射仪中观察,拍照28 S RNA和18 S RNA ,确定其比值。当28 S/18 S约为2 ∶1时,说明RNA稳定并且无降解,逆转录试剂盒说明合成cDNA,用于实时定量PCR实验。利用DNAMAN软件设计引物,由上海英骏生物技术有限公司及上海生工公司合成,引物序列如下:ADRM1上游引物5′-AAGCGGAAAGGGCTGGTGTA-3′,下游引物5′-GCAATGCTCCTCATCCTGGT-3′,扩增片段长度240 bp;以β-actin为对照基因,其上游引物5′-AGTGTGACGTGGACATCCGCAA-3′,下游引物5′-ATCCACATCTGCTGGAAGGTGGAC-3′,扩增片段长度220 bp。
1.2.2构建ADRM1 shRNA与scrambled shRNA慢病毒感染HL60细胞 利用DNAMAN软件,与上海吉玛公司(Genepharma)共同设计并合成有效siRNA干扰序列3条及阴性对照序列1条,利用Lipofectamine 2000瞬时转染HL60细胞,qRT-PCR法筛选最有效干扰序列。上海吉凯公司合成靶序列(ADRM1-shRNA)及阴性对照序列(scrambled shRNA)相应各1对单链DNA,退火合成双链 shDNA,经酶切连接到带GFP筛选标记的慢病毒干扰载体GV115上,之后通过CaCl2沉淀法转导到感受态DH5α内,进行质粒扩增,之后质粒抽提试剂盒抽提质粒,经双酶切鉴定后,送上海英骏生物技术有限公司测序,得到ADRM1 shRNA与scrambled shRNA慢病毒干扰载体。由上海吉凯基因化学技术有限公司包装成ADRM1 shRNA与scrambled shRNA慢病毒,并进行病毒滴度浓缩。慢病毒感染HL60细胞,流式细胞分选仪分选GFP阳性HL60细胞,多次流式筛选,得到稳定ADRM1 shRNA与scrambled shRNA HL60细胞株。
1.2.3细胞增殖/毒性实验 在96孔板中接种100 μL 细胞悬液(细胞增殖实验5×107·L-1;细胞毒性实验1×108·L-1),于37 ℃、5% CO2培养箱预培养24 h;向培养板加入10 μL不同浓度的MG132,孵育24、48、72 h后,向每孔加入10 μL CCK-8 溶液,在培养箱内孵育3 h;用酶标仪测定在450/630 nm处的吸光度。
1.2.4Annexin V FLUOS Staining Kit流式细胞术检测细胞凋亡 用 Annexin V FLUOS Staining Kit检测细胞凋亡率。收集细胞于5 mL PBS中,800 r·min-1离心5 min, 弃上清,预冷的PBS洗2次,之后按说明书操作。
1.2.5Western blot检测细胞内蛋白表达 收集各组细胞,PBS洗2次,加入RIPA细胞裂解液(含1 mmol·L-1PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验。10% SDS-PAGE电泳后,行转膜印迹,分别用β-actin、ADRM1、UCH37一抗体与膜上的抗原结合,然后用HRP偶联的二抗与其反应,用ECL化学发光试剂检测,经压片曝光后,显影和定影。比较各组蛋白表达情况。

2 结果
2.1ADRM1mRNA在血液肿瘤细胞株的表达以急性白血病完全缓解患者骨髓标本(AL-CR)、脐带血干细胞标本(HSCs)为对照,结果如Fig 2所示:急性白血病初治患者骨髓标本(AL-untreated)、急性白血病初治患者骨髓 CD34+细胞标本(CD34+AL cells)、急性髓系白血病细胞株(NB4、THP1、HL60)、急性淋系白血病细胞株(Ball、Molt-4、Jurkat)、慢性髓系白血病细胞(K562)、组织细胞淋巴瘤细胞 U937与多发性骨髓瘤细胞(U266)内,ADRM1 mRNA表达明显上调;实验室细胞株内ADRM1表达普遍高于急性白血病初治患者骨髓标本内 ADRM1 表达。
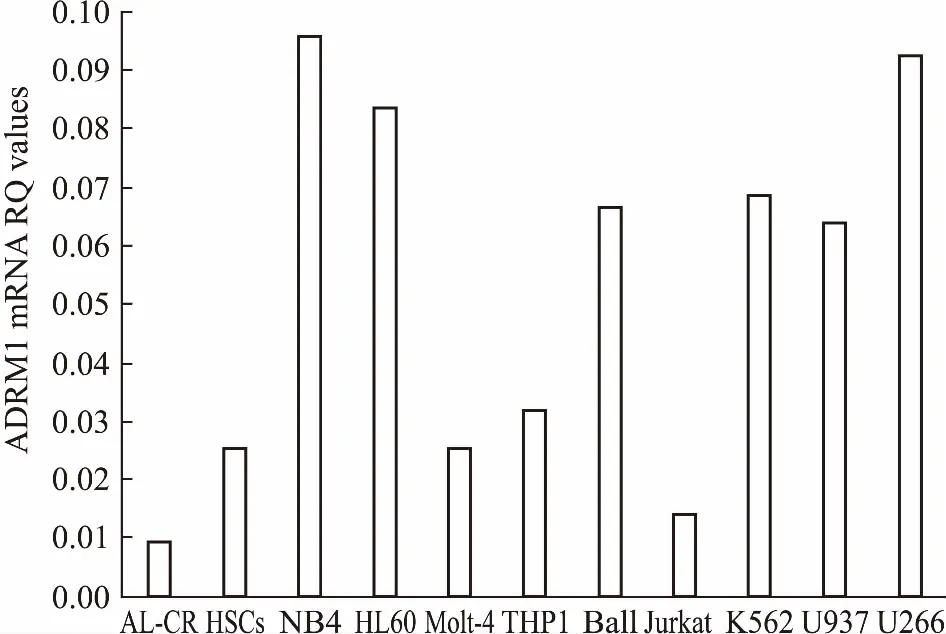
Fig 2 Comparison of expression of ADRM1 mRNA in blood tumor cell lines
RQ=2-ΔΔCT
2.2qRT-PCR筛选有效靶序列qRT-PCR法检测siRNA瞬转后,HL60细胞内ADRM1 mRNA表达水平,以分析不同靶序列siRNA的干扰有效性。HL60细胞RNAi 48 h后,β-actin与ADRM1基因的qRT-PCR结果见Tab 1。353靶点siRNA沉默有效率约0.67(有效率=1-2-ΔΔCT),1044靶点siRNA则为0.49,所以选择353靶点siRNA设计shRNA。
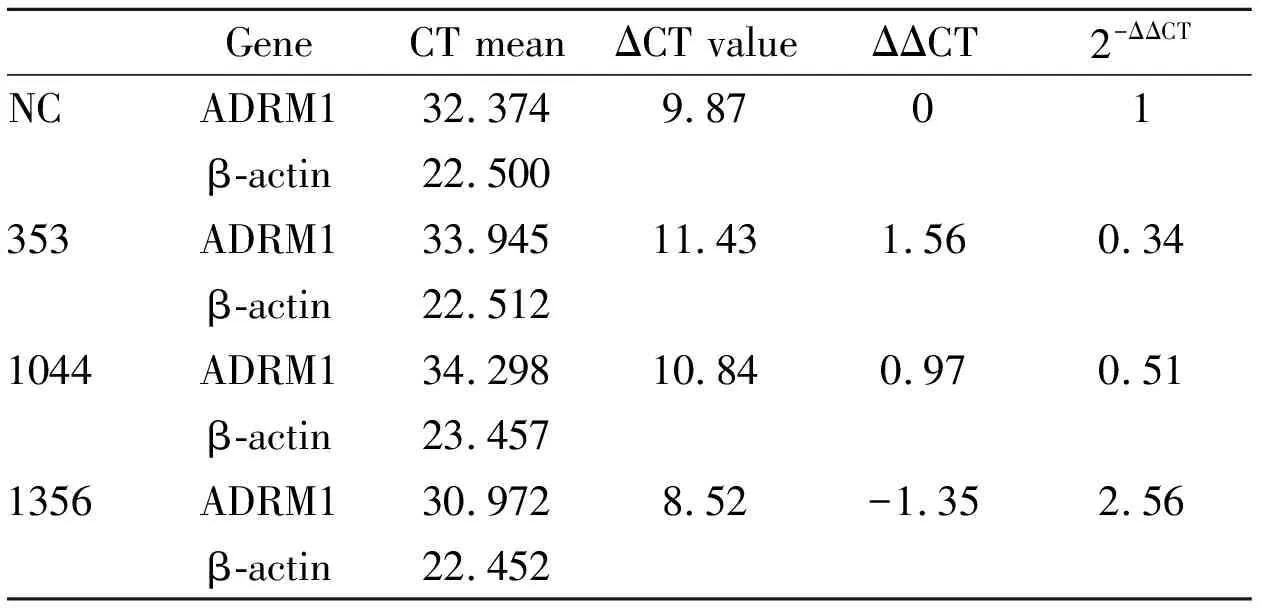
Tab 1 Expression of ADRM1 mRNA in HL60 after transient transfection of siRNA 48 h(2-ΔΔCT)
2.3成功构建慢病毒干扰载体LV-ADRM1-shRNA载体:TGTTAGAGAGATAATTGGAATTAATTTGACGTAAACACAAAGATATTAGTACAAAATACGTG ACGTAGAAAGTAATAATTTCTTGGGTAGTTTGCAGT TTTAAAATTATGTTTTAAATGGACTATCATATGCTTA CCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATA TATCTTGTGGAAAGGACGAAACACCGGGGGTCTAC GTGCTGAAGTTCACTCGAGTGAACTTCAGCACGTAG ACCCTTTTTGAATTCGGATCCATTAGGCGGCCGCGT GGATAACCGTATTACCGCCAGGCATTAGTTATTAAT AGTAATCAATTAGGGGGTCATTAGTTCATAGCCCAT ATATGGAGTTCCGCGTTACATAACTAACGGAAAATG GCCCGCCTGGCTGATCGCCCAACGACCCCCGCTCAT TGACGTCAATAATGACGTATGTTCCCATAGGAACGC CAATAGGCCCTTTCCATTGGGGTCAATGGGTGGAGT ATTTACGGGTAAACTGCC;LV-scrambled-shRNA载体:GGCTTAATGTGCGATAAAAGACAGATAATCTG TT CTTTTTAATACTAGCTACATTTTACATGATAGGC TTGGATTTCTATAACTTCGTATAGCATACATTATACG AAGTTATAAACAGCACAAAAGGAAACTCACCCTAA CTGTAAAGTAATTGTGTGTTTTGAGACTATAAATAT CCCTTGGAGAAAAGCCTTGTTTTTCTCCGAACGTGT CACGTTTCAAGAGAACGTGACACGTTCGGAGAATTT TTTCTCGAGTACTAGGATCCACGCGAATTAATTCTG TGGAATGTGTGTCAGTTAGGGTGTGGAAAGTCCCCA GGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGCA TCTCAATTAGTCAGCAACCAGGTGTGGAAAGTCCCC AGGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGC ATCTCAATTAGTCAGCAACCATAGTCCCGCCCCTAA CTCCGCCCATCCCGCCCCTAACTCCGCCCAGTTCCGC CCATTCTCCGCCCCATGGCTGACTAA。
2.4成功构建ADRM1shRNA与scrambledshRNAHL60细胞由上海吉凯公司包装慢病毒及滴度测定。慢病毒感染HL60细胞,MOI值为病毒滴度/接种细胞数。慢病毒感染有效率受MOI值、细胞状态、细胞接种密度、营养状态、培养条件、有无助转剂及其浓度的影响。我们在优化HL60细胞感染条件后,采用不同 MOI值,GFP表达效率也不同,两者之间不呈正比(Tab 2);普遍认为GFP表达效率与慢病毒感染有效率呈正相关。
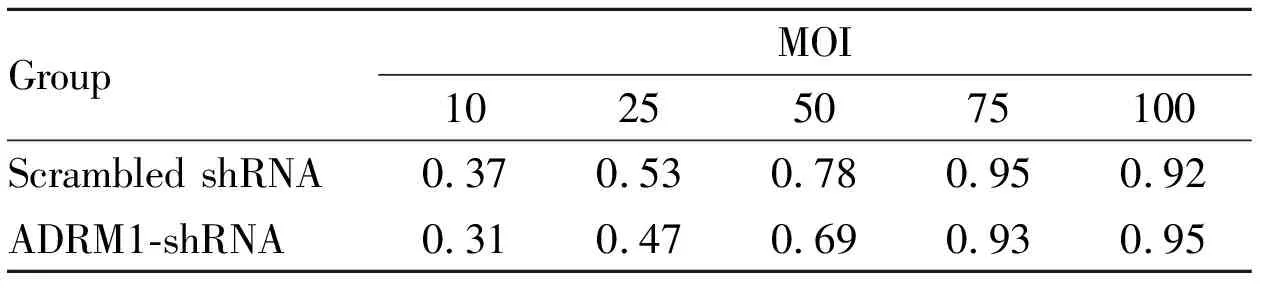
Tab 2 Effective rate of lentivirus infection in different MOI values
慢病毒对细胞也有一定的毒性作用,所以我们以MOI小于75的病毒量感染HL60细胞(Fig 3),再采用流式细胞分选仪分选出GFP阳性细胞,即为慢病毒成功感染的HL60细胞。分选时分析观察10 000个细胞,首先以侧向光散射(side scatter,SSC)和前向光散射(forward scatter,FSC)设门。去除死细胞,圈选大小比较均一的活细胞群设门为P1;P1门内细胞以SSC和GFP再设门。以野生株HL60细胞(parental)为对照,其P1内细胞为GFP阴性,不分群,设门为P2(Fig 4B)。慢病毒感染的HL60细胞,P1内细胞分两群(Fig 4D),P2门外右为GFP阳性细胞,圈选该GFP阳性细胞群并设门为P3。P3内细胞即为慢病毒成功感染的HL60细胞。我们收集该P3细胞群。
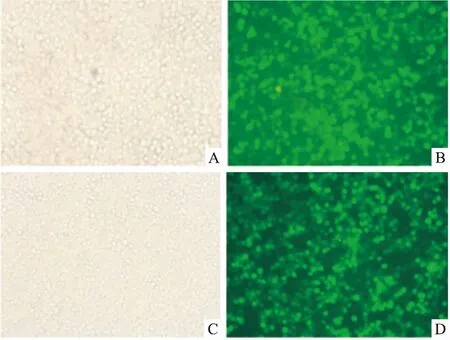
Fig 3 Detection of lentivirus infection in HL60 cells(MOI=75,×100)
The photo on the left side is under the ordinary light microscope, while the right side under the fluorescence microscope. A, B: Scrambled shRNA;C,D:ADRM1 shRNA.
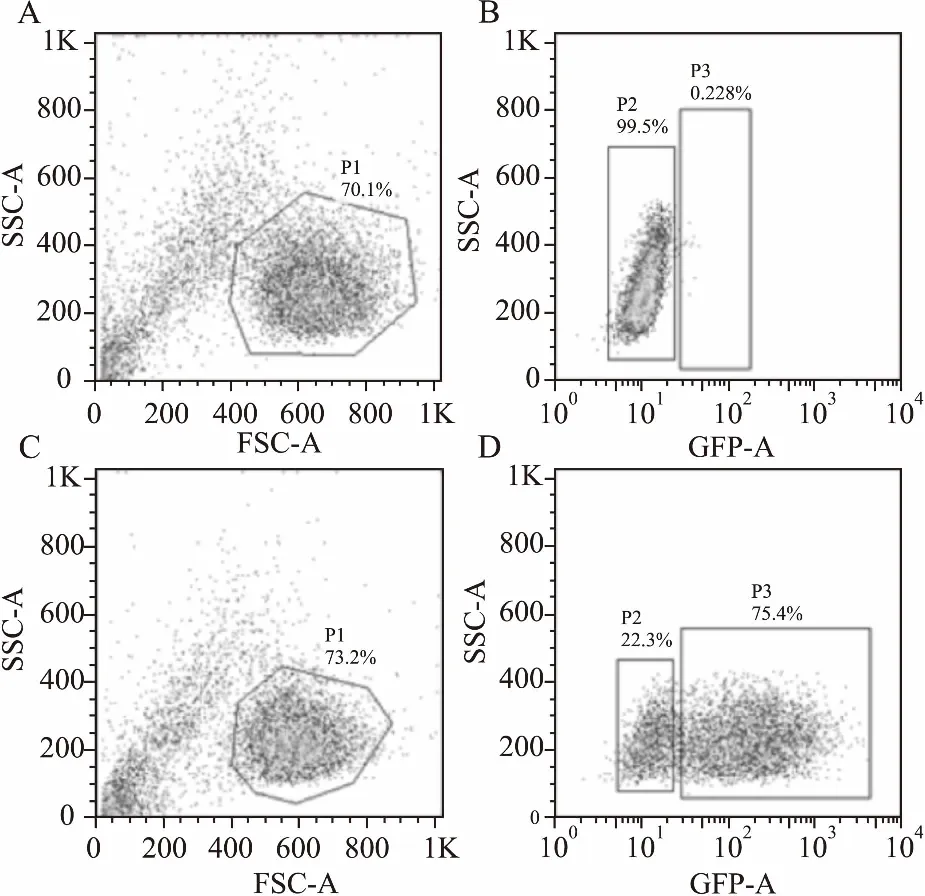
Fig 4 Sorting of GFP positive HL60 cells
A,B:Parental HL60 cells;C,D:HL60 cells infected with lentivirus carrying GFP fluorescence
2.5ADRM1shRNA、scrambledshRNA、parentalHL60细胞内ADRM1蛋白的表达Fig 5的Western blot结果显示,ADRM1 shRNA组细胞内ADRM1蛋白表达明显下调;scrambled shRNA和parental HL60细胞内ADRM1蛋白表达未见明显差异。提示成功构建ADRM1干扰HL60细胞及其阴性对照株。
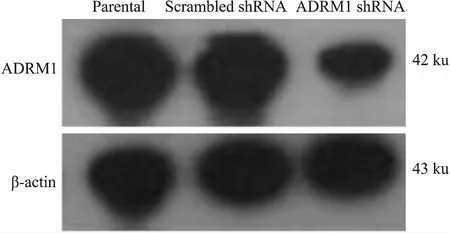
Fig 5 Expression of ADRM1 protein in ADRM1 shRNA, scrambled shRNA and parental HL60 cells
2.6ADRM1干扰前后HL60细胞增殖情况CCK-8法检测parental、scrambled shRNA和 ADRM1 shRNA各组细胞增殖情况。如Fig 6所示,ADRM1 shRNA组细胞增殖缓慢,说明下调ADRM1抑制HL60细胞增殖。
2.7MG132对HL60细胞活力的影响CCK-8法检测蛋白酶体抑制剂 MG132(0、0.1、0.25、0.5、0.8、1、1.5 μmol·L-1)作用24 h,对 parental、scrambled shRNA和ADRM1 shRNA HL60细胞的影响。如Fig 7所示,MG132抑制parental、scrambled shRNA和ADRM1 shRNA HL60 细胞活力,随着MG132浓度提高各组细胞死亡增加;各组细胞在OD 450/630值相近(即0.15左右),所需的MG132浓度分别为0.5 μmol·L-1(parental组)、0.8 μmol·L-1(scrambled shRNA组)和1.5 μmol·L-1(ADRM1 shRNA组),说明ADRM1下调前HL60细胞对MG132敏感性较高,反映MG132对HL60细胞的毒性作用与HL60细胞内ADRM1蛋白水平相关。
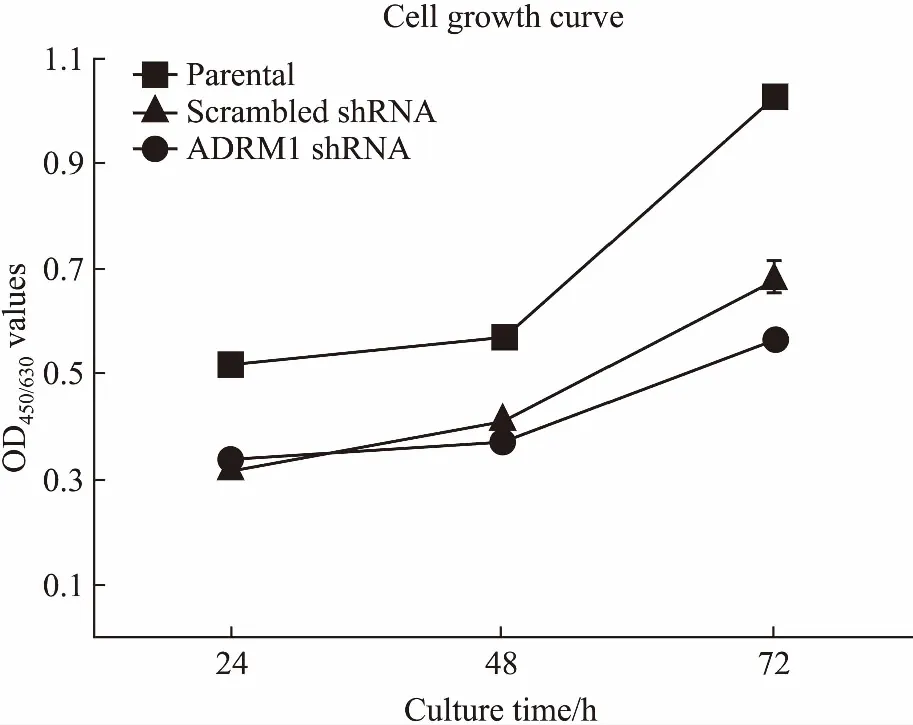
Fig 6 Cell growth of parental, scrambled shRNA
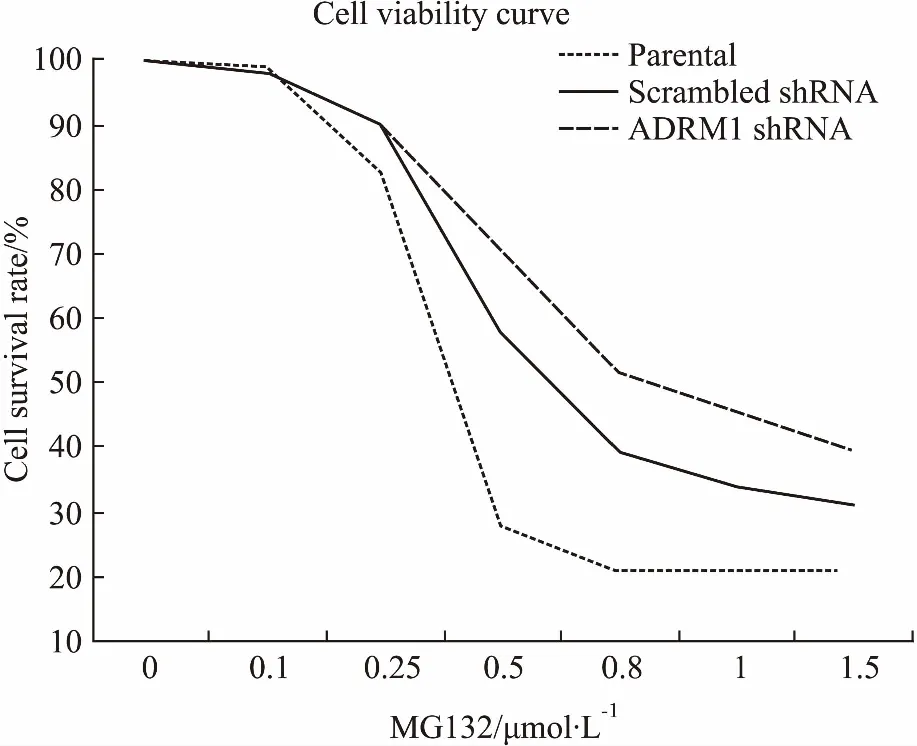
Fig 7 Cell viability of parental, scrambled shRNA and ADRM1 shRNA groups treated with different MG132 concentrations for 24 h
2.8MG132对HL60细胞内ADRM1、UCH37蛋白表达的影响为探讨蛋白酶体抑制剂 MG132抑制细胞增殖、降低其活力的作用与ADRM1的相关性,利用Western blot检测 0.25、0.4 μmol·L-1MG132作用24 h后,parental、scrambled shRNA和ADRM1 shRNA组细胞内ADRM1、UCH37蛋白表达变化。如Fig 8所示,0.4 μmol·L-1MG132作用24 h后,parental 和scrambled shRNA组细胞内ADRM1、UCH37蛋白表达减少;ADRM1 shRNA组ADRM1 蛋白表达提高,UCH37蛋白下调。0.25 μmol·L-1MG132作用下的parental HL60细胞UCH37 蛋白表达提高。0.4 μmol·L-1MG132作用后,ADRM1 shRNA组细胞ADRM1蛋白表达提高,0.25 μmol·L-1MG132作用下,parental组细胞UCH37蛋白表达提高,可能是各组细胞对低浓度MG132应激性反应,具体机制有待进一步研究。
2.9MG132促进HL60、NB4细胞凋亡细胞以1×105·L-1接种6孔板2 mL,设不同浓度 MG132实验组,各组2个复孔,24 h后流式细胞术检测各组细胞凋亡,独立重复实验2次。图左上(upper left, UL)为死亡细胞,右上(upper right, UR)为晚期凋亡细胞,左下(lower left, LL)为活细胞,右下(lower right, LR)为早期凋亡细胞。如Fig 9、10所示,随着MG132 浓度提高,细胞早期与晚期凋亡均增加。以MG132浓度为0.4 mol·L-1时HL60凋亡率为参照,当MG132浓度为0.8 μmol·L-1时HL60细胞早期凋亡变化较小,晚期凋亡大量增加;而MG132浓度为2 μmol·L-1时NB4细胞凋亡率,处于HL60细胞MG132浓度为0.25 μmol·L-1与0.4 μmol·L-1之间。以上结果说明NB4细胞对MG132敏感性小于HL60细胞,提示不同白血病亚型细胞株对 MG132药物反应存在个体差异。
3 讨论
ADRM1 mRNA在9株实验室血液肿瘤细胞中过表达,这与前述研究ADRM1在多种肿瘤中过表达情况一致,说明ADRM1可能参与血液肿瘤,特别是AL的发生发展。
ADRM1干扰前后HL60细胞在0.5 μmol·L-1MG132作用下,parental组活力下调72%,scrambled shRNA组下调42%,而ADRM1 shRNA组下调30%,提示ADRM1表达高的肿瘤细胞对MG132敏感,受抑制明显;随着 MG132浓度提高,HL60细胞增殖缓慢、活力下降,此时各实验组细胞内ADRM1、UCH37蛋白表达减少,说明MG132下调ADRM1、UCH37蛋白表达,抑制HL60细胞增殖与活力;HL60、NB4细胞随MG132浓度提高凋亡亦明显增加。以上研究为临床治疗AML采用抑制ADRM1表达手段提供了理论基础。
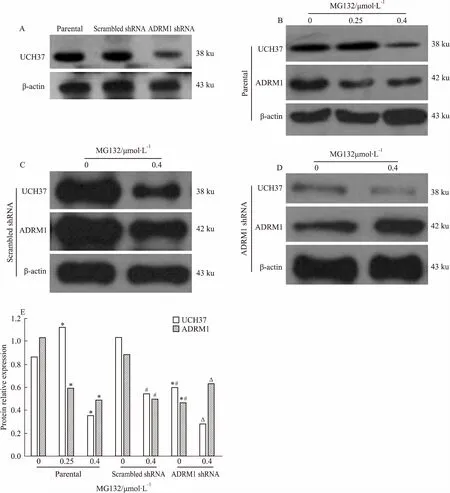
*P<0.05vsparental 0 group;#P<0.05vsscrambled shRNA 0 group;ΔP<0.05vsADRM1 shRNA 0 group
特定基因的mRNA丰度不一定与其翻译产物——蛋白质的表达量成线性关系,因为基因表达成蛋白的调控层次包括转录水平的调控、转录后调控、翻译水平调控及翻译后调控。此外,mRNA的降解、蛋白的降解、修饰折叠等因素都可能导致mRNA丰度与蛋白表达水平不一致。因此,可以出现ADRM1 mRNA水平较HL60高的NB4细胞凋亡所需MG132浓度较高的现象。
恶性肿瘤细胞具有自主生长、过度增殖、对抑制生长的调控信号不敏感、逃避细胞内在的凋亡信号、促血管生成、侵袭性生长及转移的能力。恶性肿瘤的发生往往是单克隆肿瘤细胞增殖失控、凋亡受阻的结果。已有研究表明,ADRM1通过募集UCH37形成ADRM1/UCH37复合物,介导NF-κB的降解,并影响其活性,参与细胞周期和凋亡过程。这提示ADRM1在肿瘤中作用的发挥可能与UCH37及NF-κB信号通路有关。UCH37可通过影响Bax/Bcl-2比率和caspase-9、 caspase-3酶活性而抑制细胞凋亡。NF-κB与恶性肿瘤发生发展过程有着极为紧密的关系,对绝大多数恶性肿瘤具有促癌作用。静息状态的细胞,NF-κB位于胞质中,与IκB形成复合物。当该复合物被激活时,NF-κB暴露核定位位点,进入核内与特异性κB序列结合,启动下游靶基因转录和表达。NF-κB主要调节炎症和自身免疫反应,也可调控细胞周期及凋亡,影响细胞分化,可控制细胞增殖及癌变。研究表明,NF-κB转录因子可通过与Cydin D1的启动子κB 位点结合而启动该基因的转录,也可通过其他途径间接上调Cyclin D1的表达。亦有研究显示,NF-κB可通过激活Cyclin D2、Cyclin D3、Cyclin E和c-myc的转录和表达,促进淋巴瘤细胞的细胞周期转化和增殖。NF-κB通路的异常激活,可导致一系列细胞肿瘤相关基因的异常表达,从而抑制肿瘤细胞凋亡、促进其增殖。因此,ADRM1可能通过UCH37改变Bax/Bcl-2比率和caspase-9、caspase-3酶活性,抑制HL60细胞凋亡;也可能通过ADRM1/UCH37复合物影响NF-κB的降解或活性,促进细胞周期调控蛋白的表达,使细胞周期加速通过G0/G1期,促进细胞增殖,从而在白血病的发生发展中发挥作用。因此,本研究为临床治疗AML采用下调ADRM1表达策略提供了依据[4-6,8,14-15]。
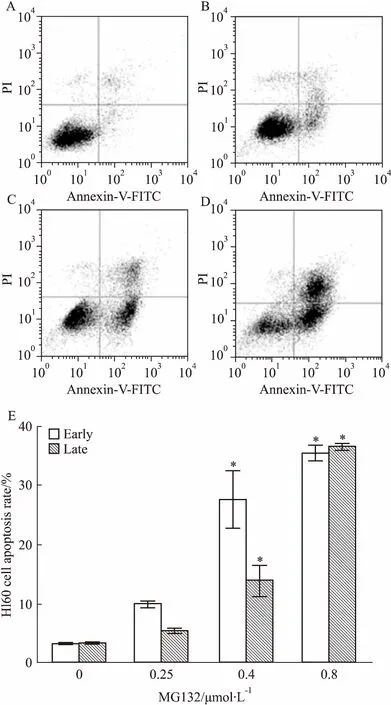
Fig 9 Apoptosis of HL60 cells treated with different concentrations of MG132 for 24
A,B, C, D: Apoptosis of HL60 cells exposure to 0, 0.25, 0.4 and 0.8 μmol·L-1MG132 for 24 h; E:Early and late apoptotic rate of HL60 cells.*P<0.05vs0 group
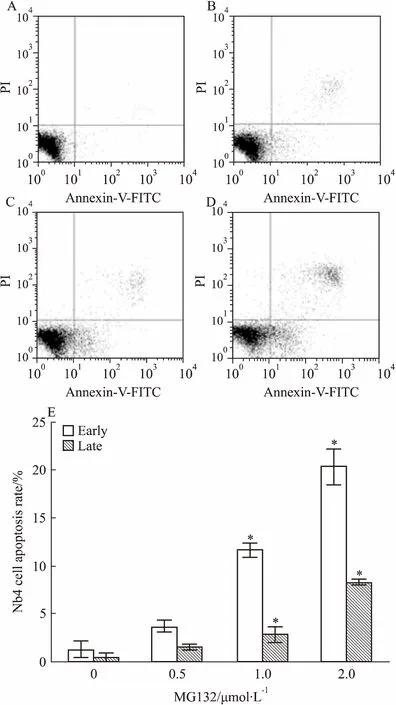
Fig 10 Apoptosis of NB4 cells treated with different concentrations of MG132 for 24
A, B, C, D: Apoptosis of NB4 cells exposed to 0, 0.5, 1 and 2 μmol·L-1MG132 for 24 h; E:Early and late apoptotic rate of NB4 cells.*P<0.05vs0 group

