ABT-737增强Mcl-1小分子抑制剂UMI-77诱导的胃癌细胞凋亡
吴 萍,李佳佳,裴新茹,陈 坤,胡汪来
(安徽医科大学基础医学院免疫学教研室,安徽 合肥 230032)
Bcl-2家族蛋白是线粒体凋亡途径重要的调控者,其中抗凋亡蛋白包括B细胞淋巴瘤-2(B-cell lymphoma,Bcl-2)、B细胞淋巴瘤超大蛋白(B-cell lymphoma extra large,Bcl-xL)、髓样细胞白血病-1(myeloid cell leukemia-1,Mcl-1)、Bcl-w和A1。近年来的研究发现,抗凋亡蛋白高表达是肿瘤细胞生存及耐药的重要机制之一,因此,抑制抗凋亡蛋白能达到杀伤肿瘤细胞的目的。“BH3-only”蛋白是天然的抗凋亡蛋白的抑制剂,但很难通过现有技术直接得到,因此,人们用模拟“BH3-only”蛋白的小分子化合物来抑制抗凋亡蛋白,由此诞生了BH3类似物(BH3 mimetics)的概念。自2005年以来,BH3类似物成为肿瘤研究领域的新热点,大量的小分子化合物不断涌现,如抑制Bcl-2/Bcl-xL的ABT-737及其口服衍生物ABT-263、抑制Bcl-2的ABT-199等。对于那些依赖Bcl-2和/或Bcl-xL存活的肿瘤细胞而言,这些BH3类似物的效果很好,但一些肿瘤细胞由于高表达Mcl-1而对它们抵抗[1],因此,研发出能选择性抑制Mcl-1的BH3类似物很有必要。UMI-77是2014年通过高通量筛选方法鉴定出来的Mcl-1小分子抑制剂,在胰腺癌的体内和体外实验中都有很好的效果[2]。本研究将UMI-77应用到胃癌细胞,在对UMI-77抵抗的胃癌细胞中,将UMI-77和Bcl-2/Bcl-xL的抑制剂ABT-737联用,观察联用后的细胞凋亡情况,并探讨其分子机制。
1 材料与方法
1.1材料
1.1.1试剂 RPMI 1640培养基,购自Gibco公司;胎牛血清,购自Hyclone公司;UMI-77、ABT-737,购自Selleck公司;MTS购自Promega公司;FITC Annexin V 凋亡检测试剂盒,购自BD Pharmingen公司;MitoProbe JC-1试剂盒,购自Invitrogen公司;BCA蛋白定量试剂盒、RIPA裂解液,购自碧云天生物技术有限公司;抗pro-caspase-3、多聚腺苷二磷酸核糖聚合酶-1(poly [ADP-ribose] polymerase-1,PARP-1)、Survivin、Bcl-2和Mcl-1单克隆抗体,购自Santa Cruz公司;抗cleaved-caspase-3、caspase-9、X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、细胞凋亡抑制蛋白1(cellular inhibitor of apoptosis protein 1,cIAP1)、cIAP2、Bcl-xL、Bim、p53上调凋亡调节因子(p53 upregulated modulator of apoptosis,PUMA)单克隆抗体,购自Cell Signaling公司;抗NOXA单克隆抗体,购自Abcam公司;抗GAPDH单克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG及山羊抗兔IgG,购自北京中杉金桥生物技术有限公司。
1.1.2仪器 全自动酶标仪(Bio Tek公司);流式细胞仪(BD公司);Mini-PROTEAN Tetra电泳仪(Bio-Rad公司);全自动化学发光图像分析系统(Tanon公司);倒置相差显微镜(Olympus公司)。
1.2方法
1.2.1细胞培养 人胃癌细胞MGC-803、HGC-27,购自中国科学院上海细胞库。细胞用含体积分数为0.10胎牛血清的RPMI 1640培养基,37 ℃、5% CO2饱和湿度的培养箱中培养。
1.2.2MTS法检测细胞存活率 取对数生长期的细胞,以适当密度接种于96孔板(每孔100 μL),次日细胞汇合度达70%,加入不同浓度的UMI-77、ABT-737或同时加入UMI-77和ABT-737,对照组加入含有与药物组同等含量的DMSO,调零孔仅加等体积的培养液、无细胞,每组设6个复孔。处理48 h或24 h后,每孔加10 μL MTS,37 ℃避光孵育1~4 h,在酶标仪上检测主波长为490 nm、参考波长为630 nm处的吸光度(OD)值,计算细胞存活率:细胞存活率/%=(实验组OD值-调零孔OD值)/(对照组OD值-调零孔OD值)×100%。
1.2.3Annexin V-FITC/PI染色流式细胞术检测细胞凋亡 取对数生长期的HGC-27细胞,以适当密度接种于24孔板,次日细胞汇合度达70%,分别加UMI-77(10 μmol·L-1)、ABT-737(10 μmol·L-1)、UMI-77(10 μmol·L-1)+ABT-737(10 μmol·L-1)处理,对照组(Control)加入含有与处理组同等含量的DMSO,每组设3个复孔。24 h后,分别收集孔中的上清至流式管中,贴壁的细胞用不含EDTA的胰酶消化下来,也收集到对应的流式管中。用冷PBS洗2次,每管细胞沉淀中加100 μL 1×binding buffer,充分吹打混匀。每管加5 μL Annexin V-FITC和5 μL PI,室温避光染色15 min,最后每管加400 μL 1×binding buffer,立即上流式细胞仪检测细胞凋亡,FlowJo 7.6软件分析结果,以Annexin V(+)细胞所占比例定为细胞凋亡率。
1.2.4JC-1染色流式细胞术检测线粒体膜电位(Δψm)的变化 种板、处理及收集步骤同“1.2.3”,每管细胞沉淀中加1 mL温PBS重悬,阳性对照管加1 μL 50 mmol·L-1的碳酰氰基-对-氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone,CCCP)(终浓度为50 μmol·L-1),37 ℃避光处理5 min。然后每管加2.5 μL 200 μmol·L-1的JC-1(终浓度为0.5 μmol·L-1),37 ℃避光染色30 min。每管加2 mL 温PBS洗1次,最后每管加500 μL温PBS重悬,立即上流式细胞仪检测ΔΨm的变化情况。FlowJo 7.6软件分析结果,当ΔΨm较高时,JC-1聚集在线粒体基质中,形成聚合物,产生红色荧光。当ΔΨm较低时,JC-1为单体,产生绿色荧光。
1.2.5Western blot检测凋亡相关蛋白的表达 收集对照组(Control)、UMI-77(10 μmol·L-1)、ABT-737(10 μmol·L-1)、UMI-77(10 μmol·L-1)+ABT-737(10 μmol·L-1)处理24 h的细胞,加入RIPA裂解液,冰上裂解30 min,4 ℃、14 000×g离心30 min后,取上清,即细胞总蛋白。采用BCA法蛋白定量,取20 μg总蛋白进行SDS-PAGE,随后转移至硝酸纤维素膜上,用含50 g·L-1脱脂奶粉的封闭液室温封闭1 h,一抗4 ℃孵育过夜;次日用TBST洗3次,每次10 min,二抗室温孵育1 h,TBST洗3次,每次10 min。ECL显色,在化学发光图像分析系统中曝光成像。应用Image J软件分析条带的灰度值,以目的蛋白和内参蛋白(GAPDH)条带灰度值之比表示目的蛋白的相对表达水平。

2 结果
2.1HGC-27细胞对UMI-77不敏感用UMI-77(1、2、5、10、20、50 μmol·L-1)处理MGC-803和HGC-27细胞48 h,MTS法检测细胞存活率。Fig 1结果显示,MGC-803细胞对UMI-77很敏感,随着UMI-77浓度升高,细胞存活率逐渐降低,呈现一定的浓度依赖性;而HGC-27细胞对UMI-77抵抗,20 μmol·L-1以下的浓度几乎对细胞存活无影响,只有在浓度高达50 μmol·L-1时,细胞才大量死亡。

Fig 1 Effect of UMI-77 on viability of gastric cancer MGC-803 and HGC-27 cells n=6)
**P<0.01vscontrol
2.2UMI-77和ABT-737联用能明显增加HGC-27细胞死亡在对UMI-77不敏感的HGC-27细胞中,分别将UMI-77(1、2、5、10 μmol·L-1)与10 μmol·L-1的ABT-737联用24 h,MTS法检测细胞存活率。如Fig 2A所示,10 μmol·L-1的ABT-737与UMI-77(1、2、5、10 μmol·L-1)联用时,能明显降低细胞存活率,与单用UMI-77或单用ABT-737相比,差异均有统计学意义(P<0.01)。进一步采用Annexin V-FITC/PI染色流式细胞术检测细胞凋亡情况,如Fig 2B所示,10 μmol·L-1UMI-77与10 μmol·L-1ABT-737联用24 h后,Annexin V (+)细胞所占的比例明显增多,且其中大部分死细胞都位于右下象限,说明确实发生了凋亡。
2.3UMI-77和ABT-737联用激活了线粒体凋亡途径JC-1染色流式细胞术检测线粒体膜电位(ΔΨm)的变化,Fig 3A结果显示,10 μmol·L-1UMI-77或10 μmol·L-1ABT-737单独处理24 h时Δψm较高,JC-1大多处于聚合状态,而UMI-77和ABT-737联用后Δψm急剧下降。Western blot结果显示(Fig 3B),UMI-77单用时caspases不激活,ABT-737单用时,caspases有一定程度的活化,但UMI-77和ABT-737联用后,caspase-9、caspase-3和PARP-1的裂解更加明显,表现为pro-caspase-9、pro-caspase-3和PARP-1的表达水平降低,同时cleaved-caspase-9、cleaved-caspase-3和cleaved-PARP-1出现,说明UMI-77和ABT-737联用是通过线粒体途径导致HGC-27细胞发生凋亡。
2.4IAP家族和Bcl-2家族在UMI-77和ABT-737联用中的作用Western blot检测IAP家族和Bcl-2家族在单用或联用UMI-77与ABT-737前后的表达情况,如Fig 4所示,IAP家族中的XIAP、cIAP1和cIAP2在UMI-77与ABT-737联用时下降,其中以XIAP和cIAP2的下降尤为明显,Survivin的表达没有变化;“BH3-only”蛋白中的NOXA明显增高,PUMA明显降低,抗凋亡蛋白中的Bcl-2略有升高、Mcl-1略有下降,但变化的程度很有限,而Bcl-xL和Bim没有任何改变。
3 讨论
以Bcl-2家族中的抗凋亡蛋白为靶点设计的小分子抑制剂,被称为BH3类似物,是一类新的抗肿瘤制剂,目前,研究得较为清楚的是ABT-737、ABT-263、ABT-199等。ABT-737和ABT-263在体内和体外实验中都具有很好的抗肿瘤活性,已进入Ⅰ/Ⅱ期临床试验阶段。ABT-199在2016年4月经美国FDA批准已经上市,用于染色体17p缺失的慢性淋巴细胞白血病的治疗,是第1个进入临床的BH3类似物,这一具有里程碑意义的事件,极大地激发了人们研究BH3类似物的热情。

Fig 2 Effect of treatment with UMI-77 plus ABT-737 on cell death in HGC-27 cells n=6)
A: Cell viability after treatment with UMI-77, ABT-737 alone or combination for 24 h; B: Apoptotic rate after treatment with UMI-77 plus ABT-737 for 24 h.**P<0.01 vs control;##P<0.01 vs 10 μmol·L-1UMI-77;△△P<0.01 vs 10 μmol·L-1ABT-737.
Mcl-1是抗凋亡蛋白里比较独特的成员,它只含有Bcl-2同源结构域1~3(Bcl-2 homology domain,BH1~3),尽管如此,它的分子量却最大,由350个氨基酸残基组成。其氨基端含有2个脯氨酸/谷氨酸/丝氨酸/苏氨酸(proline/glutamic acid/serine/threonine,PEST)序列,使得Mcl-1半衰期很短(<1~4 h)。Mcl-1在多种肿瘤中高表达,与肿瘤的发生、发展和不良预后相关[3]。利用基因转录或蛋白质翻译的抑制剂[4]或RNA干扰[5]办法下调Mcl-1,能增加肿瘤细胞对化疗药物或BH3类似物(ABT-737、ABT-199等)的敏感性,因此,研发出能特异性抑制Mcl-1的BH3类似物很有必要。
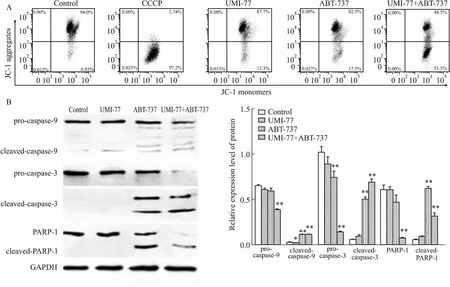
Fig 3 Effect of combination of UMI-77 with ABT-737 on mitochondrial membrane potential and caspases activation n=3)
A: Effect on the mitochondrial membrane potential using JC-1 staining by flow cytometry; B: Activation of caspase-9, caspase-3 and PARP-1.*P<0.05,**P<0.01vscontrol.
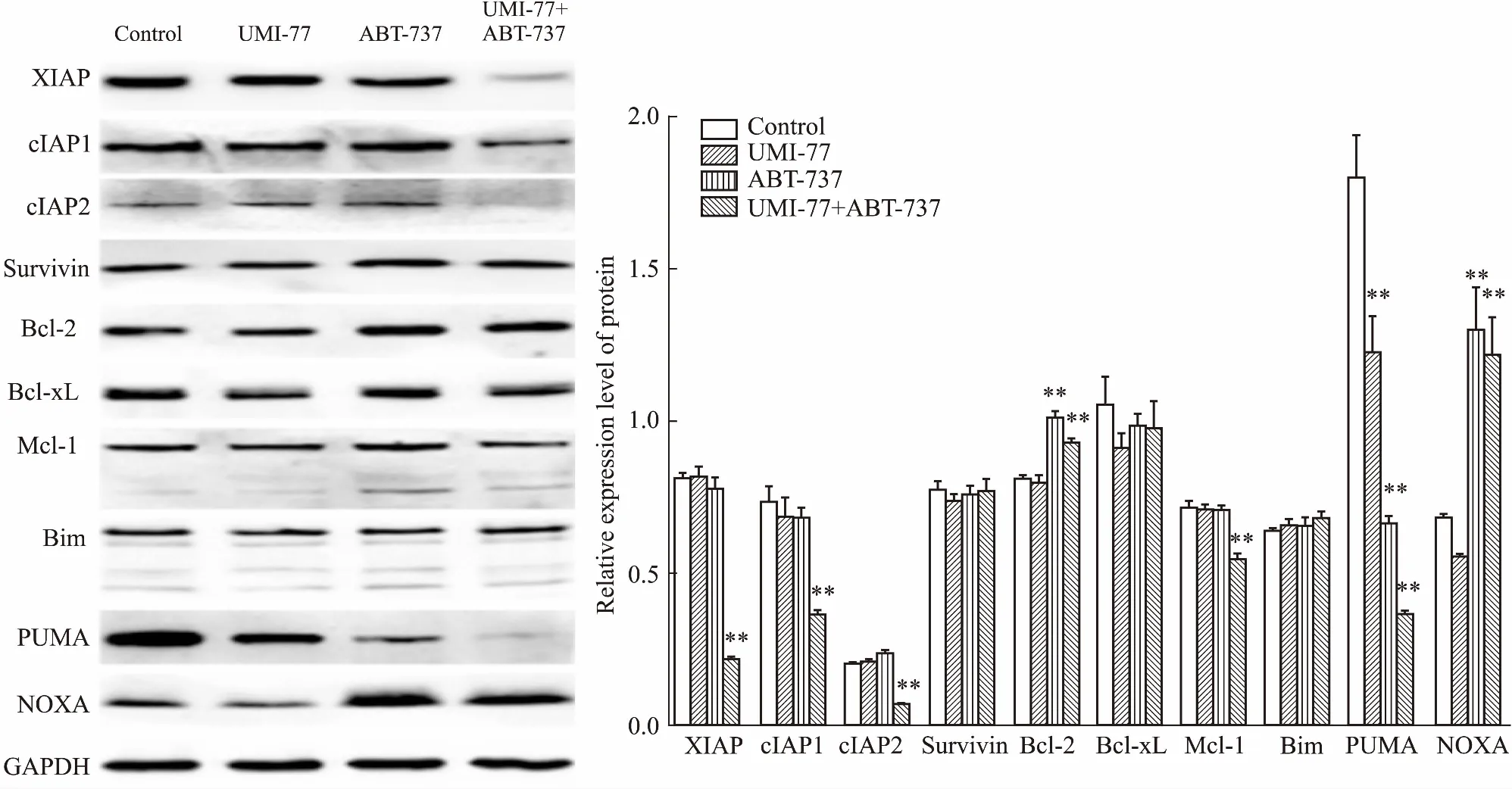
Fig 4 Effect of treatment with UMI-77, ABT-737, either alone or in combination, on expression levels of IAP family and Bcl-2 family members n=3)**P<0.01 vs control
与针对Bcl-2和Bcl-xL的抑制剂相比,Mcl-1抑制剂的研究稍显滞后,最近几年才陆续出现几个选择性针对Mcl-1的小分子抑制剂,如Maritoclax[6]、UMI-77、A-1210477[7]和S63845[8]。UMI-77是2014年Abulwerdi等[2]鉴定出的一种选择性的Mcl-1抑制剂,能与Mcl-1的BH3结合槽结合,阻止Mcl-1/Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和Mcl-1/Bcl-2同源拮抗者(Bcl-2 homologous antagonist killer,Bak)复合物形成,经线粒体途径诱导胰腺癌细胞发生凋亡。在胰腺癌异种移植物重症联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠模型中,UMI-77也显示出很强的抗肿瘤活性,且对周围组织无毒性。此外,UMI-77能增强胰腺癌细胞对放疗的敏感性[9],在神经胶质瘤[10]和食管鳞癌[11]中,将UMI-77与TRAIL或顺铂联用也能诱导更明显的细胞凋亡。
本研究将UMI-77作用于两株胃癌细胞,发现MGC-803细胞对之很敏感,单独使用就可以达到很好的效果,而HGC-27细胞对之抵抗,因此,如何克服HGC-27细胞对UMI-77的抵抗就是本研究的重点。HGC-27细胞对低浓度的ABT-737也不太敏感,但是当UMI-77和ABT-737联用后,细胞存活率明显下降,超过一半的细胞表现为Annexin V(+),且其中的绝大多数位于右下象限,说明细胞确实发生了凋亡。此外,前体形式的pro-caspase-9、pro-caspase-3和PARP-1明显减少,与之相伴着裂解形式的cleaved-caspase-9、cleaved-caspase-3及cleaved-PARP-1出现,说明caspases级联反应被激活;线粒体膜电位的下降,说明线粒体参与了细胞凋亡过程,这些都充分证实UMI-77和ABT-737联用是通过线粒体途径诱导HGC-27细胞发生凋亡。
为了了解凋亡相关调节蛋白在UMI-77和ABT-737联用中的作用,观察Bcl-2家族中的抗凋亡蛋白(Bcl-2、Bcl-xL、Mcl-1)、“BH3-only”蛋白(Bim、PUMA、NOXA),以及IAP家族中的XIAP、cIAP1、cIAP2、Survivin的表达水平,发现XIAP、cIAP1和cIAP2在联用时明显下调。IAP家族是一组内源性的抑制细胞凋亡的蛋白,包括XIAP、cIAP1、cIAP2、Survivin等8个成员。XIAP能直接结合到caspase-9、caspase-7和caspase-3上,从而抑制它们的活性,而凋亡发生时,从线粒体释放出来的第2个线粒体来源的caspases激活剂(second mitochondria-derived activator of caspases,SMAC)能解除XIAP对caspases的抑制。cIAP1和cIAP2能以高亲和力结合SMAC,阻止SMAC对XIAP的抑制作用,从而间接地抑制caspases。越来越多的证据表明,IAP家族在多种肿瘤细胞中高表达,其下调或失活会引起凋亡的增加[12],本研究中,XIAP、cIAP1和cIAP2的下降可能正是导致凋亡增加的关键因素。抗凋亡蛋白Bcl-2升高和Mcl-1降低的程度很有限,而“BH3-only”蛋白NOXA的上调和PUMA的下调却十分明显。“BH3-only”蛋白启动凋亡是通过直接激活Bax/Bak,或者抑制抗凋亡蛋白的作用来达成。如Bim、PUMA能抑制Bcl-2、Bcl-xL和Mcl-1,而NOXA只能抑制Mcl-1[13]。抗凋亡蛋白抑制凋亡主要是通过隔离“BH3-only”蛋白,或者阻止Bax/Bak发生同源寡聚化。在本研究中,“BH3-only”蛋白与抗凋亡蛋白之间究竟有着怎样复杂的相互作用尚不清楚,可能是NOXA的增加抑制了Mcl-1,另外,Bcl-2的增加又导致了PUMA的下降,这些问题还需要今后进一步深入的研究。
综上所述,不同的胃癌细胞对Mcl-1小分子抑制剂UMI-77的敏感性不同,对于那些对UMI-77抵抗的细胞,可以通过与Bcl-2/Bcl-xL抑制剂ABT-737联用的方式来增强杀伤效应,两者联用能更有效地激活线粒体凋亡途径。本研究的结果将有望拓展Mcl-1小分子抑制剂在更多实体肿瘤中的应用,为此类抑制剂最终进入临床提供理论依据。

