姜黄素对氧化应激条件下心肌细胞线粒体的保护作用
廖雪艳, 汪克纯
(四川省成都市第六人民医院, 四川 成都, 610051)
氧化应激在心肌缺血再灌注损伤的发生、发展中起着重要的作用[1-2]。线粒体是氧化应激产物的重要细胞器,其电子传递链中Ⅰ与Ⅲ复合体是产生活性氧(ROS)的主要部位。研究[3-4]表明,线粒体与心肌缺血再灌注损伤的各个环节密切相关。姜黄素是从姜黄中分离出来的一种相对分子量低的多酚类化合物。研究[5]发现姜黄素可以通过减轻线粒体内氧化应激、增加抗氧化应激酶活性、改善呼吸链功能等而改善肾脏、肝脏等细胞线粒体功能。作者推测姜黄素可能在氧化应激损伤中对心肌细胞线粒体也起着重要的保护作用。本实验通过体外培养H9c2心肌细胞株建立氧化应激模型,姜黄素预处理后观察氧化应激条件下细胞损伤,线粒体氧化应激产物及线粒体形态功能的变化,探讨其在氧化应激损伤中对心肌线粒体的保护作用及可能机制,现报告如下。
1 材料与方法
1.1 一般资料
H9c2心肌细胞株购自中国科学院上海细胞库; 姜黄素购自美国Sigma公司; 过氧化氢(H2O2)和MTT试剂盒; 活性氧(ROS)探针DCFH-DA、活性氮簇(RNS)探针、线粒体膜电位探针(JC-1)、细胞线粒体分离试剂盒和ATP测试试剂盒购自江苏碧云天生物技术有限公司; 乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、丙二醛(MDA)、超氧化物歧化酶(SOD)和三磷酸腺苷(ATP)酶测试试剂盒购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 H9c2心肌细胞株培养及氧化应激模型建立: 将H9c2细胞接种在无菌细胞培养皿中,放置在5% CO2、37 ℃培养箱中,用含有10%胎牛血清的DMEM/F12培养基培养, H9c2细胞密度达到80%~90%用于后续实验。用无血清DMEM/F12稀释H2O2原液,配制成50、100、200、400 μmol/L浓度梯度处理液,分别处理H9c2心肌细胞6 h,根据MTT实验结果选择最佳H2O2干预浓度,建立H9c2 细胞氧化应激模型。用二甲基亚砜(DMSO)稀释姜黄素配制成25、50、75、100 μmol/L浓度梯度处理液后,在H2O2处理液干预前30 min分别处理H9c2心肌细胞,根据MTT实验结果选择最佳姜黄素干预浓度。
1.2.2 分组及处理: H9c2心肌细胞按105个/孔接种于无菌6孔板上,当细胞密度长至80%~90%后用于后续实验。分组及处理: ① 正常对照组: 将H9c2心肌细胞接种至正常细胞培养液培养; ② 模型组(H2O2组): 将H9c2心肌细胞换无血清DMEM/F12培养基培养12 h, 然后加入最佳H2O2干预浓度处理液培养培养6 h; ③ 姜黄素预处理组(姜黄素组): 将H9c2心肌细胞在H2O2干预前30 min加入姜黄素最佳干预浓度培养处理,余同模型组。
1.2.3 MTT测细胞存活率: 根据MTT试剂盒说明书进行操作,将H9c2心肌细胞按104个/孔密度接种于无菌96孔板, DMEM/F12培养基培养24 h用于实验。用不同浓度H2O2处理液和姜黄素处理液分别干预细胞后,每孔加入20 μL (5 mg/mL)MTT试剂, 37 ℃培养箱孵育4 h, 弃上清,加入150 μL DMSO,置于室温摇床 10 min后用酶标仪490 nm波长测光密度(OD值)。
1.2.4 LDH和CK-MB水平检测: 将H9c2心肌细胞按105个/孔密度接种于无菌6孔板中,相应干预后(详见分组与处理)取各组细胞培养液,按照LDH和CK-MB试剂盒说明书中操作步骤进行操作,应用721D分光光度计测光密度值,检测各组LDH、CK-MB水平,单位为U/L。
1.2.5 透射电镜检测H9c2细胞线粒体形态结构: 将H9c2细胞接种至无菌细胞培养瓶中,按105个/孔密度接种于无菌6孔板,细胞密度长至80%~90%时,给予相应干预后,用无血清DMEM/F12 洗涤3 次,收集细胞; 然后加入2.5%戊二醛,固定细胞2 h,再加入1%四氧化锇,固定细胞15 min, 室温脱水,包埋,过夜,固化,切片,醋酸钠染色后自然干燥,柠檬酸铅染色; 晾干后采用透射电镜观察各组细胞线粒体形态结构。
1.2.6 流式细胞技术检测线粒体膜电位: 将H9c2心肌细胞按105个/孔密度接种于无菌6孔板中,给予相应干预后PBS洗涤3次,胰酶消化,用含血清DMEM/F12终止消化后收集细胞,加入JC-1探针10 μg/mL 37℃孵育20 min,500 μL PBS重悬细胞后上流式细胞仪观察,记录各组细胞平均荧光强度。
1.2.7 细胞内ATP水平检测: 将H9c2心肌细胞按105个/孔密度接种于无菌6孔板中,给予相应干预后取各组细胞,裂解后1 600 g离心10 min, 取上清,按照ATP测试试剂盒说明书中操作步骤进行操作,酶标仪检测光密度值(RLU值), BCA蛋白浓度试剂盒测定各组培养液蛋白浓度,检测各组细胞内ATP水平,单位为nmol/mg protein。
1.2.8 细胞线粒体的提取分离、线粒体酶及线粒体SOD和MDA水平检测: 将H9c2心肌细胞按105个/孔密度接种于无菌6孔板,给予相应干预后取各组细胞; 按照江苏碧云天生物技术有限公司细胞线粒体分离试剂盒操作。① 将得到的线粒体按照南京建成生物工程研究所线粒体ATP酶试剂盒说明书进行操作,检测各组线粒体钠钾ATP酶(Na+k+-ATPase)和钙镁ATP酶(Ca2+Mg2+-ATPase)活性水平,单位为μmol Pi/(mg protein·h)。② 将得到的线粒体按照南京建成生物工程研究所SOD和MDA试剂盒说明书进行操作,检测各组线粒体内SOD和MDA水平,单位分别为U/mg protein和nmol/mg protein。
1.2.9 激光共聚焦检测细胞内活性氧(ROS)和活性氮簇(RNS)水平: 将H9c2心肌细胞按105个/孔密度接种于无菌激光共聚焦皿,给予相应干预后,分别进行如下操作: ① 加入ROS探针DCFH-DA 10 μmol/L探针37 ℃孵育15 min; 激光共聚焦显微镜成像,激发波长488 nm, 发射波长525 nm。② 加入用DMSO配制的DHE5 μmol/探针, 37 ℃恒温孵箱孵育30 min; 激光共聚焦显微镜成像,激发波长543 nm, 发射波长560 nm。Image-ProPlus 6.0软件分析荧光的强度。
1.3 统计学处理

2 结 果
2.1 不同浓度H2O2对H9c2心肌细胞存活率的影响(n=3)
用不同浓度H2O2处理H9c2心肌细胞6 h建立心肌氧化应激模型。MTT结果显示,随着H2O2浓度梯度(50、100、200、400 μmol/L)的升高, H9c2心肌细胞存活率逐渐降低。与对照组100.00%心肌细胞存活率相比, 50、100 μmol/L H2O2处理H9c2心肌细胞6 h, 心肌细胞存活率分别为(82.79±0.52)%、(74.21±2.03)%, 差异有统计学意义(P<0.05)。而200、400 μmol/L处理时,心肌细胞存活率分别为(49.05±0.37)%、(28.20±1.05)%, 差异也有统计学意义(P<0.05)。提示200 μmol/L浓度的H2O2能够兼顾体现氧化应激损伤和适当的细胞活力,故在后续实验中选择200 μmol/L H2O2作为建立氧化应激模型的干预浓度。
2.2 不同浓度姜黄素对氧化应激损伤H9c2心肌细胞存活率的影响(n=3)
为了了解姜黄素对H9c2心肌细胞存活率的影响,氧化应激模型建立前30 min加入不同浓度的姜黄素(25、50、75、100 μmol/L)。MTT结果显示,与对照组100.00%心肌细胞存活率及H2O2组(46.02±0.76)%心肌细胞存活率相比,25、50、75、100 μmol/L姜黄素均可显著改善细胞存活率(P<0.05), 分别为(62.59±2.50)、(85.28±1.95)、(76.71±0.83)、(73.60±3.57)%,并在姜黄素 50 μmol/L时达到最高的H9c2心肌细胞存活率,故在后续实验中选择50 μmol/L 姜黄素作为干预浓度。
2.3 姜黄素对氧化应激损伤条件下LDH、CK-MB的影响(n=3)
与对照组相比,其余各组培养液中的LDH和CK-MB水平显著升高(P<0.05)。与H2O2组比较,姜黄素组LDH和CK-MB水平显著降低(P<0.05)。见表1。

表1 姜黄素对各组LDH、CK-MB水平的影响
LDH: 乳酸脱氢酶; CK-MB: 肌酸激酶同工酶。
与对照组比较, *P<0.05; 与H2O2组比较, #P<0.05。
2.4 姜黄素对氧化应激损伤条件下心肌细胞线粒体形态的影响
透射电镜观察结果显示,与对照组相比, H2O2组H9c2心肌细胞线粒体肿胀,嵴肿胀结构紊乱,空泡化,密度减低; 与H2O2组相比,姜黄素组H9c2心肌细胞线粒体肿胀减轻,线粒体嵴肿胀减轻,排列较整齐,空泡化程度明显减少。见图1。
2.5 姜黄素对氧化应激损伤条件下心肌细胞线粒体酶的影响(n=3)
与对照组相比, H2O2组H9c2心肌细胞线粒体Na+k+-ATPase和Ca2+Mg2+-ATPase活性显著降低(P<0.05); 与H2O2组相比,姜黄素组H9c2心肌细胞线粒体Na+k+-ATPase和Ca2+Mg2+-ATPase活性显著升高(P<0.05)。见表2。
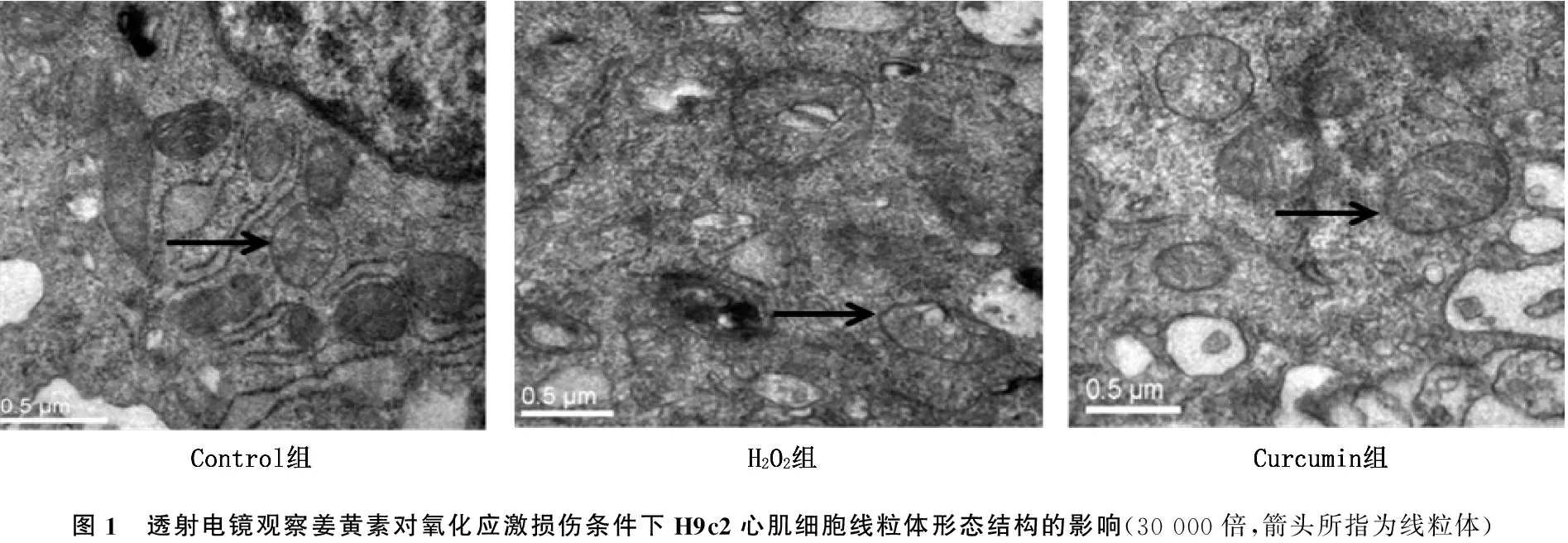
图1 透射电镜观察姜黄素对氧化应激损伤条件下H9c2心肌细胞线粒体形态结构的影响(30 000倍,箭头所指为线粒体)

表2 姜黄素对各组细胞线粒体酶的影响
Na+k+-ATPase: 钠钾ATP酶; Ca2+Mg2+-ATPase: 钙镁ATP酶。
与对照组比较, *P<0.05; 与H2O2组比较, #P<0.05。
2.6 姜黄素对氧化应激损伤条件下细胞ATP水平和线粒体膜电位的影响(n=3)
与对照组相比较, H2O2组H9c2心肌细胞中ATP水平和线粒体膜电位显著降低(P<0.05)。与H2O2组相比,给予姜黄素预处理能够显著升高H9c2心肌细胞中ATP水平和线粒体膜电位 (P<0.05)。见表3、图2。

表3 姜黄素对各组细胞ATP和线粒体膜电位的影响
ATP: 三磷酸腺苷。与对照组比较, *P<0.05;
与H2O2组比较, #P<0.05。
2.7 姜黄素对氧化应激损伤条件下心肌细胞ROS、RNS、MDA和SOD的影响(n=3)
与对照组相比, H2O2组H9c2心肌细胞中ROS, RNS和线粒体内MDA水平显著升高,而线粒体内SOD水平显著下降(P<0.05)。与H2O2组相比,姜黄素预处理能够显著降低H9c2心肌细胞中ROS, RNS和线粒体内MDA水平,升高线粒体中SOD水平(P<0.05)。见图3、4及表4。
3 讨 论
心肌细胞能量供应障碍是心肌缺血再灌注损伤的关键环节,线粒体功能障碍在心肌缺血再灌注损伤中起着关键的作用[6-7], 改善线粒体形态异常和功能障碍可作为减轻心肌缺血再灌注损伤的重要干预靶点。
本研究发现,随着H2O2浓度的升高, H9c2心肌细胞存活率降低; 给予不同浓度姜黄素预处理后,可使氧化应激条件下H9c2心肌细胞存活率升高,其中姜黄素 50 μmol/L 时达到H9c2心肌细胞存活率最高,并可显著降低氧化应激条件下LDH和CK-MB水平。上述结果表明,姜黄素能够减轻氧化应激条件下心肌细胞的损伤。
细胞内ATP水平与线粒体膜电位高低是反映线粒体功能状态的重要指标。氧化应激损伤可导致线粒体功能障碍,主要表现为ATP产生和线粒体膜电位降低。本研究结果显示,氧化应激可导致线粒体膜电位降低, ATP生成减少; 给予姜黄素干预后H9c2心肌细胞线粒体膜电位升高, ATP生成增加,提示姜黄素可以改善氧化应激条件下线粒体功能。
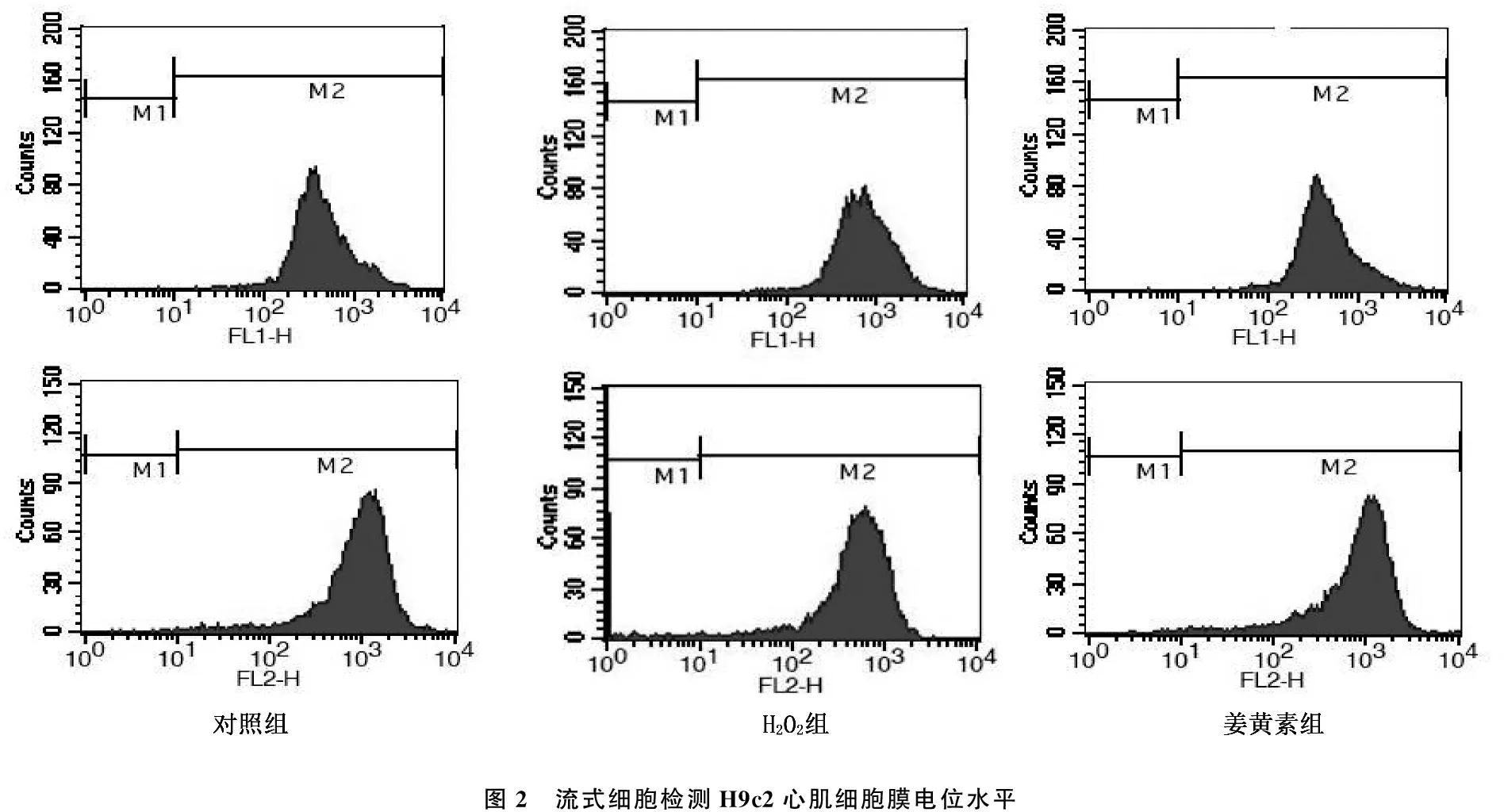
图2 流式细胞检测H9c2心肌细胞膜电位水平

图3 激光共聚焦检测H9c2心肌细胞ROS水平(1 000倍)
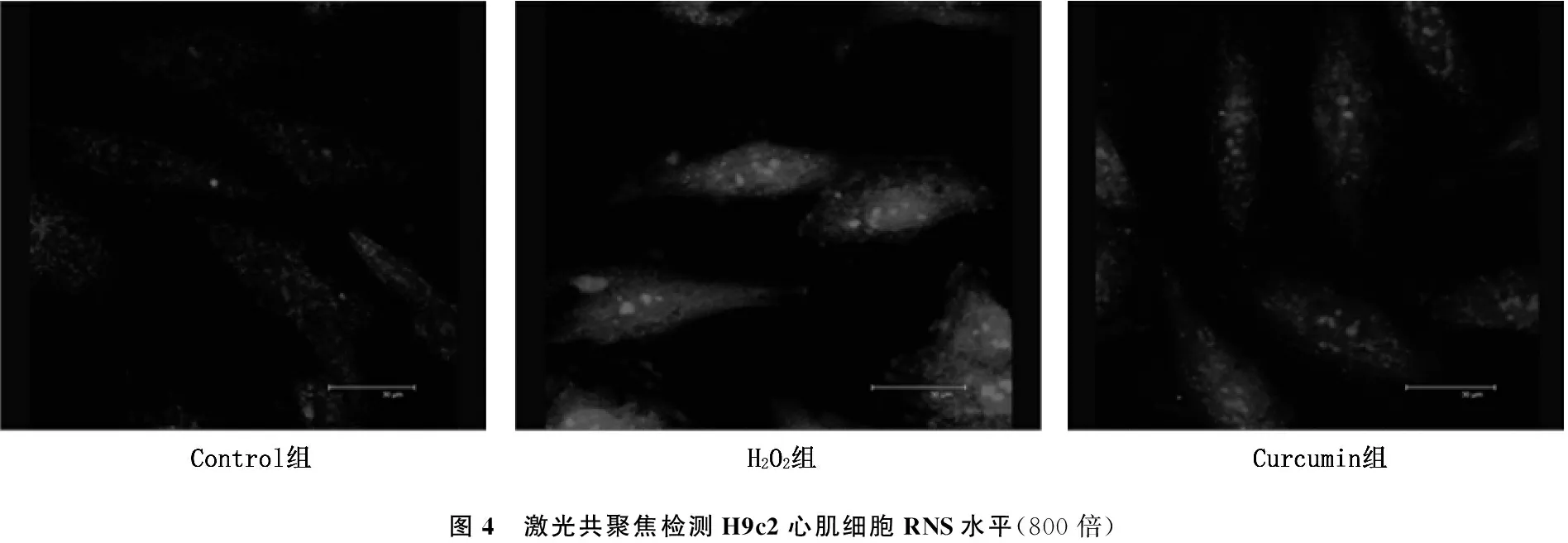
图4 激光共聚焦检测H9c2心肌细胞RNS水平(800倍)

表4 姜黄素对各组细胞的ROS、RNS、MDA和SOD影响
ROS: 活性氧; RNS: 活性氮簇; MDA: 丙二醛; SOD: 超氧化物歧化酶。与对照组比较, *P<0.05; 与H2O2组比较, #P<0.05。
线粒体膜Na+k+-ATPase和Ca2+Mg2+-ATPase是维持线粒体膜流动性关健酶。其活性下降,造成线粒体电解质平衡紊乱,线粒体水肿等形态结构变化,进而导致线粒体氧化磷酸化功能障碍, ATP合成不足[8-9]。本实验通过透射电镜检测发现,氧化应激可导致线粒体水肿,密度降低,线粒体嵴水肿; 给予姜黄素干预后可减轻线粒体及线粒体嵴的水肿,维持线粒体正常的形态结构。本实验结果还发现,氧化应激导致线粒体膜Na+k+-ATPase和Ca2+Mg2+-ATPase活性降低; 姜黄素干预后可提高线粒体膜Na+k+-ATPase和Ca2+Mg2+-ATPase活性。上述结果提示姜黄素可通过维持氧化应激条件下线粒体正常的形态结构及提高线粒体膜Na+k+-ATPase和Ca2+Mg2+-ATPase活性来改善线粒体功能。
超氧化物歧化酶(SOD)是细胞内关键的抗氧化超氧歧化物酶类,其水平可以间接反映细胞内抗氧化能力[10]。丙二醛(MDA)是细胞氧化应激损伤的产物,其水平反映了细胞受自由基攻击和损伤的程度。为了解姜黄素对氧化应激条件下H9c2心肌细胞线粒体内SOD和MDA的影响,本实验观察相应干预条件下H9c2心肌细胞线粒体内SOD和MDA水平的变化。结果发现,氧化应激条件下, H9c2心肌细胞线粒体内SOD水平降低, MDA水平升高; 给予姜黄素预处理后, H9c2心肌细胞线粒体内SOD水平升高, MDA水平降低,上述结果说明姜黄素可增强线粒体内源性抗氧化能力,减轻线粒体的氧化应激损伤。
心肌缺血再灌注后组织恢复氧灌注会引起剧烈的线粒体氧化应激,主要表现为线粒体内活性氧簇(ROS)和活性氮簇(RNS)生成增加[11], 最终导致线粒体功能障碍,表现为线粒体膜电位降低[12-13], 线粒体内钙超载[14-15]等。本研究发现,氧化应激条件下,H9c2心肌细胞线粒体ROS和RNS生成显著增加; 给予姜黄素预处理后,线粒体内ROS和RNS生成显著减少。
综上所述,姜黄素可改善氧化应激条件下H9c2心肌细胞的线粒体形态和功能,表现为升高线粒体膜电位、增加ATP生成、提高线粒体ATPase活性和维持线粒体正常的形态结构,其机制可能与清除细胞内氧化应激产物(如ROS、MDA), 增强细胞内SOD活性有关。

