替诺福韦酯阻断乙型肝炎病毒母婴传播的疗效和安全性的Meta分析
黄 丽,龙云铸,罗圣平,谭秋红,刘 珂(.株洲市中心医院药学部,湖南 株洲 4000;.株洲市中心医院感染内科,湖南株洲 4000)
中国是乙型肝炎病毒 (hepatitis B virus,HBV)感染大国,母婴传播是HBV重要传播途径,婴儿感染HBV后,65% ~ 90%将发展成为慢性HBV感染,是肝硬化及肝细胞癌的主要原因之一。HBV感染母亲所生婴儿出生时应用乙肝免疫球蛋白(HBIg)可降低母婴传播风险,但是高HBV病毒载量的孕妇仍有传播给其婴儿的风险。替诺福韦酯(TDF)、替比夫定(LDT)及拉米夫定(LAM)用于高HBV病毒载量的孕妇,可能降低母婴传播风险。各国指南均建议首选TDF[1-2],因其具有高耐药基因屏障,且孕期用药安全。
2016年有学者发表了1篇关于慢性HBV妊娠期抗病毒治疗的Meta分析[3],该篇Meta分析纳入的研究主要是LDT及LAM相关的研究,TDF相关的研究仅有3篇,且均为非随机对照试验(NRCT),虽然纳入标准中提到英文及非英文文献均纳入,且文献中提到92%的研究是在中国开展,但中文文献仅检索了CBM数据库。2017年发表的1篇关于TDF阻断HBV母婴传播疗效和安全性Meta分析[4]结果示:TDF使婴儿HBsAg阳性发生风险降低77%,但未纳入中文文献。2018年在泰国开展1项比较TDF和安慰剂预防HBV母婴传播的RCT[5]结果示,在婴儿接种HBIg和疫苗之外,母亲额外使用TDF与安慰剂相比没有降低母婴HBV传播率,与既往研究结果不同。本研究对慢性HBV孕妇在妊娠中晚期应用TDF阻断HBV母婴传播疗效和安全性进行Meta分析,旨为临床提供循证参考。
1 资料与方法
1.1 文献检索策略
计算机检索Cochrane Library、PubMed、Embase、CBM、CNKI、VIP、万方数据库,检索时限从建库至2018年3月28日。中文检索词包括:孕期、孕妇、妊娠、母婴传播、宫内感染、乙肝、HBV、替诺福韦酯、TDF。英文检索词包括:tenofovir, TDF, Viread,antiviral, pregnancy, gravidity, pregnant, maternity,maternal, mother to child transmission, MTCT,maternal to child transmission, adult to children transmission,infectious disease transmission, vertical, perinatal transmission, intrauterine transmission, hepatitis b virus,hepatitis B, HBV。
1.2 纳入与排除标准
1.2.1 研究类型 RCT、队列研究。语种限中、英文。
1.2.2 研究对象 HBV感染(HBsAg阳性)的孕妇和其分娩婴儿; 婴儿均注射HBV疫苗和HBIg。
1.2.3 干预措施 试验组妊娠中晚期TDF抗病毒治疗阻断HBV母婴垂直传播。对照组为空白对照或安慰剂对照。
1.2.4 结局指标 主要结局指标:新生儿和6 ~ 12月龄婴儿HBsAg及HBV DNA阳性率。次要结局指标:孕妇HBV DNA抑制,丙氨酸氨基转移酶(ALT)复常,HBeAg血清学转换。孕妇安全性指标:肌酸激酶(CK)升高,肌酐(Cr)升高,ALT骤升、剖宫产和产后出血率。胎儿安全性指标:先天畸形,早产率,低出生体重(< 2500 g)和胎儿死亡率。
1.2.5 排除标准 患者合并其他类型的肝炎或艾滋病;妊娠期间接受糖皮质激素、化疗、免疫调节治疗、肝移植或血液透析;重复发表及数据不充分的研究;会议摘要。
1.3 资料提取和质量评价
采用医学文献王软件管理并筛选文献,由两位研究者根据纳入排除标准独立筛选文献和提取资料,如遇分歧,则讨论解决或征求第三位研究者的意见。主要提取的信息包括:第一作者、发表年份、研究设计、纳入患者的种族、入选标准、年龄、病例数、孕妇HBV DNA抑制、ALT复常及HBeAg血清学转换、新生儿和6 ~ 12月龄儿的HBsAg或HBV DNA阳性、孕妇和胎儿的不良结局。
采用Cochrane偏倚风险评估工具对RCT进行评价,采用NOS量表对队列研究进行评价。
1.4 统计学方法
采用RevMan 5.3统计软件进行Meta分析。分类变量采用相对危险度(RR)为效应分析统计量;区间估计采用95%可信区间(CI)表示。采用χ2检验判断统计学异质性,如果异质性检验P> 0.1且I2< 50%时,认为各研究结果间无统计学异质性。因纳入研究包括RCT及NRCT,采用随机效应模型进行效应分析,并对不同的研究类型进行亚组分析。
2 结果
2.1 文献检索结果
初步检索获得文献2125篇,最终纳入分析11篇(RCT 2篇,队列研究9篇)。具体文献筛选流程见图1。
图1 文献筛选流程图Fig 1 Flow chart of literature screening
2.2 纳入研究的基本特征和质量评价结果
11项研究中有7项(63.6%)在中国开展;纳入的2项RCT均为多中心研究,Jourdain等[5]采用安慰剂对照,Pan等[6]采用空白对照;纳入研究TDF均为妊娠中晚期开始给药,TDF组孕妇HBV DNA均>2×105IU·mL-1;TDF组和对照组在婴儿出生后均给予HBIg + 疫苗联合免疫。Pan等[6]的研究为开放性研究,未实施盲法,偏倚风险为高风险。Samadi等[7]研究中的暴露组和非暴露组纳入标准不一致,且随访不充分,偏倚风险为高风险,详见表1。
2.3 Meta分析结果
2.3.1 母婴传播率 6项研究报道了出生后24 h新生儿HBsAg阳性率。Meta分析结果显示,TDF组HBsAg阳性率6.3%(19/302),对照组HBsAg阳性率16.5%(51/310),TDF使新生儿HBsAg阳性发生风险降低59%[RR = 0.41,95%CI(0.18,0.90)]。5项研究报道了出生后24 h新生儿HBV DNA阳性率,Meta分析结果显示,TDF组HBV DNA阳性率2.9%(8/275),对照组HBV DNA阳性率34.1%(133/390),TDF使新生儿HBV DNA阳性发生风险降低84%[RR = 0.16,95%CI(0.08,0.32)]。
10项研究报道了出生后6 ~ 12月婴儿HBsAg阳性率,Meta分析结果显示,TDF组HBsAg阳性率5.2%(28/539),对照组HBsAg阳性率12.7%(83/654),TDF使婴儿HBsAg阳性发生风险降低69%[RR = 0.31,95%CI(0.14,0.67)]。3项研究报道了出生后6 ~ 12月婴儿HBV DNA阳性率,Meta分析结果显示,TDF组HBV DNA阳性率为0(0/113),对照组HBV DNA阳性率13.9%(29/208),TDF使婴儿HBV DNA阳性发生风险降低88%[RR = 0.12,95%CI(0.02,0.60)]。详见图2。

表1 纳入研究的基本特征Tab 1 Characteristics of the included studies

图2 母婴传播率Meta分析森林图A - 出生后24 h新生儿HBsAg阳性率,B - 出生后24 h新生儿HBV DNA阳性率,C - 出生后6 ~ 12月婴儿HBsAg阳性率,D - 出生后6 ~12月婴儿HBV DNA阳性率Fig 2 Forest plots of mother-to-child transmission rate outcomes A - HBsAg positivity in newborns within 24 hours, B - HBV DNA positivity in newborns within 24 hours, C - HBsAg positivity in infants within 6 - 12 months, D - HBV DNA positivity in infants within 6 -12 months
2.3.2 孕妇疗效指标 4项研究报道了HBV DNA抑制,Meta分析结果显示TDF组HBV DNA抑制率高于对照组[RR = 38.31,95%CI(14.47,101.44)];仅1项研究(Celen 2013)报道了ALT复常率,TDF组80.9%(17/21),对照组62.5%(15/24),两组差异无统计学意义[OR = 2.55,95%CI(0.65,10.01)];2项研究报道了HBeAg血清转换,Meta分析结果显示两组差异无统计学意义[RR = 1.09,95%CI(0.05,25.43)]。详见图3。
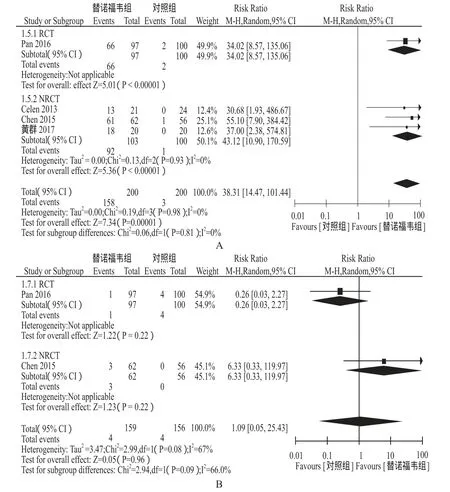
图3 孕妇疗效指标Meta分析森林图A - HBV DNA抑制,B - HBeAg血清转换Fig 3 Forest plots of maternal effi cacy outcomes A - HBV DNA suppression, B - HBeAg seroconversion
2.3.3 孕妇安全性指标 2项研究报道了Cr发生率,RR = 0.34,95%CI(0.01,8.33)。2项研究报道了CK发生率,RR = 7.83,95%CI(0.95,64.74)。6项研究报道了ALT骤升发生率,RR = 1.30,95%CI(0.52,3.28)。7项研究报道了剖宫产率,RR = 1.02,95%CI(0.87,1.18)。3项研究报道了产后出血率,RR =0.77,95%CI(0.30,1.99)。孕妇Cr、CK、ALT骤升、剖宫产及产后出血发生率TDF组和对照组差异无统计学意义。详见图4。

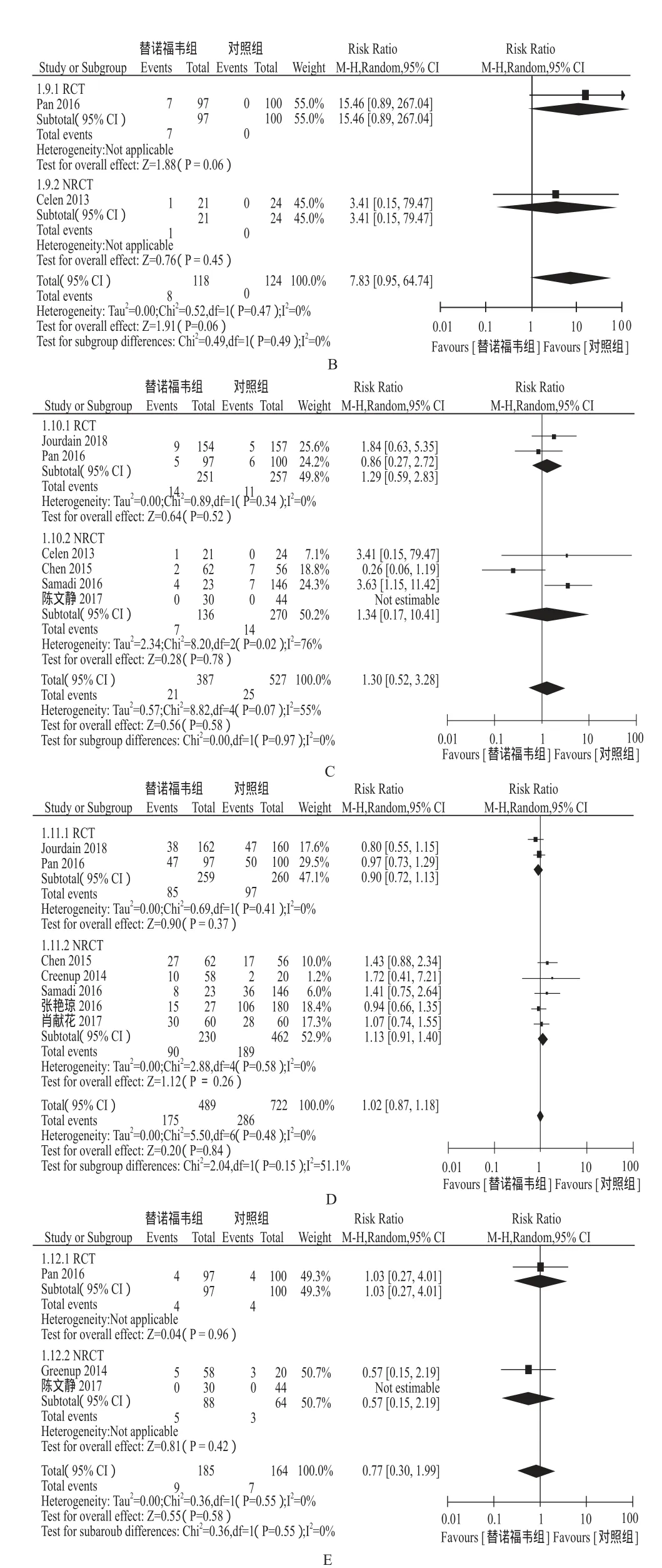
图4 孕妇安全性指标Meta分析森林图A - Cr发生率,B - CK发生率,C - ALT骤升,D - 剖宫产率,E -产后出血Fig 4 Forest plot of safety indicators in pregnant women A - Cr elevation, B - CK elevation, C - ALT fl are, D - cesarean section rate, E - postpartum hemorrhage
2.3.4 婴儿安全性指标 9项研究报道了婴儿先天畸形发生率,TDF组(4/528),对照组(5/767),RR = 0.93,95%CI(0.28,3.12)。5项研究报道了早产率,RR =1.54,95%CI(0.65,3.63)。仅1项研究(Celen 2013)报道了低出生体重发生率,TDF组4.8%(1/21),对照组4.3%(1/23)[OR = 1.10,95%CI(0.06,18.77)]。6项研究报道了胎儿死亡率,RR = 1.56,95%CI(0.32,7.63)。婴儿先天畸形、早产、低出生体重及胎儿死亡发生率TDF组和对照组差异无统计学意义。详见图5。

图5 婴儿安全性指标Meta分析森林图A - 先天性畸形发生率,B - 早产率,C - 死亡率Fig 5 Forest plot of infant safety indicators A - congenital malformation, B - preterm birth rate, C - fetal death
3 讨论
预防HBV母婴传播具有临床挑战性。大部分妊娠患者处于免疫耐受期,HBeAg阳性,HBV DNA水平高,使用HBIg和疫苗预防的胎儿仍有可能发生HBV感染。因为证据有限且级别低,2015年WHO慢性HBV感染管理指南并未推荐抗病毒药物预防HBV母婴传播。随着相关研究逐渐增多,2017年EASL乙型肝炎管理指南建议对HBV DNA > 200 000 IU·mL-1或HBsAg≥104IU·mL-1的孕妇,在妊娠24 ~ 28周开始服用TDF,直到分娩后12周[1]。2017年SOGC乙型肝炎与妊娠指南建议在孕妇HBsAg阳性、HBV DNA载量> 200 000 IU·mL-1情况下,在妊娠28 ~ 32周开始使用核苷逆转录酶抑制剂进行抗病毒治疗[2]。
本研究提示,与安慰剂或空白对照组相比,高HBV病毒载量的孕妇,妊娠中晚期予以TDF抗病毒治疗,孕妇HBV DNA抑制率更高;新生儿HBsAg阳性发生风险降低59%,HBV DNA阳性发生风险降低84%;6 ~ 12个月婴儿HBsAg阳性发生风险降低69%,HBV DNA阳性发生风险降低88%。
本研究主要局限性如下:①RCT仅有2项,Meta分析中纳入了RCT和队列研究数据。Hyun等[4]在TDF阻断HBV母婴传播疗效和安全性Meta分析中提到精心设计的观察性研究偏倚风险并不一定比RCT高,如果研究设计是引起差异的唯一原因,纳入观察性研究可增加样本量,得到更可靠的证据。②出生后24 h新生儿和6 ~ 12个月婴儿HBsAg阳性率这两项主要结局指标,RCT和队列研究组间异质性较大,一方面因为目前无统一规定,虽然开始抗病毒治疗的时机均在妊娠中晚期,但不同研究间开始抗病毒治疗的孕周存在差异,孕28周后HBV可能已经感染胎盘,此时抗病毒治疗无效,导致阻断失败;另一方面队列研究人群的选择,虽然非暴露组和暴露组均来自医院孕检的人群,但分组通常是根据患者的意愿进行,患者本身的用药依从性及对疾病的认识就已经存在差异。此外Jourdain等[5]的解释还包括:HBV疫苗和HBIg使用的时机有所不同;羊膜穿刺术、分娩方式和逃逸突变株的流行率也可能是导致差异的原因。③纳入的研究中大多数参与者是亚洲人,63.6%的研究是在中国开展。需要更多在不同种族的推广结果。④因为纳入研究随访时间的局限性,TDF远期安全问题尚未得到充分评价。未来的研究应持续监测TDF的母婴安全。⑤目前在开始抗病毒治疗的HBV DNA阈值问题上,尚无统一的意见。虽然纳入的研究中HBV DNA基础值均 > 2×105IU·mL-1,但仍存在差异。
综上,高病毒载量的慢性HBV孕妇在妊娠中晚期应用TDF可降低孕妇HBV病毒载量,降低母婴传播风险,且未增加母婴不良反应发生风险。但目前研究尚不够充分,应继续开展多中心、大样本、高质量的RCT进行证实。并在此基础上探讨抗病毒治疗开始及停药时机,研究设计应充分考虑孕妇HBV DNA水平对结果的影响,进行分层分析,以便探讨开始抗病毒治疗的最佳时机及HBV DNA阈值;此外可考虑延长随访时间,评估TDF孕期用药的远期安全性。

