自由基氧化对猪肌球蛋白-醛类化合物吸附特性的影响
丁安子,朱 萌,2,乔 宇,汪 兰,熊光权,吴文锦,廖 李,李 新,石 柳,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心,湖北 武汉 430064;2.湖北工业大学,湖北 武汉 430064)
1993年,Decker等[1]第一次将蛋白质氧化的概念引入肉及肉制品加工体系,随后肉制品中蛋白质氧化的研究引起国内外学者的广泛关注。研究发现,蛋白质的氧化贯穿于肉制品加工贮运的整个过程,造成蛋白质功能特性(溶解度、黏度、凝胶性、乳化性和保水性)发生变化[2],影响肉制品的最终品质。氧化对蛋白质功能特性的影响基于其对蛋白质构象的改变,包括氨基酸修饰[3]、肽链断裂[4]、分子内/分子间交联[5-7]以及解折叠(结构展开)[8]。在现代肉类食品加工体系中,产品风味是十分重要的评判标准[9]。风味感知取决于风味成分的浓度、阈值等,以及与食品组分(肉制品主要为蛋白质)间相互作用。在影响蛋白质与风味成分相互作用的各种因素中,蛋白质构象的改变是一个重要因素[10-11]。现有研究结果表明,温度、pH值与盐类均可通过改变蛋白质构象而影响蛋白质的风味吸附能力[12-16]。但由于氧化造成蛋白质构象的改变,进而影响其风味吸附能力的研究鲜见报道。
本实验以猪肉为原料,采用FeCl3/抗坏血酸/H2O2羟自由基氧化体系对猪肌球蛋白进行模拟氧化,探讨自由基氧化对肌球蛋白结构变化及对醛类化合物吸附特性的影响,以期对肉类食品风味改进及加工贮存过程中风味控制和产品改良提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
选用4~5 月龄的阉割的长白公猪(96±5)kg,宰后2 h内取猪后腿股二头肌肌肉去除结缔组织和脂肪后绞碎,真空包装后贮存于-20 ℃冰箱内备用。
BCA蛋白浓度测定试剂盒 碧云天生物技术研究所;3-甲基丁醛、戊醛、庚醛、辛醛(色谱纯,纯度>98%) 国药集团生物有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
ALPHA 1-4 LD plus冷冻干燥机 德国Christ 公司;inVia-Reflex拉曼光谱仪 法国Renishaw公司;SpectraMax 190全波长酶标仪 美国MD公司;57330U固相微萃取装置、57318萃取头 美国Supelco公司;QP2010气相色谱-质谱联用仪 日本岛津公司;WH966旋涡混合器 上海康华生化仪器制造有限公司。
1.3 方法
1.3.1 肌球蛋白提取与纯化
参照吕彤等[12]的方法。取肌肉100 g,加入6 倍体积6 mmol/L K2HPO4/KH2PO4缓冲液(pH 6.9),在冰上高速匀浆3 次,每次6 s,间隔10 s,然后低温离心(11 500×g、10 min、4 ℃)。收集沉淀,再次加入6 mmol/L K2HPO4/KH2PO4缓冲液(pH 6.9)匀浆、离心(11 500×g、10 min、4 ℃)并收集沉淀,重复3 次。取沉淀加入2 倍体积0.675 mol/L KCl溶液(含7.5 mmol/L MgCl2,0.15 mmol/L二硫苏糖醇(dithiothreitol,DTT),7.5 mmol/L ATP,pH 6.4)抽提10~12 min,然后低温离心(11 500×g、10 min、4 ℃)。收集上清液,用9 倍体积预冷后的蒸馏水稀释并低温离心(11 500×g、10 min、4 ℃),所得沉淀用1/5体积的0.12 mol/L Tris-maleate缓冲溶液(含3 mol/L KCl、0.6 mmol/L DTT,pH 7.5)溶解,再加入1/10体积的含110 mmol/L ATP和55 mmol/L MgCl2,5.5 mmol/L EGTA的溶液(pH 7.5)后,用质量分数40%~55%的(NH4)2SO4饱和溶液分离,所得沉淀即为粗肌球蛋白。
用20 mmol/L Tris-maleate缓冲液(含0.5 mol/L KCl、0.1 mmol/L DTT,pH 7.5)溶解沉淀并透析过夜,-50 ℃冷冻干燥48 h,即得纯化的肌球蛋白。
1.3.2 肌球蛋白氧化处理
采用芬顿氧化体系:其中FeCl3浓度为0.1 mmol/L,抗坏血酸浓度为1 mmol/L,H2O2浓度分别为0、1、5、10、20 mmol/L。
采用50 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl,pH 7.0)调整肌球蛋白质量浓度为20 mg/mL。将肌球蛋白溶液与氧化体系等体积混合,混合液在2 ℃条件下避光氧化24 h。为减少氧化反应试剂对后续实验的影响,将氧化后的肌球蛋白装入透析袋,以20 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl,pH 7.0)为透析液,于4 ℃条件下透析过夜。将透析后的肌球蛋白溶液冷冻干燥,贮存于-20 ℃冰箱中备用。
1.3.3 巯基总量及活性巯基含量测定
参照Hamada等[17]的方法,略作修改。采用20 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl,pH 7.0)调整肌球蛋白质量浓度为4 mg/mL。取0.75mL肌球蛋白溶液,加入2.25 mL 8 mol/L尿素,使尿素终浓度为6 mol/L;向混合液中添加20 μL 1.5 mg/mL二硝基苯甲酸,25 ℃孵化5 min,在412 nm波长处测定吸光度,空白组为不加蛋白质而含缓冲液的混合体系。巯基含量计算如式(1)所示:
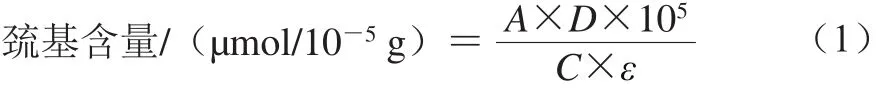
式中:A为减去试剂空白后412 nm波长处蛋白吸光度;D为蛋白稀释倍数;C为蛋白质量浓度/(mg/mL);ε为摩尔消光系数(13 600 L/(mol·cm))。
1.3.4 肌球蛋白二级结构测定
参照Alix等[18]的方法,略作修改。取1 g冷冻干燥后的肌球蛋白样品,选用20 倍长聚焦镜头聚焦测试。具体条件为:532 nm氩离子激光器,功率12 mW,分辨率1 cm-1,收集180°散射光,扫描范围500~2 100 cm-1,每个样品扫描30 次。数据处理采用Labspec软件对结果谱图进行基线校正及平滑处理,以苯丙氨酸的单基取代苯基环在1 003 cm-1伸缩振动强度作为内标进行归一化。蛋白质二级结构(α-螺旋、β-折叠、β-转角、无规则卷曲及其他结构)含量计算参考Susi等[19]的方法,利用PeakFit 4.12软件结合傅里叶去卷积处理进行曲线拟合定量分析蛋白质酰胺I带。
1.3.5 表面疏水性测定
参照Boyer等[20]的方法。采用20 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl,pH 7.0)调整肌球蛋白质量浓度为1 mg/mL,以8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)为荧光探针,取6.5 μL 0.8 mmol/L的ANS添加到200 μL肌球蛋白溶液中。激发波长380 nm,发射波长475 nm,激发和发射波长的狭缝均设定为5 nm,用全波长酶标仪测定荧光强度。以未处理的肌球蛋白作为对照,疏水强度用处理组蛋白与对照组蛋白荧光强度的比例(相对荧光强度)表示,计算如式(2)所示:

1.3.6 醛类化合物标准溶液制备及固相微萃取-GC/MS测定
将3-甲基丁醛、戊醛、庚醛、辛醛4 种醛类化合物分别用少量乙醇溶解,然后用纯水定容至各化合物质量浓度为1 mg/mL,即得醛类化合物标准溶液,贮存于4 ℃冰箱中备用。
采用20 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl,pH 7.0)将纯化及自由基氧化处理后的猪肉肌球蛋白溶解,调整质量浓度为1 mg/mL。精确吸取5 mL蛋白溶液至20 mL顶空瓶中,然后添加醛类化合物标准溶液并调整其质量浓度为1 μg/mL,置于4 ℃振动平衡16 h后,选用75 μm CAR/PDMS萃取头在25 ℃顶空吸附40 min后气相色谱进样。
色谱条件:色谱柱:v o c o l毛细管柱(60 m×0.32 mm,0.18 μm);程序升温:初始温度35 ℃,保持3 min,以3 ℃/min升至40 ℃,再以5 ℃/min 升至210 ℃,保持15 min;进样口温度250 ℃;载气为He,流量1 mL/min。
质谱条件:电子电离源温度200 ℃;电子电离能量70 eV;质量扫描范围45~600 u。各风味成分的质谱数据与NIST、WILEY7.0进行比对定性,对鉴定化合物进行峰面积归一化定量分析。
蛋白质-醛类化合物作用强弱,参照周昌瑜等[13]的方法,用溶液中化合物自由比例表示,计算如式(3)所示:
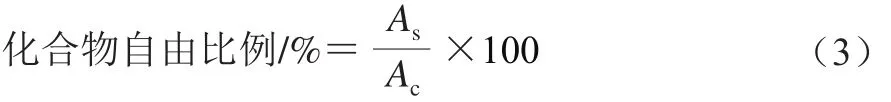
式中:As为蛋白样品溶液中醛类化合物的峰面积;Ac为空白溶液中醛类化合物的峰面积。
1.4 统计分析
采用SAS 8.0中one-way ANOVA的Duncan’s Multiple Range Test模型序进行统计学分析,P<0.05,差异显著。
2 结果与分析
2.1 肌球蛋白巯基总量和活性巯基含量分析
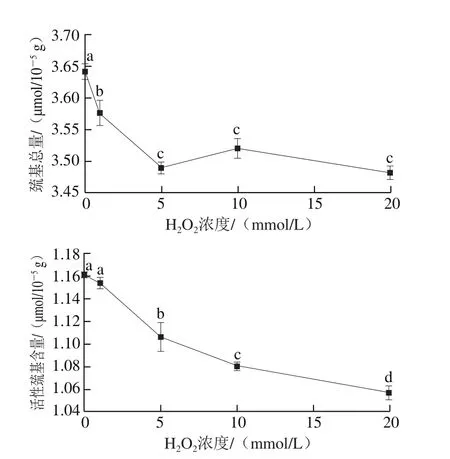
图1 H2O2处理浓度对肌球蛋白巯基总量和活性巯基含量的影响Fig. 1 Effect of H2O2 concentration on total and reactive sulfhydryl contents of myosin
如图1所示,随着H2O2处理浓度的增加,巯基总量整体呈降低趋势,当H2O2浓度在0~5 mmol/L范围时,处理组巯基总量显著降低(P<0.05),在10~20 mmol/ L范围时,巯基总量变化不显著(P>0.05);活性巯基含量呈显著降低趋势(P<0.05),与李艳青等[21]的研究结果一致。
半胱氨酸残基中的巯基是蛋白质中最活泼的基团,也是抗氧化活性最强的基团[22],其含量的变化可反映蛋白质氧化情况[23]。肌球蛋白分子中约含有40 个半胱氨酸残基,其中27 个分布在肌球蛋白头部S1亚基上,13 个分布在螺旋状杆部(Rod)上[24]。处于氧化体系中时,S1亚基中的半胱氨酸残基首先被氧化修饰,随后Rod中巯基基团暴露于肌球蛋白表面,此时形成的分子内二硫键占主导;随着H2O2处理浓度的继续增加,分子间二硫键大量生成,蛋白质发生交联聚集[25]。
在本研究中,H2O2浓度在0~1 mmol/L之间时,活性巯基含量变化不明显(P>0.05),巯基总量显著减少(P<0.05)且远大于活性巯基含量变化,说明蛋白结构被打开,肌球蛋白头部S1亚基内部巯基首先暴露出来,同时蛋白表面巯基被氧化消耗,且暴露的量远大于消耗的量;H2O2浓度在1~5 mmol/L之间时,巯基总量和活性巯基含量均显著减少(P<0.05),且活性巯基含量减少量约为巯基总量的1/2,说明蛋白结构进一步打开,蛋白内部巯基大量暴露;H2O2浓度在5~10 mmol/L之间时,巯基总量轻微上升(P>0.05),活性巯基含量显著减少(P<0.05),肌球蛋白表面巯基被羟自由基氧化形成分子间二硫键,发生LMM-LMM交联聚集[26];H2O2浓度在10~20 mmol/L之间时,巯基总量轻微降低(P>0.05),活性巯基含量显著减少(P<0.05),说明蛋白表面巯基进一步转化为分子间二硫键,蛋白质交联聚集加剧。
2.2 肌球蛋白二级结构分析
不同浓度H2O2处理的肌球蛋白峰拟合图谱如图2所示,肌球蛋白二级结构相对含量变化如表1所示:α-螺旋的相对含量先降低后升高,当H2O2浓度在0~5 mmol/L范围时,处理组持续显著降低(P<0.05),在10 mmol/L时出现显著升高(P<0.05),与李春强等[27]的研究结果相似;β-折叠、β-转角和无规则卷曲的相对含量变化呈波动变化趋势。
肌球蛋白主要由α-螺旋结构构成[28],受到羟自由基的攻击时,其α-螺旋结构失去稳定引起蛋白质构象的改变。在本研究中,H2O2浓度在0~1 mmol/L之间时,α-螺旋结构相对含量降低(P<0.05),β-折叠相对含量升高(P<0.05)。肌球蛋白受到氧化剂的攻击后,头部S1亚基展开,α-螺旋结构失去稳定,分子内氢键减少,多肽链上羰基(C=O)和氨基(N—H)与相邻肽链上的C=O和N—H之间形成分子间氢键,造成β-折叠相对含量升高。H2O2浓度在1~5 mmol/L之间时,α-螺旋结构与β-折叠结构相对含量均降低(P<0.05),此时蛋白结构进一步打开,分子内氢键继续减少,同时巯基氧化生成分子内二硫键,肽链结构发生回折,β-转角相对含量显著升高(P<0.05)。H2O2浓度在5~10 mmol/L之间时,α-螺旋结构与β-折叠结构相对含量升高(P<0.05),这是由于氧化剂诱导肌球蛋白分子通过二硫键发生LMM-LMM共价交联;H2O2浓度在10~20 mmol/L之间时,α-螺旋结构相对含量降低,但不显著(P>0.05),β-折叠结构相对含量降低(P<0.05),β-转角相对含量升高(P<0.05),说明LMM-LMM共价交联加剧,肽链结构发生回折。
Bourassa[29]、Ahmed-Ouameur[30]等分别研究了牛血清蛋白和人血清蛋白与多种药物小分子间相互作用,结果发现药物小分子的添加均可导致α-螺旋结构相对含量的降低,其原因是蛋白质的C=O、C—N和N—H基团与药物小分子间形成氢键相互作用[31-32]。因此,随着肌球蛋白结构的展开,α-螺旋结构相对含量降低,分子内氢键作用减小,分子间氢键作用增大。
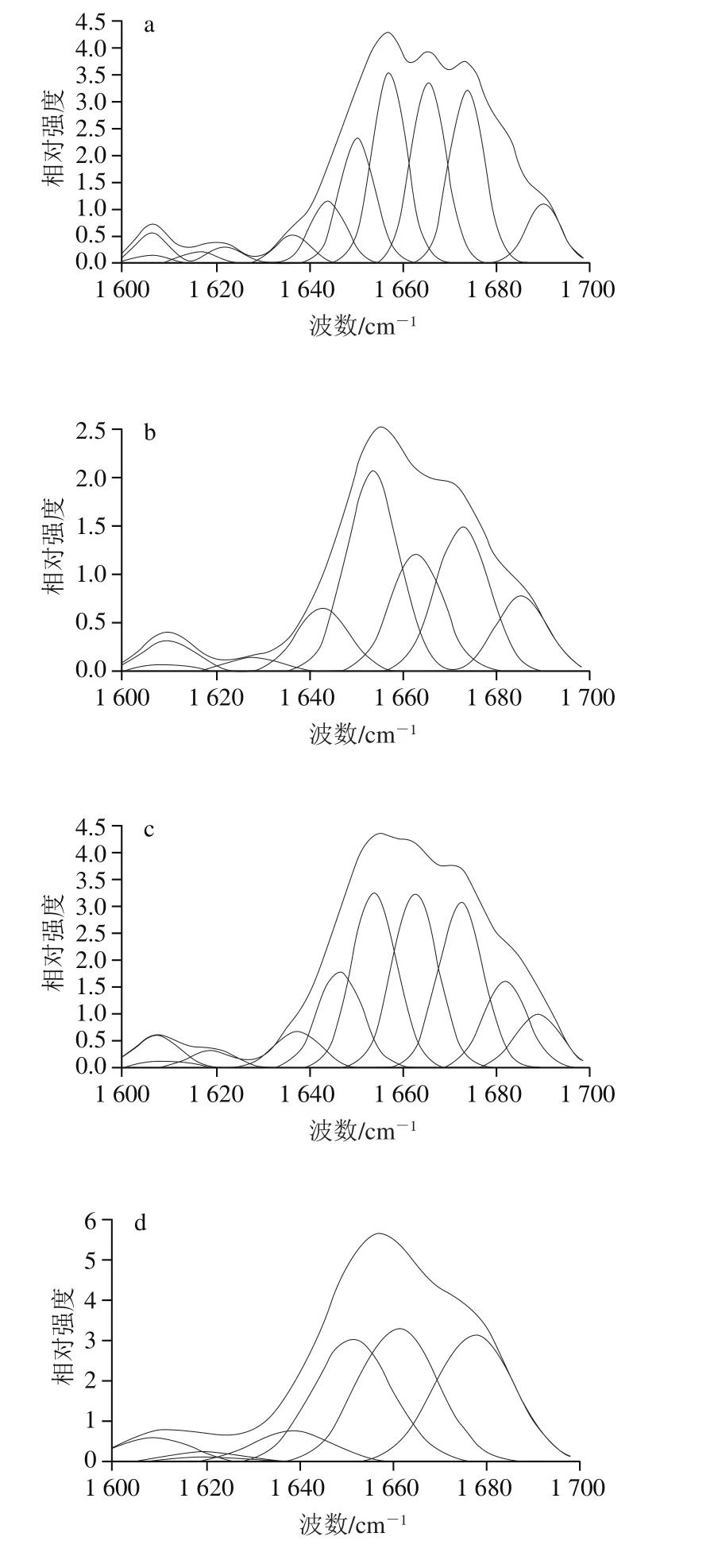
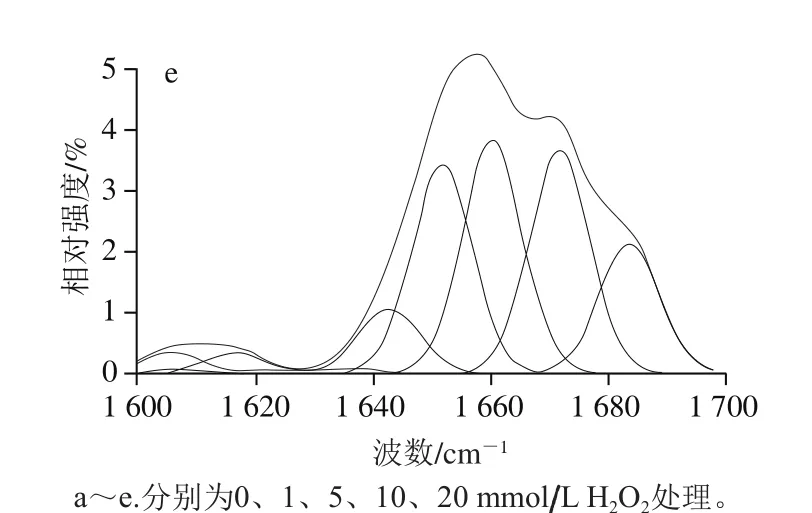
图2 肌球蛋白经H2O2处理后的拉曼光谱拟合图Fig. 2 Fitted Raman spectra of myosin treated with different concentrations of H2O2

表1 不同浓度H2O2处理的肌球蛋白二级结构的相对含量分析Table 1 Relative contents of secondary structures of myosin treated with different concentrations of H2O2 %
2.3 肌球蛋白表面疏水性分析

图3 H2O2处理浓度对肌球蛋白表面疏水性的影响Fig. 3 Surface hydrophobicity of myosin treated with different concentrations of H2O2
如图3所示,随着H2O2处理浓度的增加,肌球蛋白的表面疏水性整体呈上升趋势。在本研究中,H2O2浓度在0~5 mmol/L之间时,表面疏水性显著增加(P<0.05),这是由于肌球蛋白头部S1亚基在氧化过程中展开,内部疏水性氨基酸残基暴露,表面疏水性增加,与Chanarat等[33]研究结果一致;H2O2浓度在5~10 mmol/L之间时,表面疏水性继续增加,但不显著(P>0.05),此时蛋白质展开与聚集同时存在,蛋白质展开造成疏水性氨基酸残基暴露,而蛋白质聚集造成疏水性氨基酸残基掩埋;H2O2浓度在10~20 mmol/L之间时,表面疏水性显著增加(P<0.05),可能是由于强氧化条件下蛋白聚集部分屏蔽了蛋白展开的作用,蛋白聚集(主要是二硫键)导致的蛋白再折叠以及生成多聚物引起表面疏水性增加。
2.4 肌球蛋白的吸附作用分析
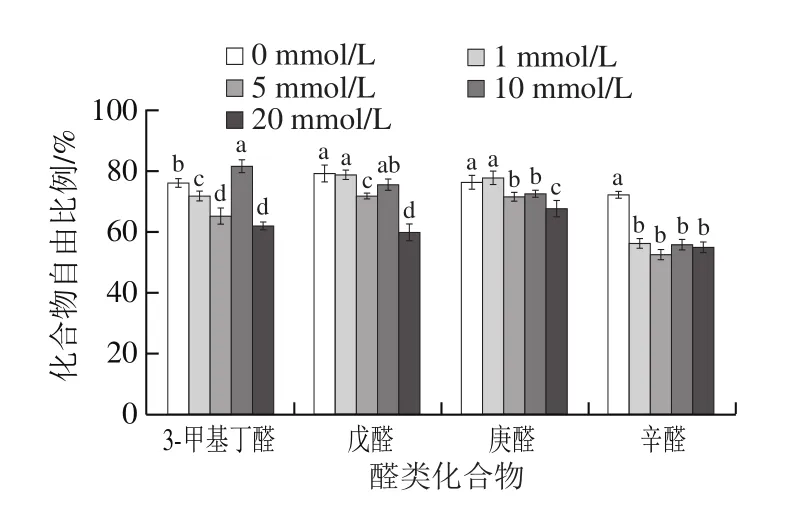
图4 H2O2处理浓度对肌球蛋白吸附性的影响Fig. 4 Effect of H2O2 concentration on binding capacity between myosin and aldehyde compounds
如图4所示,不同链长醛类化合物与未氧化处理蛋白吸附作用强度大小为:戊醛<庚醛<辛醛,随化合物疏水性(链长)的增加而增大,这与Weel[34]、Tan[35]等对β-乳球蛋白、牛血清蛋白与醛类化合物相互作用研究结果一致。相同碳原子数醛类化合物吸附作用强度大小为:戊醛<3-甲基丁醛,进一步证明随化合物疏水性(支链>直链)的增加,其与蛋白间相互作用增大。
Brewer等[36]指出,氢键作用和疏水相互作用是影响醛类吸附的主要作用。如图4所示,肌球蛋白(1 mg/mL)被羟自由基氧化后,以3-甲基丁醛为例,H2O2浓度在0~5 mmol/L之间时,分子间氢键作用随着α-螺旋的减少而持续增大,疏水相互作用也随着疏水基团的暴露而显著增大,从而造成蛋白对醛类化合物的吸附作用增强,化合物自由比例显著降低(P<0.05);H2O2浓度在5~10 mmol/L之间时,疏水相互作用无显著变化,但是分子间氢键作用随着α-螺旋的增加而减小,此时蛋白对醛类化合物的吸附作用随分子间氢键作用的减小而减弱,化合物自由比例显著升高(P<0.05);H2O2浓度 在10~20 mmol/L之间时,虽然α-螺旋相对含量变化不明显,但是深度氧化造成疏水基团暴露,以及蛋白交联形成疏水性空腔,从而使疏水相互作用继续增大,蛋白对醛类化合物的吸附作用增强,化合物自由比例显著降低(P<0.05)。其他醛类化合物与肌球蛋白吸附作用趋势与3-甲基丁醛类似,由于不同醛类化合物的物理化学性质略有不同,其自由比例各自不同。
由此可见,H2O2浓度在0~5 mmol/L之间时,肌球蛋白以展开为主,其与醛类化合物间相互作用主要为氢键作用和疏水相互作用;H2O2浓度在10~20 mmol/L之间时,肌球蛋白以交联聚集为主,其与醛类化合物间相互作用主要为疏水相互作用。
3 结 论
不同浓度H2O2氧化处理猪肌球蛋白,使氢键作用和表面疏水作用发生变化,改变了蛋白质构象,进而引起蛋白质对醛类化合物吸附能力的改变。低浓度H2O2处理条件下(0~5 mmol/L),肌球蛋白氧化以蛋白质展开为主,展开过程中α-螺旋失去稳定,分子内氢键转化为分子间氢键,氢键作用增大,疏水性氨基酸残基暴露,表面疏水性增加,疏水作用增大;高浓度H2O2处理条件下(10~20 mmol/L),蛋白以交联聚集为主,交联聚集过程中分子间二硫键大量生成,蛋白发生再折叠并生成多聚物,表面疏水性增加,疏水作用增大。肌球蛋白与醛类化合物间的作用力主要为氢键和疏水相互作用,氢键和(或)疏水相互作用越强,蛋白质对醛类化合物的吸附能力越强。

