甘露寡糖对泥鳅生产性能、肠道菌群和非特异性免疫功能的影响
杜宗君,苏 健,巫红萍,王雪力,邓 涛,曾丽雯,徐华明,武佳韵,温安祥*
(1.四川农业大学动物科技学院,成都611130;2.四川农业大学生命科学学院,四川 雅安625014)
泥鳅(Misgurnus anguillicaudatus)属温水性底栖小型鱼类,具有较好的食用和药用价值。国内外旺盛的市场需求,促进了泥鳅养殖业的快速发展。但泥鳅生长速度相对缓慢,苗种成活率低。高密度养殖引起的应激反应也导致鱼体抗病力下降。为防控病害,在水产养殖中普遍使用抗生素,由此产生的抗药性和药物残留等食品安全问题已引起人们的高度重视。研发绿色无毒、低成本的高效促生长剂或免疫增强剂,提高泥鳅的生长速度和成活率,减少抗生素的使用,已成为推动泥鳅养殖业健康发展的重要举措之一。
甘露寡糖(mannose oligosaccharides,MOS)是一种从酵母细胞壁中提取的磷酸化葡萄糖与甘露糖结合的复合物,具有无毒副作用、无污染残留、不产生耐药性且可部分替代抗生素等特点。已有研究表明,甘露寡糖可提高非洲鲶鱼[1]、鲤鱼[2-5]、大西洋鲑[6]、罗非鱼[7-8]、金头鲷[9]、黄颡鱼[10]、斑点叉尾鮰[11]、舌齿鲈[12]和草鱼[13]等鱼类的生产性能和抗病力[14]。但李富东[15]的相关研究中却发现甘露寡糖对牙鲆的生产性能、消化酶、血清溶菌酶活力和白细胞吞噬活性均没有显著影响。徐磊等[16]的研究表明甘露寡糖对异育银鲫的生产性能影响不明显,但能显著提高异育银鲫血清碱性磷酸酶活性、球蛋白浓度和总抗氧化能力,增强其对嗜水气单胞菌感染的免疫保护。迄今未见甘露寡糖对泥鳅生产性能和免疫功能的研究报道。本试验拟探索在饲料中添加甘露寡糖对泥鳅生产性能、肠道菌群和非特异性免疫功能的影响,以期为泥鳅健康养殖实践中科学利用甘露寡糖提供参考,同时为进一步探索甘露寡糖的作用机理提供基础资料。
1 材料和方法
1.1 试验材料
试验泥鳅购自四川省成都市双流县万福水产养殖场。将购回的鱼种用1.5% NaCl消毒10 min,饲养于四川农业大学生命科学学院动物实验室。试验所用基础饲料配方见表1。常规饲料原料购自四川农业大学动物营养所,预混料购自广州白云牧之林动物药厂。
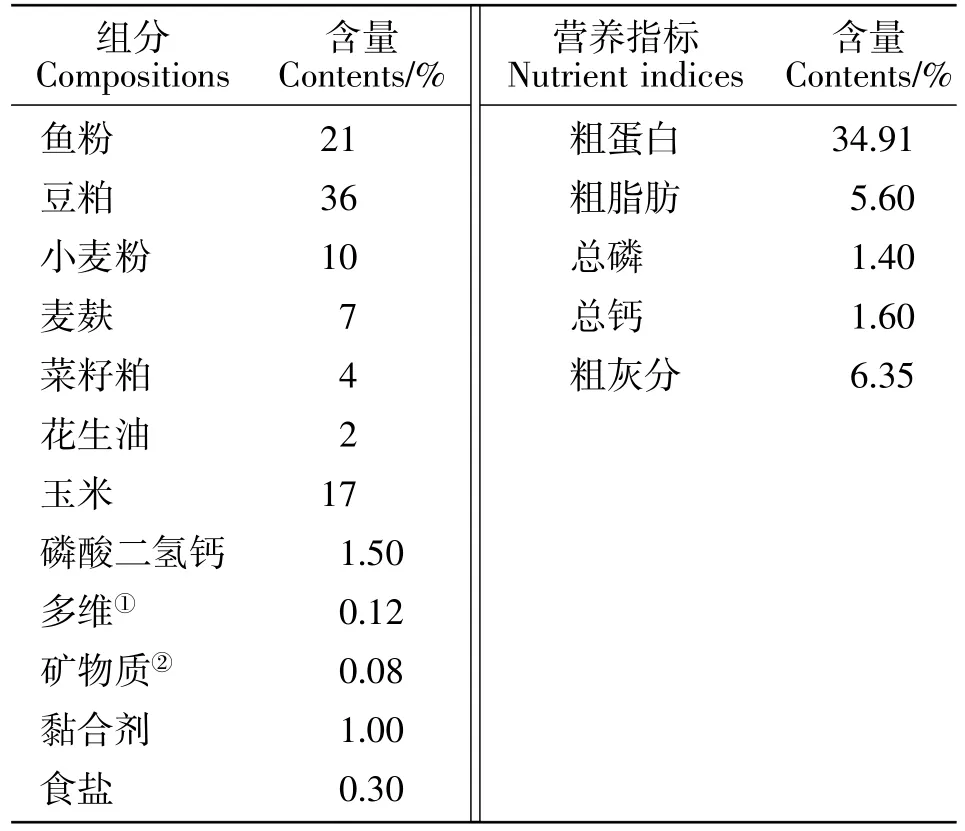
表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis)
1.2 试验设计
用基础饲料驯养14 d,选择初重为(3.27±0.05)g的健壮泥鳅360尾,随机分为6组,每组3个重复,每个重复20尾,置于60 cm×45 cm×45 cm的玻璃缸中饲养。在基础饲料中分别添加0、100、200、400、600和800 mg/kg甘露寡糖(四川成都禾日生物科技有限公司,饲料级,干基≥70%),配制成6种饲料。微量组分采用逐级扩大法加入基础饲料。用水将饲料揉和成团,每天按鱼体重的2%~3%定时(09:00、18:00)投喂。每次投喂前采用虹吸法清除残饵,并补充适量新水。试验期水深20 cm,水温为22~28℃,室内自然光照。试验期70 d。
1.3 样品采集
试验结束时禁食24 h,测定泥鳅的体长和体重;从每一重复中随机捞取10尾泥鳅,自尾静脉采血,0.5%肝素钠抗凝。将每2尾泥鳅的抗凝血等量混合,4℃下3 000 r/min离心10 min制备血浆。解剖并迅速分离肝胰脏,与预冷0.65% NaCl溶液按1∶9体积比混合,4℃下匀浆,将匀浆液3 000 r/min离心10 min,取上清液。测量肠道长度,称取肠道重量,收集肠道内容物。
1.4 测定指标与方法
1.4.1 生产性能测定
成活率(SR)=终末尾数/初始尾数×100%
特定生长率(SGR)=(ln终末体质量-ln初始体质量)/试验天数×100%
肥满度(CF)=体重/体长3×100%
饵料系数(FCR)=投食饲料总质量/(终末体质量-初始体质量)
肠体指数(IWI)=肠重/体重×100%
肠长指数(ILI)=肠长/体长×100%
1.4.2 肠道菌群检测
采用点种法检测肠道大肠埃希菌、乳酸杆菌和双歧杆菌[17]。将肠道内容物以灭菌生理盐水倍比稀释为10-1~10-6,然后用微量进样器分别取稀释液0.02 mL,滴入各种培养基,即大肠埃希菌用伊红-美蓝培养基(EMB),乳酸杆菌用MRS培养基,双歧杆菌MRS+X-gal培养基。每个重复做3个稀释度(大肠埃希菌选择10-3、10-4、10-5;乳酸杆菌选择10-4、10-5、10-6;双歧杆菌选择10-4、10-5、10-6),每个稀释度做3个平行。大肠埃希菌需氧培养24 h,乳酸杆菌、双歧杆菌厌氧培养72 h,分别计数大肠埃希菌、乳酸杆菌、双歧杆菌数量。菌群数量以每克肠道内容物所含细菌群落总数的对数[(lg CFU)/g]表示。
1.4.3 非特异性免疫指标测定
采用南京建成生物工程研究所生产的试剂盒检测溶菌酶(lysozyme,LZM)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等非特异性免疫指标。
1.5 数据处理
试验结果用“平均数±标准差”表示,采用SPSS 20.0软件进行数据分析和统计,先对数据作单因数方差分析(ANOVA),若组间差异显著,再用Ducans多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 甘露寡糖对泥鳅生产性能的影响
据表2所示,100~600 mg/kg组泥鳅的特定生长率显著高于对照组和800 mg/kg组(P<0.05);100~800 mg/kg组泥鳅的肥满度均显著高于对照组(P<0.05),其中200 mg/kg组最高;200和400 mg/kg组的饵料系数显著低于对照组、100、600和800 mg/kg组;各试验组泥鳅的成活率与对照组相比均有所提高,但差异不显著(P>0.05)。
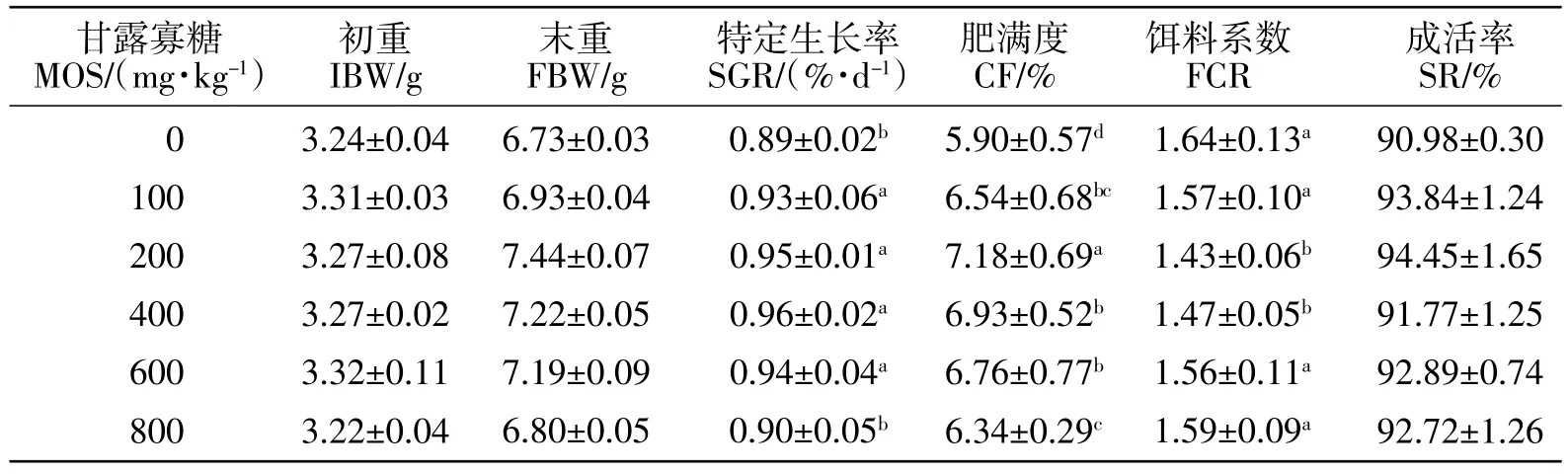
表2 甘露寡糖对泥鳅生产性能的影响Table 2 Effect of mannan-oligosaccharides on production performance of M.anguillicaudatus
2.2 甘露寡糖对泥鳅肠道发育和肠道主要菌群的影响
从表3可知,添加甘露寡糖的各试验组泥鳅的肠体指数和肠长指数均显著大于对照组(P<0.05),其中200 mg/kg组的肠体指数和肠长指数最大;200~800 mg/kg组大肠埃希菌数量显著低于对照组(P<0.05);各甘露寡糖组泥鳅的肠道乳酸杆菌、双歧杆菌数量均显著大于对照组(P<0.05),其中200~600 mg/kg组乳酸杆菌数量显著高于低添加剂量的100 mg/kg组和高添加剂量的800 mg/kg组(P<0.05),200~400 mg/kg组双歧杆菌数量显著高于低添加剂量的100 mg/kg组和高添加剂量的600 mg/kg组、800 mg/kg组(P<0.05)。
2.3 甘露寡糖对泥鳅非特异性免疫的影响
添加甘露寡糖对泥鳅血浆和肝胰脏SOD、CAT及LZM等非特异性免疫指标的影响见表4。肝胰脏和血浆SOD、CAT活性,以及血浆LZM含量均随甘露寡糖添加量地增加而提高,添加200 mg/kg或400 mg/kg时达到最高水平。200 mg/kg组、400 mg/kg组血浆和肝胰脏SOD、CAT活力较对照组显著提高(P<0.05)。各甘露寡糖组血浆LZM含量均显著高于对照组(P<0.05)。
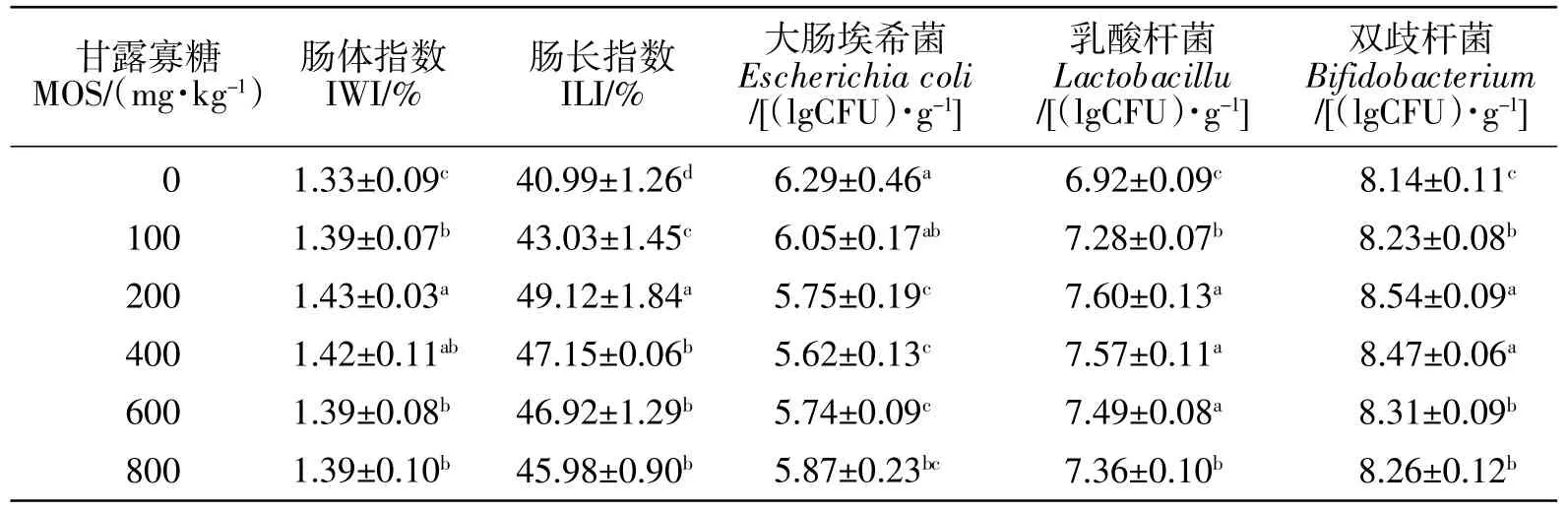
表3 甘露寡糖对泥鳅肠道发育和肠道主要菌群的影响Table 3 Effects of mannan-oligosaccharides on intestinal development and intestinal microflora in M.anguillicaudatus
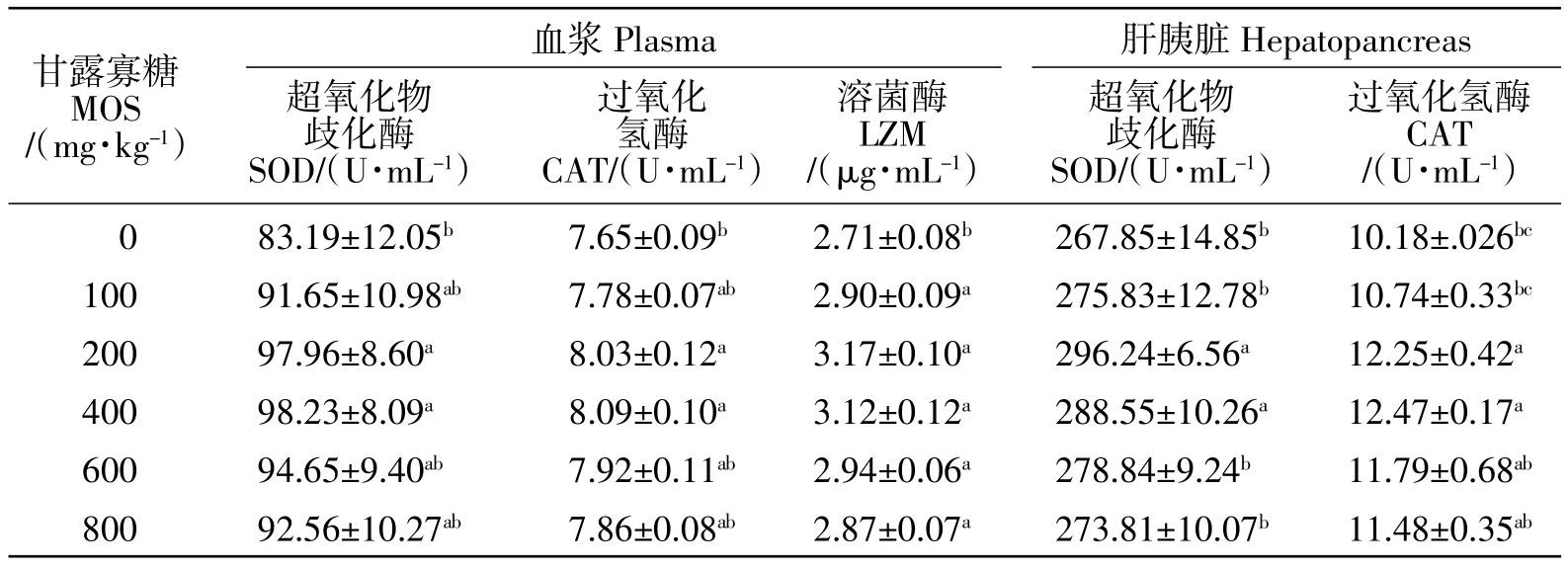
表4 甘露寡糖对泥鳅血浆和肝胰脏SOD、CAT及LZM的影响Table 4 Effects of mannan-oligosaccharides on SOD,CAT and LZM in plasma and hepatopancreas of M.anguillicaudatus
3 讨论
3.1 甘露寡糖对泥鳅生产性能和肠道菌群的影响
自T.Yoshida等[1]率先报道甘露寡糖能显著提高大西洋鲑抗病力以来,有关甘露寡糖对鱼类生长性能和肠道菌群影响的研究也陆续开展。李云兰[2]、李洋[5]等添加甘露寡糖显著提高幼建鲤的增重率、降低饵料系数,显著提高肠道重量与长度、肠道乳酸杆菌与双歧杆菌数量,降低大肠埃希菌数量。还有众多研究表明,在饲料中添加甘露寡糖对试验动物的促增重效果明显[4,7,11,13],促进肠道乳酸杆菌增殖并抑制大肠埃希菌定植[8],提高前、后肠皱襞高度和小肠绒毛密度、宽度与高度[5,7]。这些研究表明,甘露寡糖的促生长作用可能与其显著促进肠道发育,改善肠道微生态环境有关。
本试验在饲料中添加200、400 mg/kg甘露寡糖,显著提高了泥鳅的特定生长率和肥满度,降低了饵料系数;显著提高了泥鳅的肠体指数、肠长指数;显著促进了肠道乳酸杆菌和双歧杆菌的增殖,对大肠埃希菌有极显著的抑制作用。表明在泥鳅饲料中添加200~400 mg/kg甘露寡糖,可促进泥鳅肠道发育,优化肠道微生态环境,从而促进其生长。本试验结果与前述李云兰[2]的研究结论一致。但李富东[15]、徐磊等[16]发现甘露寡糖对牙鲆和异育银鲫的增重率和饵料系数等均没有显著影响。
甘露寡糖影响肠道菌群的作用机理已比较清楚[18]。从结构上看,甘露寡糖1,4糖苷键极少,因此不易被鱼类消化吸收,直接进入鱼类后肠作为乳酸杆菌和双歧杆菌等有益菌群的特异性营养基质,促进有益菌群增殖,而有益菌群的代谢产物能通过降低肠道pH或者通过在空间、营养上的竞争性屏蔽作用来抑制有害菌在肠道上的定植和生长,保证消化道菌群的平衡。对甘露寡糖促生长效应的研究结果尚不一致,还不清楚是否因鱼的种类、添加甘露寡糖的时期(鱼类生长阶段)、添加剂量和连续饲喂甘露寡糖的时间等因素所致。总之,甘露寡糖的促生长机理还有待于进一步深入研究。
3.2 甘露寡糖对泥鳅非特异性免疫功能的影响
已有研究表明,在饲料中添加适量甘露寡糖,能提高试验动物脾脏指数[4]、白细胞吞噬活性[4-5,10]、血清总蛋白含量[13]、球蛋白浓度[16]、血清溶血素活力和血清杀菌百分率[4],增强血清溶菌酶[2,10]、碱性磷酸酶[7,13,16]、超氧化物歧化酶[7]活性和总抗氧化力[7],增强鱼类的非特异性免疫功能,提高其成活率[2,11,16]。
本研究显示,添加200或400 mg/kg甘露寡糖,显著提高了肝胰脏和血浆SOD、CAT活性及血浆LZM含量,表明添加适量甘露寡糖(200~400 mg/kg)可增强泥鳅的非特异性免疫功能。与前述李云兰等的研究结论一致。但李富东[15]试验发现添加甘露寡糖对牙鲆血清溶菌酶活力和白细胞吞噬活性均无显著影响。推测长时间饲喂甘露寡糖可能对试验动物产生了免疫抑制。

