固醇类物质对鹅颗粒细胞胆固醇转运相关基因表达的影响
荣玉静,夏 露,胡深强,王继文
(四川农业大学动物科技学院,成都611130)
禽类卵巢中卵泡数量众多,根据发育阶段和功能不同形成了严格的等级体系。产蛋期家禽卵泡按排卵顺序可分为等级卵泡和等级前卵泡,其中等级卵泡按大小和排卵顺序分为F1、F2、F3、F4、F5[1],F1最接近排卵。颗粒细胞在卵泡发育过程中发挥重要作用,广泛参与营养摄入[2],卵泡膜细胞分化[3]和类固醇激素生成[4]。类固醇激素是卵母细胞和颗粒细胞存活或凋亡的重要调控因子,和家禽繁殖性能相关的类固醇激素主要有孕激素、雌激素和雄激素。对卵巢起调控作用的主要孕激素是孕酮,当卵泡发育接近成熟时,颗粒细胞分泌大量孕酮促进排卵[5]。睾酮属于雄激素,是雌二醇合成的必须底物,而雌二醇是家禽卵巢中生物活性最强的雌激素,可促进卵泡及卵母细胞发育成熟。
外部环境和禽体内分泌的刺激使下丘脑分泌促性腺激素释放激素(GnRH),GnRH促进垂体分泌卵泡刺激素(FSH)和促黄体生成素(LH)作用于卵巢和卵泡上相应受体,启动细胞内类固醇激素的合成,此过程由多个基因共同参与。胆固醇是类固醇激素合成的前体物质,它在细胞内的分布情况对胆固醇稳态以及类固醇激素的合成非常重要。固醇调节元件结合蛋白(sterol regulatory element-binding protein,SREBPs)属于膜结合转录因子家族,成员SREBP-2主要调控胆固醇合成,是维持胆固醇平衡必需基因[6],其活性主要受细胞固醇含量调控。类固醇激素急性调节脂质转运结构域4(START domain containing 4,STARD4)属于START家族,主要受胆固醇和SREBP-2特异性调控[7]。STARD4与胆固醇在细胞内的跨细胞质转运有关,在将胆固醇递送至内质网的过程中发挥重要作用[8]。类固醇激素合成急性蛋白(steroidogenic acute regulatory protein,STAR)位于线粒体膜,是胆固醇从线粒体外膜转运到内膜的限速酶,随后胆固醇侧链裂解酶(cholesterol side-chain cleavageenzyme,CYP11A1)将内膜上的胆固醇转化为孕烯醇酮,作为合成孕酮的底物。
作为调控机体胆固醇转运与类固醇激素合成的关键基因,SREBP-2、STADR4、STAR和CYP11A1在鹅卵泡发育过程中的作用及其调控机制尚不清楚。因此,本研究选取四川白鹅为研究对象,分析四个基因在鹅卵泡发育过程中的表达模式和不同固醇类物质对其转录水平的调控,以期为揭示鹅卵泡发育机制和提高产蛋量提供理论参考。
1 材料和方法
1.1 样品采集
实验动物来自四川农业大学家禽育种场。挑选4只同期孵化,相同饲养环境并处于产蛋高峰期的天府肉鹅母系母鹅。放血法处死后迅速取出卵巢,按以下标准分离出各个发育阶段卵泡:等级卵泡F1、F2、F3、F4、F5;等级前卵泡(10 mm以下)按每1 mm为一个等级(即9~10 mm、8~9 mm、7~8 mm、6~7 mm、5~6 mm、4~5 mm、3~4 mm、2~3 mm、<2 mm);闭锁卵泡(AF);排卵后卵泡(POF)。卵泡样品经液氮速冻后转移至-80℃冰箱保存,用于RNA提取。本研究中实验动物使用程序按照四川农业大学动物护理与使用指南进行。
1.2 颗粒细胞分离培养
选择符合1.1条件的母鹅,取出卵巢后按照本课题组的方法[9]分离并培养F1卵泡颗粒细胞,将细胞分别接种至96孔和6孔细胞培养板,分别用于细胞活性检测和RNA提取,然后将细胞放入37℃,5%CO2培养箱中培养。
1.3 细胞处理
分别将5 mg胆固醇(Sigma)、10 mg 25-羟胆固醇(Sigma)和10 mg洛伐他汀(Sigma)粉末溶于1 mL DMSO(Omega)配置母液。待细胞培养24 h,用无血清的DMEM/F12培养基饥饿4 h,然后换为含不同浓度胆固醇(5、10、15、20μg/mL)、25-羟胆固醇(1、5、10μg/mL)和洛伐他汀(0.1、1、10μg/mL)[10-12]的无血清DMEM/F12培养基处理细胞,另设不加任何处理的空白对照组。放入37℃,5% CO2培养箱中培养24 h。
1.4 细胞活性检测
取出96孔培养板,吸去培养基,加入25μL MTT(2 mg/mL,Omega)和75μL PBS后重新放入培养箱孵育。4 h后吸出PBS和MTT,每孔加入150μL DMSO,轻微震荡10 min;490 nm处检测吸光值。设不加细胞的空白对照孔,其他步骤一致,检测时用空白对照孔校准。
1.5 RNA提取与反转录
取出6孔培养板,吸去培养基,PBS清洗一次。用Trizol(Invitrogen,USA)裂解细胞,按Trizol试剂标准操作提取总RNA。提取的总RNA经琼脂糖凝胶电泳检测质量合格后,按照PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)说明书合成cDNA。
1.6 目的基因相对表达量检测
采用qPCR技术检测目的基因mRNA表达量,根据PrimeScriptTMreagent KIT Perfect Real Time试剂盒(TaKaRa)说明书操作。反应体系为25μL,其中SYBR Premix ExTaqTM(2x)12.5μL,上下游引物各0.5μL,cDNA模板2μL,Rnase Free H2O 9.5μL。PCR程序:95℃30 s;95℃0.5 s,60℃30 s,45个循环。每个样品3个重复,相关引物参数见表1。

表1 本研究中所用引物序列Table 1 Sequences of primer used in this study
1.7 数据统计分析
利用2-△△Ct法计算基因相对表达量[13],细胞活性及基因相对表达量结果使用SPSS Statistics 22(IBM,USA)软件进行单因素方差分析确定显著性(P<0.05),使用Excel 2010软件绘图。
2 结果与分析
2.1 胆固醇转运相关基因在鹅不同发育阶段卵泡中的表达模式
胆固醇转运与类固醇激素合成相关基因在鹅不同发育阶段卵泡中的相对表达量见图1。分析发现四个基因在各个发育阶段卵泡中均有表达。随着卵泡发育,4个基因的表达量在等级前阶段先上升后下降,等级阶段逐渐上升,均在排卵前(F1~F2)和直径3~4 mm卵泡中有较高表达量,整体表达模式基本一致。除CYP11A1外,其他3个基因均在F1阶段表达量最高;4个基因在POF阶段的表达量均低于AF阶段,其中STAR和CYP11A1在POF和AF阶段的表达量显著低于其他发育阶段(P<0.05)。
2.2 不同浓度胆固醇、25-羟胆固醇和洛伐他汀对鹅颗粒细胞活性的影响
MTT法检测不同固醇类物质处理鹅F1卵泡颗粒细胞后的细胞活性结果见图2。随着胆固醇处理浓度的增加,颗粒细胞活性逐渐增加,呈现剂量依赖性,在20μg/mL浓度时,细胞活性显著增加(P<0.01);与对照组相比,添加25-羟胆固醇能在一定程度上抑制颗粒细胞活性,5μg/mL浓度时差异显著(P=0.011);各个浓度洛伐他汀均能显著降低颗粒细胞活性(P<0.05),但不同处理浓度之间没有显著差异(P>0.05)。
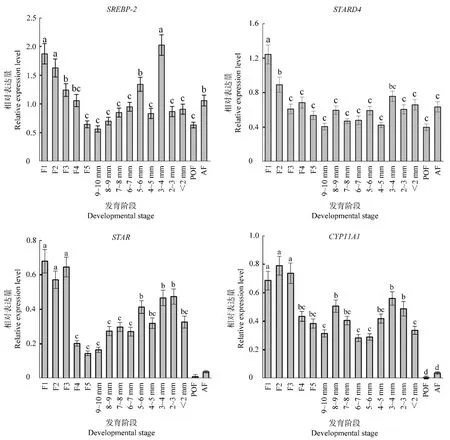
图1 鹅不同发育阶段卵泡中SREBP-2、STARD4、STAR和CYP11A1基因的表达模式Figure 1 Expression patterns of SREBP-2,STARD4,STAR and CYP11A1 genes ingeese follicles at different developmental stages
2.3 胆固醇对鹅颗粒细胞SREBP-2、STARD4、STAR和CYP11A1基因表达量的影响
不同浓度胆固醇处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量见图3。随着胆固醇处理浓度的增加,4个基因的表达量均表现出先上升后下降的变化趋势,20μg/mL浓度时表达量最低。SREBP-2在15μg/mL浓度时表达量与10μg/mL浓度时相比显著下降(P<0.001),但其他3个基因在这两个处理浓度间没有显著差异(P>0.05)。
2.4 25-羟胆固醇对鹅颗粒细胞SREBP-2、STARD4、STAR和CYP11A1基因表达量的影响
不同浓度25-羟胆固醇处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量见图4。4个基因mRNA水平在25-羟胆固醇影响下有不同的变化趋势。随着处理浓度的增加,SREBP-2表达量逐渐降低,且差异显著(P<0.05),表现出剂量依赖性;低浓度25-羟胆固醇对STARD4表达量没有影响(P>0.05),而10μg/mL时STARD4表达量显著升高(P<0.01);添加25-羟胆固醇能显著降低STAR表达量(P<0.001),但不同浓度之间没有显著差异(P>0.05);与对照组相比,低浓度25-羟胆固醇处理能显著降低CYP11A1的表达量(P<0.05),但浓度增加至10μg/mL时,CYP11A1表达量升高,且与对照组没有显著差异(P>0.05)。
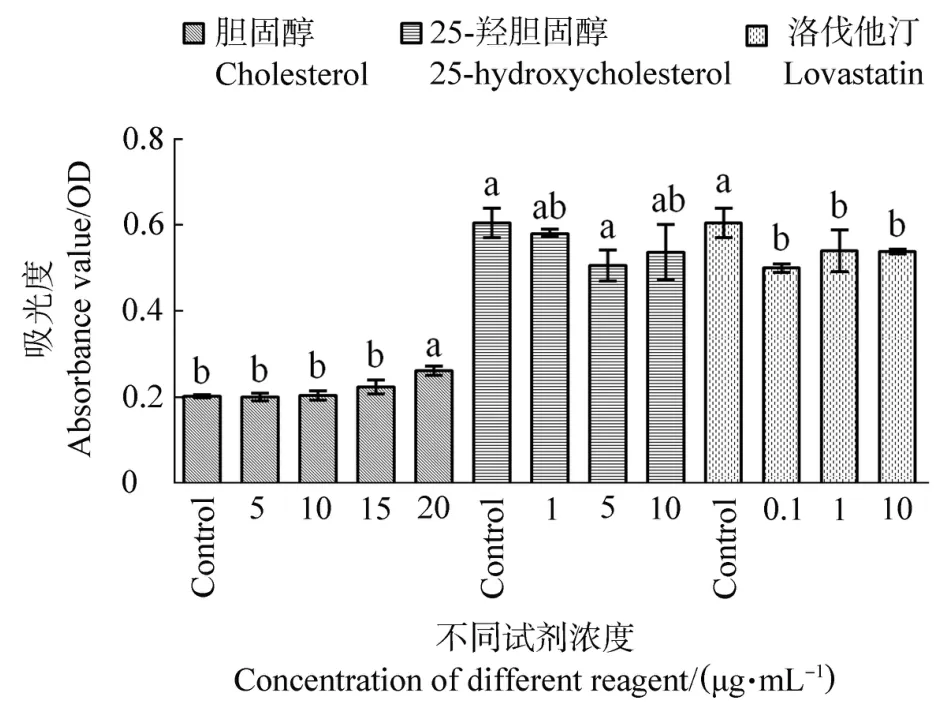
图2 不同浓度胆固醇、25-羟胆固醇和洛伐他汀处理后鹅F1卵泡颗粒细胞活性Figure 2 Goose F1 granulosa cells activity treated with different concentration scholes terol,25-hydroxycholesterol or lovastatin

图3 不同浓度胆固醇处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量Figure 3 The expression of SREBP-2,STADR4,STAR and CYP11A1 in goose F1 granulosa cells treated with different concentrations of cholesterol
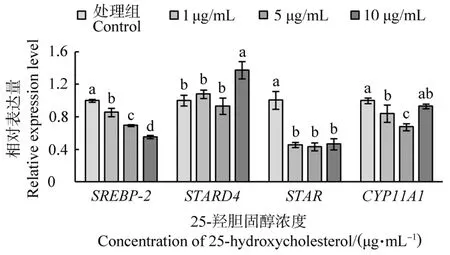
图4 不同浓度25-羟胆固醇处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量Figure 4 The expression of SREBP-2,STADR4,STAR and CYP11A1 in goose F1 granulosa cells treated with different concentrations of 25-hydroxycholesterol
2.5 洛伐他汀对鹅颗粒细胞SREBP-2、STARD4、STAR和CYP11A1基因表达量的影响
不同浓度洛伐他汀处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量见图5。随着处理浓度升高,SREBP-2表达量先降低后升高,而其余3个基因均表现出先升高后降低的趋势,与SREBP-2相反。与其余两个处理浓度相比,1μg/mL洛伐他汀处理细胞后,SREBP-2表达量显著下降(P<0.05),而STARD4、STAR和CYP11A1表达量显著升高(P<0.05)。
3 讨论
本实验检测了SREBP-2、STARD4、STAR和CYP11A1基因在鹅不同发育阶段卵泡中的表达情况,分析发现4个基因表达趋势相似,均在等级阶段表达量逐渐上升,到F1~F2时达到顶峰。在禽类等级卵泡中,促性腺激素主要刺激颗粒细胞分泌孕酮以促进排卵。研究表明,鸡等级卵泡中颗粒细胞合成孕酮的能力随着卵泡逐渐成熟而增强,发育到F1卵泡时达到顶峰[14],在鹅上也有相似的报道[15]。STARD4是SREBP-2的靶基因[7],实验结果发现STARD4和SREBP-2在鹅卵泡的不同发育阶段表达模式基本一致,并和卵泡类固醇激素合成规律相同,表明二者在类固醇激素合成过程中可能通过参与胆固醇转运发挥作用。接近排卵阶段的卵泡颗粒细胞中促黄体生成素受体(LHR)表达量增加,因此LH介导的孕酮生成增加,这个过程就伴随着STAR表达量增加[16-17],另外此时CYP11A1主要在颗粒细胞表达,随后可以诱导LH峰出现和排卵[18-20]。综上,本研究后续实验选择鹅F1阶段卵泡的颗粒细胞为实验材料,初步探讨不同固醇类物质对上述4个基因的影响。
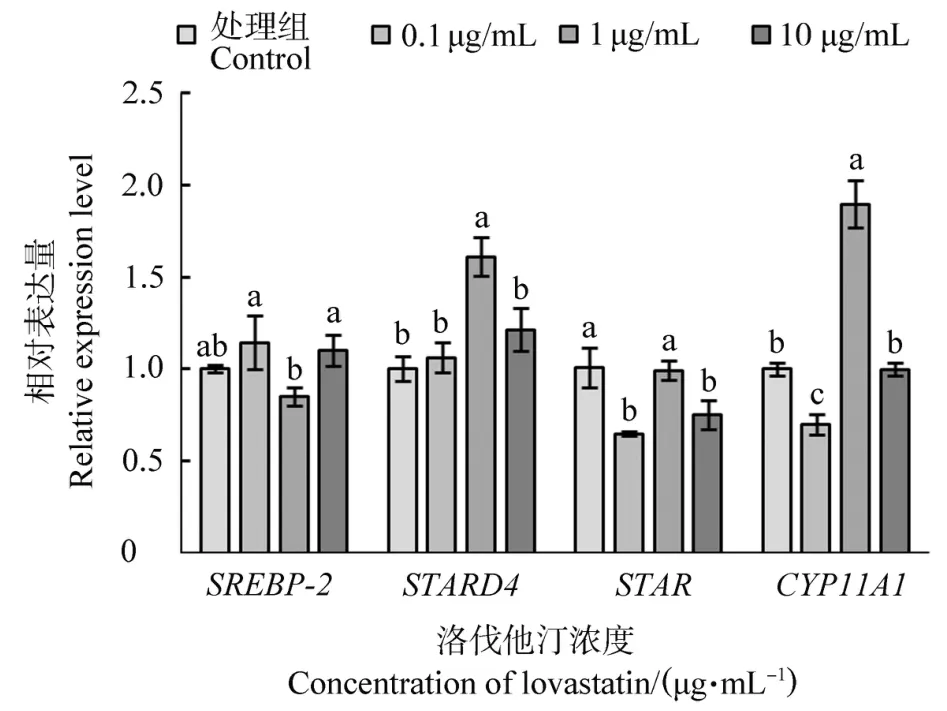
图5 不同浓度洛伐他汀处理鹅F1卵泡颗粒细胞后SREBP-2、STARD4、STAR和CYP11A1基因的表达量Figure 5 The expression of SREBP-2,STARD4,STAR and CYP11A1 in goose F1 granulosa cells treated with different concentrations of lovastatin
细胞实验结果显示,不同浓度胆固醇处理颗粒细胞后,4个基因表达量随着胆固醇浓度增加都表现出先上升后下降的趋势,且SREBP-2在15μg/mL时表达量已显著下降,其他3个基因则没有。在饲喂高胆固醇饮食的小鼠肝脏中检测到STADR4表达量降低超过2倍,并与SREBP-2表现出协调调节[21]。Ning Y.[22]等发现,胆固醇能增加小鼠脑微血管内皮细胞中STAR表达量,并存在剂量效应。推测当细胞内胆固醇浓度升高时,STADR4表达量增加,促进细胞内胆固醇代谢平衡;同时STAR从线粒体外膜转运进内膜的胆固醇增加,引起CYP11A1表达量上升。而当胆固醇浓度过高时,抑制SREBP-2和STADR4表达,进一步降低STAR和CYP11A1表达量,此时可能通过刺激细胞内胆固醇代谢增加了细胞活性。此外,SREBP-2对胆固醇浓度可能更敏感,这有助于它及时通过调节STADR4表达确保内质网对细胞器(包括质膜)胆固醇丰度的敏感性,从而保证细胞内胆固醇水平的稳定[8]。25-羟胆固醇是胆固醇氧化产物,它可以通过抑制SREBP-2裂解来抑制其下游基因转录激活,最终降低细胞内胆固醇合成[23]。25-羟胆固醇还可以激活胆固醇酯化,此时细胞内胆固醇转运蛋白STADR4的表达量会有所上升,这与本实验结果相符。羟甲基戊二酸单酰辅酶A还原酶(HMGCR)是合成胆固醇的限速酶,洛伐他汀是一种HMGCR竞争性抑制剂,可以抑制细胞内胆固醇合成[24]。洛伐他汀处理小鼠巨噬细胞源性泡沫细胞,可明显减少细胞内总胆固醇和胆固醇酯含量[25]。实验结果表明,不同浓度洛伐他汀处理后STARD4、STAR和CYP11A1表达趋势相似,推测洛伐他汀通过影响胞内STARD4来调节胆固醇平衡,从而影响STAR和CYP11A1表达量。25-羟胆固醇和洛伐他汀都能降低细胞内胆固醇含量,但其作用方式不同,可能因此对相关基因的影响也不同。另外,二者都可以诱导细胞凋亡[26-27],从本实验结果来看,洛伐他汀对颗粒细胞活性的抑制效应强于25-羟胆固醇。
4 结论
SREBP-2、STARD4、STAR和CYP11A1基因在鹅产蛋期不同发育阶段卵泡中表达模式基本一致;高浓度胆固醇能增加鹅F1卵泡颗粒细胞活性,25-羟胆固醇和洛伐他汀与之相反;不同固醇类物质通过不同方式影响细胞内胆固醇水平,从而可能对胆固醇转运和类固醇合成相关基因产生不同影响。本实验结果可以为进一步揭示鹅卵泡发育机制和提高产蛋量提供理论参考。

