荷叶总生物碱激活肝脏AMPK/Nrf2通路缓解对乙酰氨基酚诱导的小鼠急性肝损伤
舒广文,邱韵涵,李 薇,付 千,谌业珺,邓旭坤
中南民族大学药学院 民族药学国家级实验教学示范中心,武汉 430074
对乙酰氨基酚(Acetaminophen,APAP)是一种广泛使用的解热镇痛药[1]。但是,在摄入过量时,APAP可诱发肝脏氧化应激,从而引起严重的肝损伤,并可进一步恶化为致命的肝衰竭[2]。目前,临床上主要采取抗氧化剂N-乙酰半胱氨酸来应对APAP诱导的肝损伤。但是,其治疗效果并不十分令人满意[3]。因此,寻找潜在的能够缓解APAP所致肝损伤的新药具有十分重要的意义。
Nrf2(NF-E2-related factor-2)是一个广泛表达于高等动物各个组织内的转录因子,它可与其下游基因启动子区域内的特定顺式作用原件——抗氧化反应元件(antioxidant response element,ARE)直接结合并启动基因的转录[4]。对Nrf2蛋白亚细胞定位的调节是Nrf2通路活性调控的经典方式。在细胞不受任何刺激的状态下,Nrf2蛋白将与其抑制因子Keap1蛋白结合而定位于细胞质基质中[5]。这时,Nrf2不能发挥其转录激活作用。当细胞内发生氧化应激时,Keap1的构象发生改变。这时,Keap1与Nrf2的结合能力降低,Nrf2可从Keap1上释放出来,进入细胞核并启动其下游基因的转录[6]。典型的受Nrf2控制的下游基因包括血红素加氧酶1(heme oxygenase-1,HO-1)和谷氨酸半胱氨酸连接酶催化亚基(catalytic subunit of glutamate cysteine ligase,GCLC)等抗氧化酶的编码基因。这些基因的表达产物能够对抗环境中或者内源性的各种毒性物质诱导的细胞内氧化应激。研究表明,增强 Nrf2 通路活性可明显缓解APAP诱导的肝损伤[7]。因此,靶向性激活Nrf2通路可作为干预APAP所致肝损伤的潜在策略。
很多植物来源的天然产物对毒物诱导的肝损伤都有较好的干预作用[8,9]。荷叶是睡莲科植物莲的干燥叶,含黄酮、生物碱、皂苷等多种化学成分,药理活性广泛[10]。研究表明,荷叶中的生物碱类化合物具有良好的抗氧化作用[11]。然而,目前尚不清楚荷叶总生物碱(total alkaloids from lotus leaves,TAL)是否可以缓解APAP所致的急性肝损伤。因此,本实验探讨了TAL对APAP所致小鼠急性肝损伤的保护作用和可能的分子机制。
1 材料与方法
1.1 材料
动物:雄性8周龄昆明小鼠,体重20~25 g,由湖北省实验动物研究中心提供。实验动物生产许可证号:SCXX(鄂)2015-0018。
主要试剂与试剂盒:APAP(批号B19M8E36136,质量分数>98%),购自上海源叶生物科技有限公司;识别NF-E2-related factor-2(Nrf2)、Lamin B、heme oxygenase-1(HO-1)、catalytic subunit of glutamate-cysteine ligase(GCLC)和β-actin蛋白的一抗和酶标二抗购自武汉三鹰生物技术有限公司;识别AMPKα(α subunit of AMP-activated protein kinase)和172位苏氨酸磷酸化的AMPKα的一抗购自碧云天生物技术有限公司。ALT、AST、MDA、GSH、SOD、CAT、GSH-Px试剂盒购自南京建成生物工程研究所;TNF-α、IL-1β和IL-6 的ELISA检测试剂盒购自南京建成生物技术研究所。细胞核提取试剂盒购自北京索莱宝科技有限公司。
主要仪器:THERMO Multiskan GO酶标仪,美国Thermo Scientific公司;7300荧光定量PCR仪,美国ABI公司。
1.2 实验方法
1.2.1 TAL的制备
TAL的制备参照已有文献[12]。取干燥的荷叶(100 g),粉碎过筛,以30倍体积的0.2% HCl为溶剂进行提取,提取3次,每次持续3 h。合并提取液,过滤,将滤液浓缩至一定体积后过D001阳离子交换树脂柱。然后,先以5倍柱体积的纯化水洗涤去除杂质,再以含1%氨水的95%乙醇溶液洗脱。将洗脱液浓缩蒸干,即得TAL(0.92 g)。
1.2.2 动物分组与造模
在参考过相关文献[13,14]并进行预实验之后,我们选择30和100 mg/kg作为TAL的给药剂量来开展本文的研究。40只雄性昆明小鼠随机分为4组,即正常组、模型组、TAL低剂量组(30 mg/kg)和TAL高剂量组(100 mg/kg),每组10只。灌胃给药每日1次,持续7日。末次给药2 h后,腹腔注射APAP(300 mg/kg)制备急性肝损伤模型[15],12 h后,开始后续实验。
1.2.3 样本制备与相关生理生化指标测定
麻醉小鼠,取血,分离血清,检测血清中ALT和AST水平。脱颈椎处死小鼠,剖取肝脏,取小鼠肝右叶组织置于10%缓冲福尔马林中保存,进行苏木素-伊红染色,观察肝脏组织病理变化。另取一部分肝组织按1∶9比例加入冰生理盐水,匀浆、离心,制备肝匀浆,检测肝组织中MDA、GSH含量以及抗氧化酶SOD、CAT、GSH-Px活力,ELISA法检测肝组织中TNF-α、IL-1β、IL-6的含量。所有实验操作均按照试剂盒说明书进行。
1.2.4 肝脏细胞核抽提物的制备
按照试剂盒说明书规定的实验步骤操作,制备小鼠肝脏组织细胞核的抽提物。
1.2.5 免疫印迹
首先,用SDS-PAGE电泳法分离蛋白质样本(每泳道上样25 μg蛋白)。电泳结束后,将胶中的蛋白转印到PVDF膜上。然后,用5%脱脂奶粉封闭膜。将膜依次与相应的一抗(1∶1 000稀释)和酶标二抗(1∶1 000稀释)孵育。最后,用ECL化学发光底物进行发光显影,用Image J软件对所得图像进行蛋白质条带的半定量分析。
1.2.6 定量PCR
用Trizol提取肝脏组织RNA。取5 μg总RNA,用cDNA第一链合成试剂盒将RNA反转录成为cDNA。以GAPDH基因为内参,用荧光定量PCR对HO-1和GCLC的转录水平进行量化分析。引物序列如下(5′至3′)。小鼠HO-1(正向):AGG TAC ACA TCC AAG CCG AGA;小鼠HO-1(反向):CAG TGA GGC CCA TAC CAG AAG。小鼠GCLC(正向):CTA CCA CGC AGT CAA GGA CC;小鼠GCLC(反向):CCT CCA TTC AGT AAC AAC TGG AC。小鼠GAPDH(正向):AGG TCG GTG TGA ACG GAT TTG;小鼠GAPDH(反向):CTT CCC ATT CTC GGC CTT G。
PCR反应结束后,以GAPDH(glyceraldehyde-3-phosphate dehydrogenase,三磷酸甘油醛脱氢酶)为内参,计算各个基因的相对表达水平[16]。
1.3 统计学分析
所有实验数据均以平均数±标准差表示。采用软件SPSS对实验数据进行统计分析,当P< 0.05时,可认为差异具有统计学意义。
2 结果与分析
2.1 TAL对APAP肝损伤小鼠肝脏指数及血清ALT、AST水平的影响
与正常组相比,模型组小鼠出现肝脏肿大,肝脏指数显著上升(P< 0.01)。给予不同剂量的TAL后,肝脏指数均显著降低(P< 0.05或P< 0.01)。模型组小鼠血清中ALT和AST水平明显高于正常组(P< 0.01)。TAL剂量依赖性地降低了肝损伤小鼠血清中的ALT和AST水平(P< 0.01)。

表1 TAL对小鼠肝脏指数及血清中ALT、AST水平的影响(n = 10,±s)
注:与正常组比较,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note:Compared with normal group,##P< 0.01;Compared with model group,*P< 0.05,**P< 0.01.
2.2 TAL对APAP肝损伤小鼠肝组织病理变化的影响
如图1所示,与正常组相比,模型组小鼠的肝脏可见明显组织病理学变化,包括组织细胞排列不整齐,部分肝细胞细胞核缺失,组织内出血以及炎性细胞浸润。TAL有效地缓解了APAP诱导的这些组织病理学变化。

图1 TAL对小鼠肝组织形态学的影响(400×)Fig.1 Effects of TAL on the morphology of mouse liver tissues (400×)
2.3 TAL对APAP肝损伤小鼠肝组织中MDA与GSH含量的影响
如下表所示,模型组小鼠肝组织中MDA含量较正常组有明显升高(P< 0.01)。经TAL处理后,小鼠肝组织中MDA含量显著下降(P< 0.01)。与正常组相比,模型组小鼠肝组织中GSH含量显著降低(P< 0.01)。TAL低、高剂量组GSH含量则有显著升高(P< 0.01)。
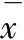
表2 TAL对肝组织中的MDA与GSH含量的影响(n = 10,±s)
注:与正常组比较,##P< 0.01;与模型组比较,**P< 0.01。
Note:Compared with normal group,##P< 0.01;Compared with model group,**P< 0.01.
2.4 TAL对APAP肝损伤小鼠肝组织中SOD、CAT和GSH-Px活力的影响
经APAP处理后,小鼠肝组织中抗氧化酶SOD、CAT和GSH-Px的活力显著降低(P< 0.01)。与模型组相比,TAL剂量依赖性地增强了小鼠肝组织中SOD、CAT和GSH-Px等抗氧化酶的活力(P< 0.05或P< 0.01)。
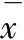
表3 TAL对肝组织中SOD、CAT和GSH-Px活性的影响(n = 10,±s)
注:与正常组比较,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note:Compared with normal group,##P< 0.01;Compared with model group,*P< 0.05,**P< 0.01.
2.5 TAL对APAP肝损伤小鼠肝组织中TNF-α、IL-1β和IL-6含量的影响
TNF-α、IL-1β和IL-6是典型的炎症因子。在模型组小鼠肝组织中,这三个细胞因子的含量均显著上升(P< 0.01)。TAL剂量依赖性地下调了小鼠肝脏中TNF-α、IL-1β和IL-6的含量(P< 0.01)。
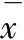
表4 TAL对肝组织中TNF-α、IL-1β和IL-6含量的影响(n = 10,±s)
注:与正常组比较,##P< 0.01;与模型组比较,**P< 0.01。
Note:Compared with normal group,##P< 0.01;Compared with model group,**P< 0.01.
2.6 TAL对小鼠肝脏中AMPK/Nrf2途径的影响
如图2A所示,与正常小鼠相比,模型小鼠肝脏细胞核内的Nrf2蛋白量呈现增加的趋势。TAL则进一步剂量依赖性地上调了Nrf2蛋白在模型小鼠肝脏细胞核中的含量(P< 0.01)。AMPK是Nrf2的重要调控因子之一。如图2B所示,APAP对小鼠肝脏中AMPKα的磷酸化水平无明显影响。在TAL的作用下,小鼠肝脏中AMPKα的磷酸化水平明显提高(P< 0.01)。

图2 TAL激活模型小鼠肝脏中的AMPK/Nrf2通路Fig.2 TAL activated the AMPK/Nrf2 cascade in the liver of mice
2.7 TAL对小鼠肝脏中Nrf2下游基因表达水平的影响
实验结果如图3A和3B所示。HO-1和GCLC都是典型的Nrf2下游基因。与正常小鼠相比,模型小鼠肝脏中这两个基因的表达水平有上升趋势。与模型小鼠相比,TAL可以在mRNA和蛋白质水平明显上调HO-1和GCLC的表达(P< 0.05或P< 0.01)。

图3 TAL上调模型小鼠肝脏中Nrf2下游基因的表达Fig.3 TAL elevated the expression of Nrf2-responsive genes in the liver of mice
3 讨论
肝细胞受损时,动物血清中的ALT和AST水平将显著升高。与正常组相比,模型组小鼠血清中的ALT和AST活性均有大幅升高,提示APAP诱导了显著的肝损伤。TAL有效降低了血清中这些酶的活性。这提示TAL对于APAP诱导的肝损伤具有明显的缓解作用。与此一致的是,TAL可明显改善APAP诱导的小鼠肝组织病变。
过量的APAP会大量消耗GSH,降低肝细胞的抗氧化能力,从而引起胞内脂质过氧化,MDA含量上升[17]。施用TAL能显著提高肝损伤小鼠肝组织中的GSH水平,抑制MDA生成。APAP过量时,肝脏中发生氧化应激反应,导致抗氧化酶SOD、CAT和GSH-Px的活性降低。与模型组相比较,TAL各剂量组小鼠SOD、CAT和GSH-Px的活性均有上升。表明TAL可上调抗氧化酶的活性,提高机体的抗氧化能力。在APAP的作用下,肝脏中炎症因子TNF-α、IL-1β和IL-6的水平会明显升高。炎症因子的积聚进一步加剧了APAP诱导的肝损伤[18]。在本研究中,TAL可显著下调模型小鼠肝组织中炎症因子的含量,抑制炎症反应的发生。以上研究结果综合说明,TAL能显著缓解APAP诱导的小鼠急性肝损伤。
AMPK是一个由三条肽链组成的丝/苏氨酸蛋白激酶。AMPKα是AMPK的催化亚基。AMPKβ和AMPKγ是AMPK的调节亚基。细胞内AMP水平增加时,AMPK由低活性的形式转变为高活性的形式,从而启动其下游分子事件。AMPKα上172位苏氨酸残基的磷酸化是AMPK被激活的重要标志。AMPK可通过以下三方面机制对Nrf2通路起到正向调控作用。其一,AMPK可直接催化Nrf2蛋白中550位丝氨酸残基的磷酸化而促进Nrf2的细胞核转位[19]。其二,活化的蛋白激酶GSK-3β可以通过诱导Nrf2出细胞核而终止Nrf2介导的基因转录。AMPK可通过催化GSK-3β上第9位丝氨酸的磷酸化而抑制GSK-3β的活性,从而拮抗GSK-3β对Nrf2的抑制作用[20]。其三,p62是一个磷酸化依赖的Nrf2活化因子。磷酸化的p62蛋白可通过与Nrf2蛋白相互作用而促进Nrf2的细胞核转位[21]。AMPK则可直接催化p62蛋白的磷酸化,从而有利于Nrf2通路的激活[22]。在APAP的作用下,肝脏内的氧化应激有代偿性上调肝内Nrf2通路活性的趋势。但是,这种对Nrf2的激活作用较弱,不呈现统计学意义,也不足以消除APAP诱导的氧化应激[23]。与模型小鼠组相比,TAL能明显促进Nrf2蛋白向细胞核内聚集并诱导Nrf2下游基因HO-1和GCLC的表达。这些研究结果提示TAL对于小鼠肝脏中的Nrf2通路具有明显的激活作用。另一方面,TAL能明显诱导小鼠肝脏内AMPKα的磷酸化。这提示提高AMPK的活性在TAL激活肝脏Nrf2通路的过程中可能起到了关键性作用。与我们的结果类似的是,小分子化合物dioscin和esculentoside A等亦可通过作用于AMPK/Nrf2通路来诱导HO-1和GCLC的高表达,以此缓解硫代乙酰胺和APAP诱导的肝损伤[24,25]。以上研究结果进一步提示,激活AMPK/Nrf2通路可能可以作为利用小分子化合物来干预毒物所致肝损伤的一种可行策略。

