水貂犬瘟热活疫苗与水貂细小病毒性肠炎灭活疫苗制备及其联合免疫效果研究
罗国良,王振军,冯二凯,易立,郭利,程悦宁※,程世鹏,王守富,王宏正,张洪亮
(1.中国农业科学院特产研究所,长春 130112;2.吉林农业大学,长春 130118;3.长春西诺生物科技有限公司,长春 130012)
水貂犬瘟热是引起水貂以双相热、白细胞减少、鼻炎和粘膜炎为特征的传染病[1]。水貂病毒性肠炎是以出血和坏死、急剧下痢、白细胞高度减少为特征的急性病毒性传染病[2]。2 种疾病均有较高的发病率和死亡率,是世界公认的危害水貂养殖业较严重的传染病[3],一旦发生,损失巨大。疫苗免疫接种是目前预防这2种疾病的最主要的方法。目前,我国防治这2 种疾病的疫苗有水貂犬瘟热活疫苗、水貂细小病毒性肠炎灭活疫苗以及水貂犬瘟热、细小病毒性肠炎二联活疫苗。联苗具有“一针多防”、减少免疫次数、提高接种效率等优点,联苗方式一般为活疫苗与活疫苗联用或者为灭活疫苗与灭活疫苗联用,而活疫苗与灭活疫苗联用的情况在国内较少采用,在国外犬用多联疫苗中较多采用灭活疫苗组分稀释活疫苗组分的联用方法,该方法有效地实现了联苗中各组分的优势组合。
本研究采用新型的制苗工艺,灭活疫苗采用新型灭活工艺,通过接种细胞和免疫动物实验,评价2 种疫苗联合免疫的效力,为进一步研制开发水貂犬瘟热活疫苗与细小病毒性肠炎灭活疫苗二联苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 水貂犬瘟热CDV3-CL 株、水貂细小病毒MEVB株(中国农业科学院特产研究所特种动物病原与免疫团队保存);F81 细胞、Vero细胞(中国科学院典型培养物保藏委员会细胞库提供)。
1.1.2 主要试剂 MEM培养基、0.25%胰酶-EDTA消化液(Corning 公司);2-溴乙胺氢溴酸盐(BEA)(Sigma-aldrich公司);甲醛(国药集团);其它试剂为国产分析纯。
1.1.3 实验动物 水貂购自农业部长白山野生生物资源重点野外科学观测试验站,2~3月龄,雌、雄随机,体况健康且未免疫水貂犬瘟热疫苗和水貂细小病毒性肠炎疫苗,免疫前经采血检测,犬瘟热病毒中和抗体和水貂细小病毒HI 抗体均为阴性。
1.2 方法
1.2.1 水貂犬瘟热活疫苗制备与检验 将CDV3-CL株用含MEM的细胞维持液作适当稀释,按5%的比例接种于长成良好单层的Vero细胞转瓶,37 ℃吸附1 h,加入含2%新生牛血清的细胞维持液,35 ℃旋转培养,细胞病变(CPE)达到80%以上时收获,20℃冻结,冻融后即为半成品。取样检验无菌合格且病毒含量≥105.70TCID50/mL 的半成品作为制苗用病毒液。将检验合格的病毒液与明胶蔗糖冻干保护剂按适宜比例混合,同时用0.1 mol/L 的NaHCO3 调pH 值7.4,充分混合,定量分装至100 mL玻璃冻干瓶内,冻干机冻干,冻干后轧盖。按以上方法制备3 批疫苗,进行性状、无菌检验、支原体检验、鉴别检验、外源病毒检验、真空度、水分测定以及效检和安检。
1.2.2 水貂细小病毒性肠炎灭活疫苗制备与检验 将MEVB 株按1%的比例接种于F81 细胞悬液转瓶中。35 ℃旋转培养,当细胞CPE达到80%以上时收获,20℃冻结,冻融后即成半成品,取样检验无菌合格且病毒含量≥106.00TCID50/mL的半成品作为制苗用病毒液。将病毒液用0.002 mol/L 二乙烯亚胺(BEI)灭活24 h,灭活后加入BEI 使用量的10%的1 mol/L 硫代硫酸钠中和BEI。灭活检验合格后,按病毒液∶氢氧化铝胶=9∶1 的比例制成水貂细小病毒灭活疫苗。按以上方法制备3批疫苗,进行性状、装量、无菌、效检和安检。
1.2.3 水貂犬瘟热活疫苗与细小病毒性肠炎灭活疫苗联合及联合后犬瘟热病毒含量的测定 在相同头份数情况下,使用专用稀释针头将水貂细小病毒性肠炎灭活疫苗吸入犬瘟热活疫苗冻干瓶内,将该状态下产品组合称之为水貂犬瘟热、肠炎联合疫苗(以下简称联合疫苗)。
将联合疫苗与同批次专用稀释液稀释的对照疫苗,分别置25 ℃条件下5 h,每小时取样1 次,将样品10 倍系列稀释,接种长成单层的Vero 细胞培养板,测定两种疫苗中犬瘟热病毒含量。
1.2.4 联合疫苗免疫试验 犬瘟热病毒中和抗体和细小病毒HI抗体均为阴性的水貂30 只,分为3 组,每组10 只。联合疫苗组免疫联合疫苗,每只水貂免疫各1头份,犬瘟单苗组免疫水貂犬瘟热活疫苗,每只水貂免疫1 头份,肠炎单苗组免疫水貂细小病毒性肠炎灭活疫苗,每只水貂免疫1 头份。免疫后21 d,采血分离血清,联合疫苗组测定犬瘟热病毒中和抗体和细小病毒HI 抗体,犬瘟疫苗组测定犬瘟热病毒中和抗体,肠炎苗组测定水貂细小病毒HI 抗体。
2 结果
2.1 水貂犬瘟热活疫苗制备与检验结果
3 批水貂犬瘟热活疫苗半成品均合格,病毒含量均在105.70TCID50/mL 标准之上,且无明显的批间差异。成品进行性状检验、无菌检验、支原体检验、外源病毒检验、鉴别检验、剩余水分和真空度测定结果均符合现行《中国兽药典》规定。3 批成品对水貂安全,病毒含量为104.50~104.70TCID50/mL,均符合产品质量标准(≥103.50TCID50/mL)。见表1、表2。
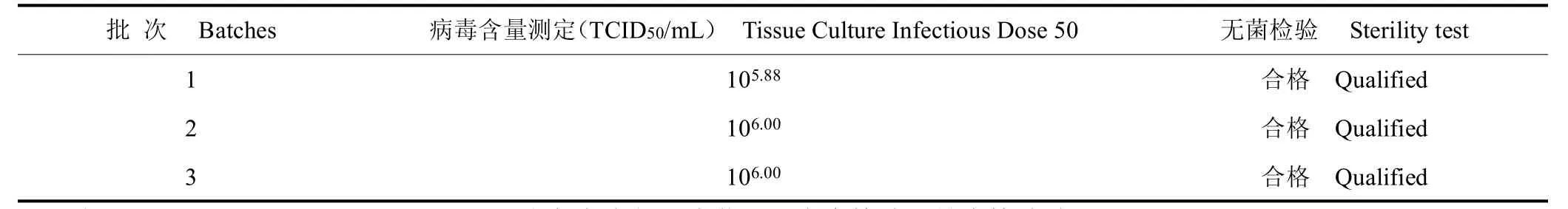
表1 水貂犬瘟热活疫苗半成品检验结果Table 1 Results of semi-finished product test of mink distemper vaccine,live
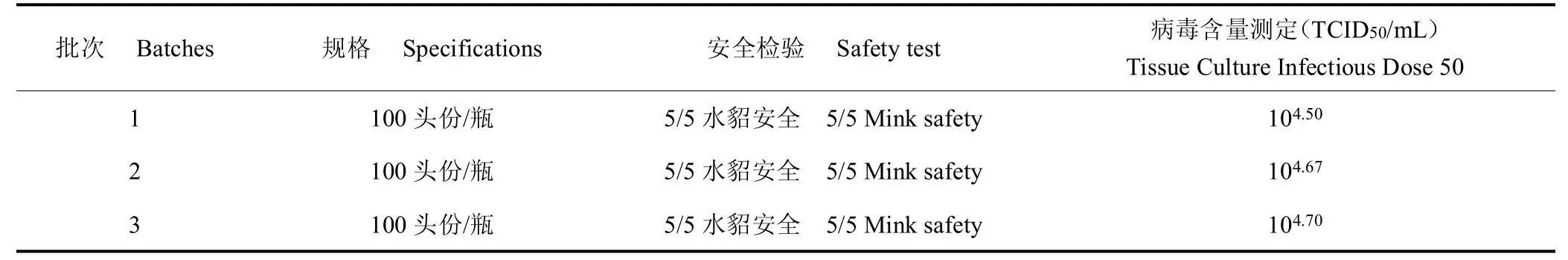
表2 水貂犬瘟热活疫苗成品安全检验和效力检验结果Table 2 Safety test and efficacy test results of mink distemper vaccine,live
2.2 水貂细小病毒性肠炎灭活疫苗制备与检验结果
3 批水貂细小病毒性肠炎灭活疫苗半成品无菌检验与灭活检验均合格,病毒含量为106.67~106.80TCID50/mL,均符合质量标准(≥106.00TCID50/mL)。
成品进行检验,性状、装量、无菌检验结果均符合要求,对水貂安全,HI 抗体效价为1∶128~1∶1 024,均符合质量标准(≥1∶32)。见表3、表4。

表3 水貂细小病毒性肠炎灭活疫苗半成品检验结果Table 3 Results of semi-finished product test of mink parvovirus enteritis inactivated vaccine
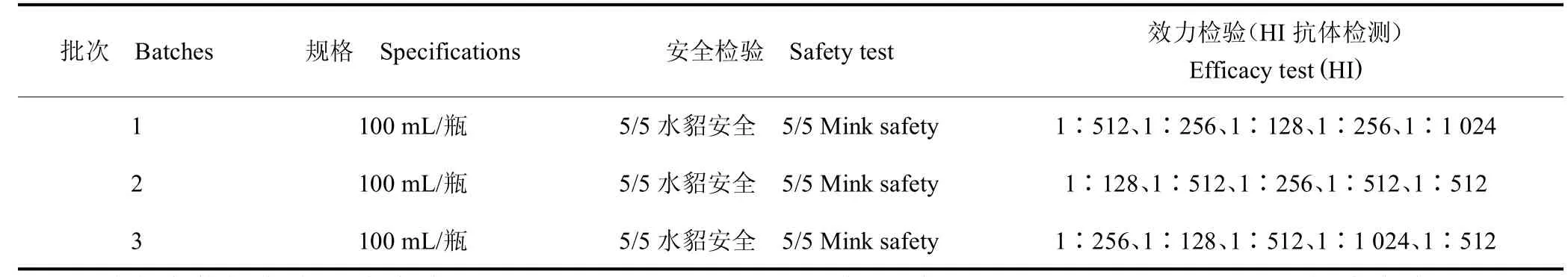
表4 水貂细小病毒性肠炎灭活疫苗成品安全检验和效力检验结果Table 4 Safety and efficacy test results of mink parvovirus enteritis inactivated vaccine
2.3 联合疫苗的犬瘟热病毒含量测定
将联合疫苗组、犬瘟单苗组样品25 ℃条件下不同时间取样,测定的犬瘟热病毒含量0~5 h 而略有下降(均下降100.30),但相同时间下两者的病毒含量无明显差异。见表5。

表5 水貂犬瘟热活疫苗与细小病毒性肠炎灭活疫苗联合后病毒含量结果Table 5 The TCID50 result of mink distemper vaccine live combined with parvovirus enteritis inactivated vaccine
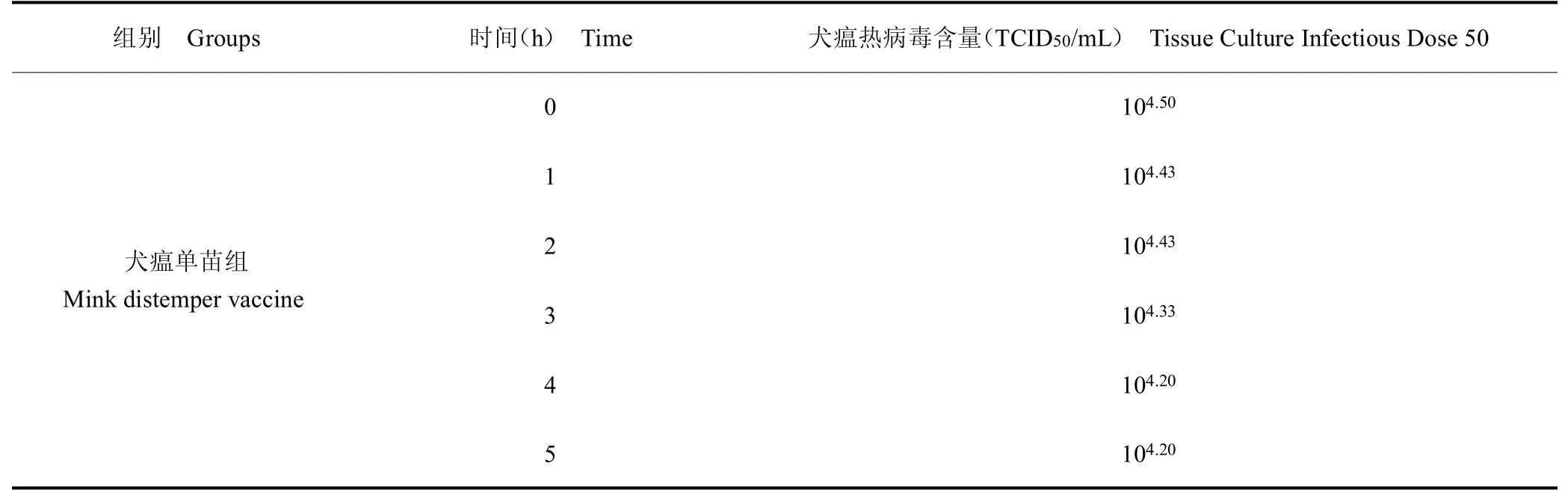
续表5
2.4 联合疫苗动物免疫试验
联合疫苗组样品产生的犬瘟热中和抗体与犬瘟单苗组相比,两者无明显差异;联合疫苗组产生的水貂细小病毒HI 抗体与肠炎单苗组相比,两者亦无明显差异。

表6 联合疫苗免疫抗体结果
3 结论与分析
目前,采用灭活疫苗稀释活疫苗实现联苗的方式在国外犬用苗上较常用,如法国梅理亚生产的犬瘟热、腺病毒病、细小病毒病、副流感病毒2 型呼吸道感染症4 联活疫苗-犬钩端螺旋体病、黄疸钩端螺旋体病2 价灭活疫苗;硕腾公司的犬瘟热、腺病毒2 型、副流感、细小病毒四联活疫苗-犬钩端螺旋体病(犬型、黄疸出血型)2 价灭活疫苗-犬冠状病毒病灭活疫苗。能够实现灭活疫苗与活疫苗联用的前提条件是灭活疫苗与活疫苗联合后对活疫苗中的病毒无灭活作用,两者一起免疫后不降低各自的免疫效果。
本研究中,在水貂细小病毒性肠炎灭活疫苗的制苗过程中,为了降低灭活剂的残留,优化了水貂细小病毒性肠炎的灭活工艺,采用BEI进行灭活,残留的BEI采用硫代硫酸钠进行中和,经检验水貂细小病毒灭活完全。半成品和成品的各项检验指标均符合要求,成品效力检测抗体水平无明显差异,生产工艺稳定。
犬瘟热半成品、成品的检测指标亦表明,采用100mL 玻璃冻干瓶冻干的犬瘟热活疫苗的生产工艺稳定,成品病毒含量无明显差异(104.50~104.70TCID50/mL);灭活疫苗组分对犬瘟热病毒无明显影响;犬瘟热病毒、细小病毒抗体水平与单苗相比均无明显影响。

