气相色谱-串联质谱法检测水产品运输水和暂养水中丁香酚残留
王正全,倪玲,谢庆超,齐自元,刘源,汪立平,赵勇,,王锡昌,,谢晶,3
(1. 上海海洋大学食品学院; 2. 农业部水产品贮藏保鲜质量安全风险评估实验室(上海);3. 农业部冷库及制冷设备质量监督检验测试中心(上海):上海 201306)
丁香酚(eugenol)化学结构如图1,分子式为C10H12O2,常温下呈黄色或透明的油状液滴,是芳香植物精油中可以萃取得到的一类苯基丙烯类化合物,其化学名是4烯丙基-2-甲氧基苯酚,CAS号码是97-53-0,密度为1.06 g/cm3,熔点为-7.5 ℃,沸点为254 ℃,在25 ℃时酸度(pKa)为10.19,可溶于水。在药理作用上,丁香酚可与氧化锌结合形成氧化锌丁香酚,有局部麻醉、防腐、镇痛、抗炎和抗菌的作用,并可作用于生物体弓状核区的敏感神经元,影响其放电作用及相关细胞通路,产生局部降温等作用,因此常用于牙根管手术麻醉以及生产清凉油等驱蚊虫药物药水[1-2]。
丁香酚可用于麻醉景观鱼,并被全球水产养殖从业人员广泛应用于水产品养殖和运输[3-4]。由于丁香酚比渔用麻醉剂MS-222价格低廉,麻醉后的复苏时间长,毒性机理和毒害作用不明确,仅有可参考的残留限量值和半致死量[5],国际上对其危害性一直存在争议,因此,受政府监督管理措施约束力小,目前已成为沪浙闽地区水产运输环节的应用主流[4,6]。据报道,高浓度的丁香酚(0.15 mL/L)能使罗非鱼出现短暂呼吸停止的现象,而低水温时鱼体对麻醉剂的吸收效果变差,需要更高剂量和更长的麻醉时间以提升鱼类血液中的促肾上腺皮质激素和皮质醇的浓度,从而缓解鱼类运输过程中的应激反应[7]。同时,国内外养殖场在温水鱼和冷水鱼的高密度养殖环节也在使用丁香酚增肥止损[8]。进入水体的丁香酚可通过水体颗粒物和底泥吸附沉降及生物富集的方式进入生物体内循环代谢,带来潜在的风险[5]。另外,商用丁香酚精油在检测时表现出残留久、可降解的特性,目前仅有部分发达国家如美国、捷克等,允许使用有限剂量的丁香酚,并给出了推荐参考值,而国内水产养殖业使用丁香酚却没有遵照参考剂量(40~150 mg/L)用药[5],也没有设置合理的休药期,并存在因低温运输导致麻醉剂效用低下而被迫追加大剂量保活的情况,使丁香酚无法从短暂的暂养环节消除而被消费者直接食用[5]。因而,近年来国内外关于水产品及其养殖、运输和暂养环节的丁香酚残留的研究显著增多,如使用固相萃取(SPE)[9-10]、超声萃取[10]、流通液体闪烁计数技术[11]、液液萃取[12]、分散固相萃取(d-SPE)[13]等提取方法配合内标物为14C-丁香酚[11]、d3-丁香酚[12]、异丁香酚[13-15]的内标法检测鱼肉、虾肉基质中丁香酚残留的研究,还有一些对血浆[14, 16-18]、血清[19]、茶[20]、环境水[21]、纯净水[22-23]、养殖水体[24]等液体基质中丁香酚残留的研究。
图1 丁香酚与对二苯基苯的化学结构图Fig.1 Chemical structures of eugenol and diphenyl benzene
目前,针对液体样品中丁香酚残留的检测方法不多,针对养殖、暂养环节复杂基质水样的检测方法存在不足,仅有赵东豪等[22]和刘海新等[24]开发了养殖水(farming water)中丁香酚残留的高效液相色谱-串联质谱(HPLC-MS/MS)检测法并完成了不确定度分析,柯常亮等[21]使用气相色谱-串联质谱(GC-MS/MS)检测纯净水中丁香酚的残留。其中,HPLC-MS/MS虽然速度快却消耗太多有机试剂,不够经济和环保,而GC-MS/MS的研究则相对简单基础,还可更深入优化。本研究旨在开创更经济环保、低消耗、高响应的GC-MS/MS检测运输和暂养水中丁香酚残留的内标检测方法,并应用该方法检测了2014年度沪浙闽地区采集的18个运输和26个暂养水样,发现确实存在丁香酚残留的情况,预期为政府监督管理提供科学依据和支撑。
1 材料与方法
1.1 材料
本研究中使用的水样品均为农贸市场和批发市场随机采样,采样方法依据GB/T 5750.2—2006 《生活饮用水标准检验方法 水样的采集和保存》的有关要求进行。水样样品经均质混匀后,过0.45 μm有机相滤膜,于-40 ℃冷冻保存备用。
丁香酚标准溶液(1 000 μg/mL,纯度为99.0%)和对二苯基苯内标溶液(1 000 μg/mL,纯度99.5%)由上海安普生物科技有限公司提供。色谱纯二氯甲烷,纯度为99.0%,由SIGMA集团提供。N-丙基乙二胺(PSA,40~60 μm)、聚合氧化铝(PAC,纯度为98.0%),由天津博纳艾杰尔科技有限公司提供。分析纯NaCl,纯度为99.5%;无水硫酸镁,纯度为97.0%,由国药集团提供。实验用水由Milli-Q提供。
1.2 仪器与设备
TSQ Vantage 8000三重四级杆气质联用仪(配有Xcalibur1.2数据处理系统),由美国Thermo Fisher Scientific公司提供。小型设备:如国产JJ-2 组织捣碎匀浆机由武汉格莱莫检测设备有限公司提供;TD5A_WS型台式低速离心机由长沙湘仪离心机仪器有限公司提供;RE- S2A旋转蒸发仪和SHB-IIIA循环水式真空泵由上海亚荣仪器厂提供;江苏天翎 XH-D旋涡混合器由江苏天翎仪器有限公司提供;ps-70A超声波清洗仪由深华泰仪器有限公司提供;SartoriusBP211D分析天平由美国Sartorius公司提供。
1.3 实验方法
1.3.1 样品前处理
取样品20.0 mL(精确到0.1 mL)[23],置于50 mL离心管中,后续步骤如图2所示。此过程中要注意2点,其一:若有机相仍出现浑浊或乳化的情况,可以向100 mL鸡心瓶中加入4 g无水硫酸镁后,振荡超声10 s,并涡旋10 s,混匀、静置分层后,取有机相;其二:2 mL正己烷定容后需要先后分别过2层有机相滤膜(0.45 μm和0.22 μm),目的是最大限度除去颗粒物,同时保证上机检测时进样体积大于0.5 mL。
1.3.2 色谱条件
色谱柱选用HP-5 MS气相色谱石英毛细柱(30 m×0.25 mm,0.25 μm)。升温程序:80 ℃保持1 min;以30 ℃/min升至280 ℃,保持4 min;再以30 ℃/min升至300 ℃,维持2 min。载气(He)流速1.0 mL/min,进样量1.0 μL,不分流进样。
1.3.3 质谱条件
电子轰击离子源电喷雾(ESI)正离子模式同时扫描;电子能量70 eV;传输线温度280 ℃;离子源温度280 ℃;采集方式选择反应监控模式(select reaction monitor,SRM);质量扫描范围m/z35~500,离子对信息参见表1。
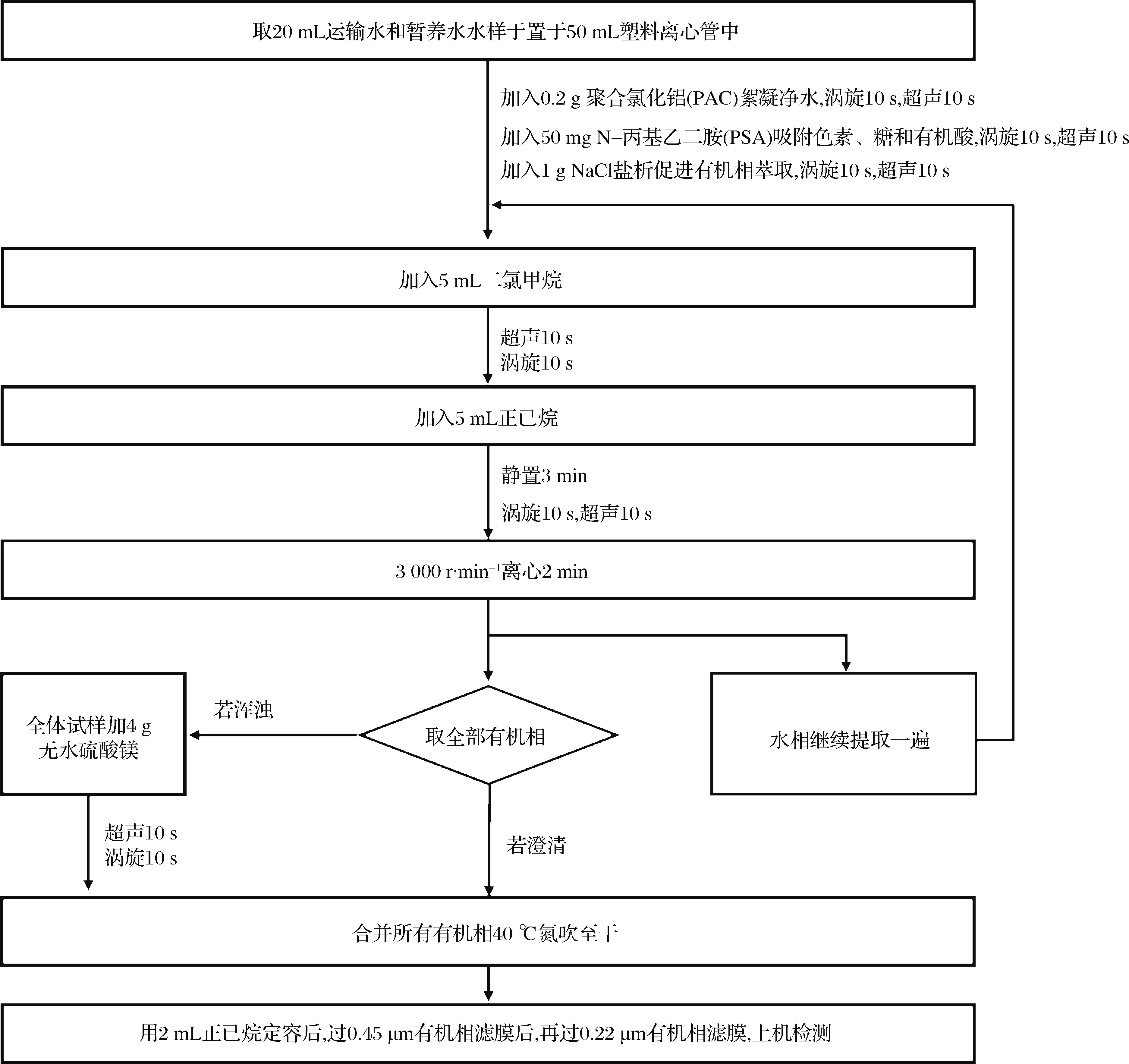
图2 运输水和暂养水中丁香酚的萃取步骤Fig.2 The extraction protocol of eugenol from transport water and temporary water
表1 丁香酚和对二苯基苯质谱检测参数Tab.1 The mass spectrometry parameters for determination of eugenol and diphenyl benzene
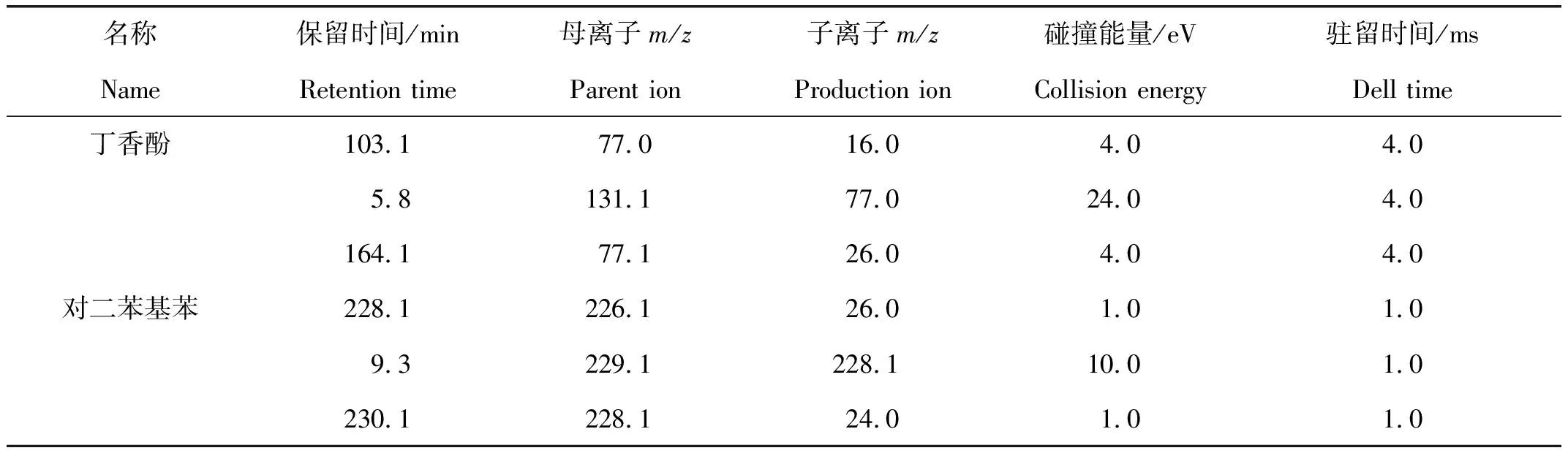
名称保留时间/min母离子m/z子离子m/z碰撞能量/eV驻留时间/msNameRetention timeParent ionProduction ionCollision energyDell time丁香酚103.177.016.04.04.05.8131.177.024.04.0164.177.126.04.04.0对二苯基苯228.1226.126.01.01.09.3229.1228.110.01.0230.1228.124.01.01.0
1.4 结果计算
运输和暂养水样品中丁香酚残留量测定结果按内标标准曲线法计算,计算结果需扣除空白值。
式(1)
式中:Xi为样品中丁香酚的含量(μg/L);Ci为样品中丁香酚的进样质量浓度(ng/L);V为最终定容体积(mL);Vi为样品体积(L)。对于超出线性范围的阳性样品,使用单点定量法计算结果。
1.5 数据处理
用Microsoft Excel 2010和Origin 8.0软件进行标准曲线线性回归分析和确认,SPSS 20.0用于精密度计算。
2 结果与讨论
2.1 前处理方法的优化
柯常亮等[23]开发的暂养水的丁香酚检测方法可以简单有效地检出暂养水基质中的丁香酚残留,使用的仪器是气相色谱-串联质谱仪,经乙酸乙酯萃取水相(乙酸乙酯与水相完全互溶)后,用NaCl盐析分离乙酸乙酯和水相的混合液,再用无水硫酸钠去除分离出来的乙酸乙酯中的残余水分,干燥后进样检测。该方法相对简单,仅使用一步类似于QuEChERS方法的优化d-SPE法,在开发方法的时候较易实现高回收率,而在实际环境复杂样品检测时容易出现净化不完全、干扰杂质多、萃取不完全的现象。对此,本研究优化了暂养水的前处理步骤,通过PAC先絮凝沉淀出带负电荷的胶体,达到除菌、脱色和除臭的作用,再用PSA吸附色素、糖和有机酸,然后使用盐析破除乳化,去除有机相中的的多余水分,后配合二氯甲烷和正己烷形成三相体系萃取,净化和萃取步骤类似于一个简化型基质分散固相萃取(matrix solid phase dispersion, MSPD)方法,是专门针对基质复杂的养殖水和运输水开发的方法。
2.2 回收率、检测限和精密度
本研究开展了1.5~50.0 μg/L的丁香酚添加实验,内标物为对二苯基苯,添加质量浓度为5.0 μg/L,同时对照空白实验,获得方法回收率和精密度(图3和表2)。结果表明,丁香酚的方法检出限为(LOD)0.5 μg/L,定量限(LOQ)为1.5 μg/L,方法回收率为82.3%~109.9%,6次平行测定结果相对标准偏差(RSD)小于6.9%,方法符合线性特征,其线性回归方程为Y=-0.006 424+0.000 391 7X,相关系数r为0.993 6,LOQ添加水平的信噪比S/N为10.95。方法回收率和LOQ与前言中的国内外研究进展相比,LOQ仅次于赵东豪等(0.05 μg/L)和柯常亮等(0.2 μg/L)的纯净水和暂养水的检测方法,方法回收率与二者相当[22-23]。
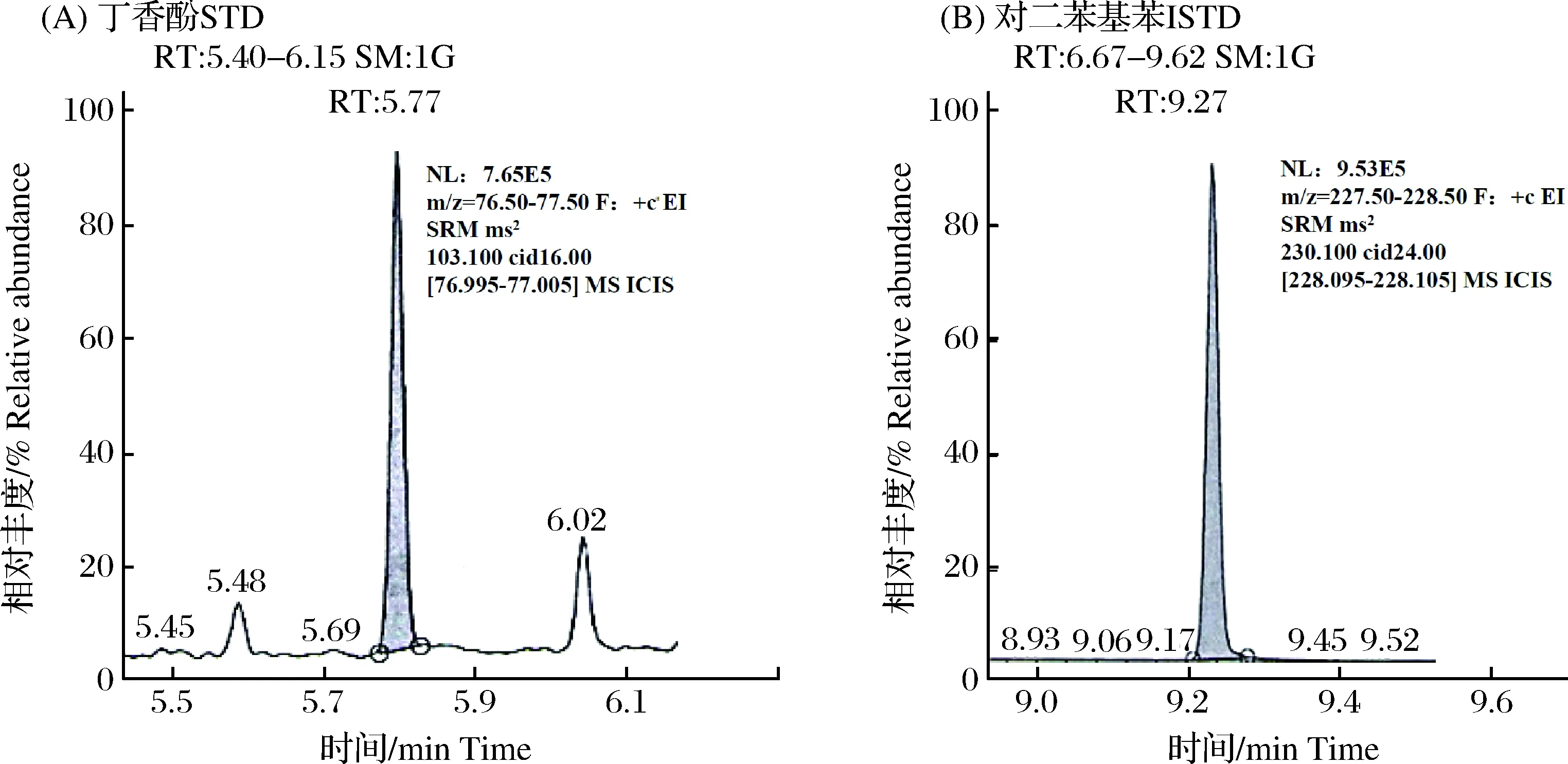
图3 添加5.0 μg·L-1的内标物对二苯基苯的运输水样品基质的的三重四级杆气质抽取离子图:tR=5.77为丁香酚(A),tR=9.27为内标物对二苯基苯(B)Fig.3Extracted ion chromatograms of eugenol and diphenyl benzene in spiked transport water sample with 5.0 μg·L-1internal standard using GC-MS. tR=5.77 is the peak of eugenol (A), tR=9.27 is the peak of diphenyl benzene (B)
表2 运输水样品基质中丁香酚内标法添加实验回收率和相对偏差Tab.2 Recoveries and relative standard deviationsof eugenol from spiked transport water samples on sixlevels using internal standard method

n=6
2.3 稳定性和重现性
样品经前处理后,再分别添加5.0 μg/L丁香酚与内标物,于室温下静置0、12和24 h后,药物浓度变化小,平均RSD<12%(n=6)。相同运输水样基质的10个5.0 μg/L丁香酚及内标物添加平行样品同时检测结果显示,实测质量浓度为(4.9±0.2)μg/L,RSD<6%。该结果说明,本方法处理的丁香酚样品在24 h之内进样是稳定可靠的,基质影响波动幅度小,适合于大批量样品前处理和进样检测分析,这与焦亚琴等[18]对鲤血液中丁香酚含量检测结果基本相同,但其鲤血液最低添加水平为0.041 4 mg/L,高于本研究中运输和暂养水的最低添加水平1.5 μg/L[20]。
2.4 方法特点
由于鲜活水产品的暂养水样中干扰物相对较少,基质比血液样品和乳制品简单,多数情况下暂养水样中相对悬浮物和颗粒物少,显得澄清透明;而运输水样多因鱼体分泌黏液含有蛋白质、糖分和氨氮排泄物而致颜色昏黄,通常浑浊且呈现胶体状,甚至伴有恶臭等异味,但经过抽滤静置后也能逐步恢复澄清(但仍保持胶体状态)。这使得养殖水样前处理过程中,若单靠简单的液液萃取法,会将多余的蛋白质、多糖和胺类物质中的脂溶性成分一同被富集在萃取有机相中,基质干扰严重[22-23]。本方法针对此类情况预先对有限的水样品进行简单的絮凝沉淀净水,净化的水样再用PSA去除色素、糖和有机酸,用盐析的方式破除乳化并促进丁香酚富集于有机相中,是一种简单有效的MSPD前处理方法。
实验证明,使用异丁香酚作为内标物检测运输和暂养水样中的丁香酚时,异丁香酚放置2个月以上时会出现转化为丁香酚,进而干扰待测物检测的情况,若以对二苯基苯为内标物时则不存在类似现象。当然,若有条件购买d3-丁香酚,推荐使用更好的同位素内标物代替,但检测单位需要综合考虑成本和订购特殊标准品的时间消耗问题。图3给出了水样基质中丁香酚与内标物对二苯基苯的三重四级杆的气质抽取离子图,可以看出丁香酚与内标物分离较好,干扰少,易于定性定量分析。
另外,本实验先加入二氯甲烷沉于水相底部做第一轮萃取后,再加入正己烷形成覆盖层并静置3 min二次萃取,然后涡旋混合三相体系,使二氯甲烷层与正己烷层合并为一相,即变为水相和有机相的两项体系,收集有机相可有效提取水样品基质中的挥发性物质[18],从而提升萃取效率[21]。
2.5 方法的实际应用
自2013年摸底排查沪浙闽地区水产品和运输环节的麻醉剂及方法开发以来,本方法被成功应用于2014年7月排查的沪浙闽地区18个运输和26个暂养水样,检测结果如表3所示。结果显示,运输水样中7个样品阳性检出,检出率为38.89%,而暂养水样中6个样品阳性检出,检出率为23.08%。统计数据表明,中高档鲜活鱼类(如大菱鲆、石斑鱼、真鲷、大黄鱼),4种鱼中除大黄鱼外,其他3种使用含丁香酚水体保活的现象更加突出,同时发现个别的鲈和石斑鱼运输和暂养水样的阳性丁香酚残留具有相关性[22]。
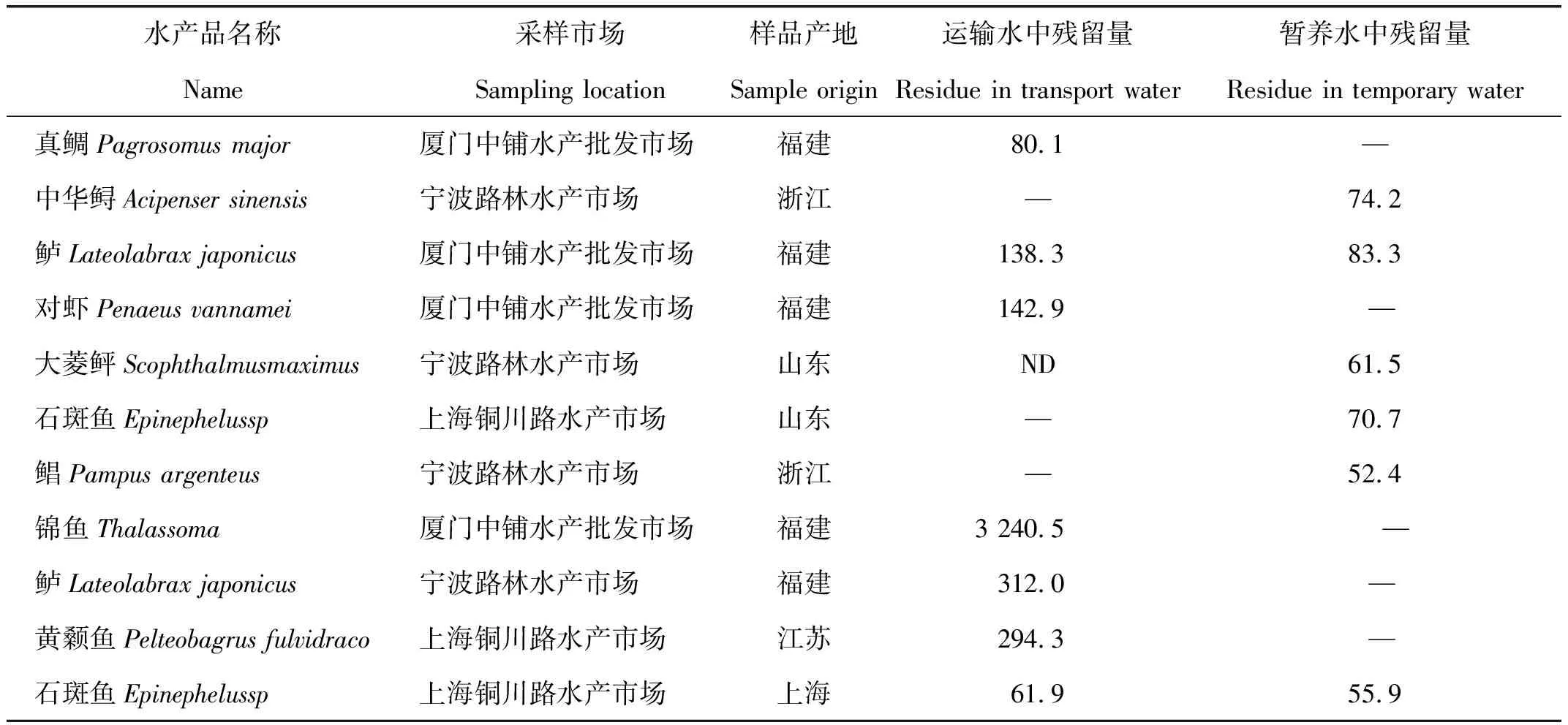
表3 2014年沪、浙、闽售水产品的运输水和暂养水水样中的丁香酚残留量Tab.3 Residue of eugenol in transport water and temporary water samples from Shanghai,Zhejiang and Fujian Provinces in 2014 μg·L-1,n=3
注:“—”代表未采集到样品;“ND”代表没有检测出丁香酚。
3 小结
沪浙闽地区水产品运输环节会使用丁香酚麻醉运输和暂养保活,其对应的运输和暂养水样经简单的MSPD净化后,再经二氯甲烷和正己烷萃取富集,简单离心后直接浓缩至干,定容后采用气相色谱串联质谱,以对二苯基苯为内标定量检测。经实践证明,该方法在针对水产品运输水和暂养水等复杂基质检测时,检出限为0.5 μg/L,定量限为1.5 μg/L,在1.5~50.0 μg/L线性范围内,回收率为82.3%-109.9%,在18个运输水样和26个暂养水样的检测中,阳性检出率大于20%,方法RSD<6.9%,平行进样RSD<6%,检出限低、稳定性好,是现有渔业运输水样检测方法的有效补充和优化改良。预期在解决丁香酚环境水样检验检测可依据的文献和标准较少的情况下,能够产生一定的社会应用和参考价值,为水产品流通领域的安全监控提供技术支持。

