lncRNA RP11-769O8.2在肝癌组织、细胞系中的表达及其编码能力评估和靶基因预测
陈思宇,陈安宁,宋伟,刘玲珑,王鹏飞,姚清媚,吴帆,周素芳
(广西医科大学基础医学院,南宁 530021)
肝癌(HCC)是临床常见的恶性肿瘤,在癌症死亡原因中排在前列,且发病和死亡水平居高不下[1,2]。近年来,虽然临床上针对HCC的治疗手段不断更新,但治疗HCC的总体疗效并没有明显提高[3]。肿瘤转移是一个多步骤、多阶段、多途径的复杂过程,涉及到多基因的参与[4]。研究[5~11]发现,除蛋白质编码基因能调节肿瘤外,一些非编码基因如长链非编码RNA(lncRNA)分子也参与了肿瘤发生发展的调控。在HCC中也存在多种lncRNA的表达改变,比如lncRNA MVIH、MALAT-1、HULC和H19等,这些lncRNA通过不同方式调控基因表达,参与了HCC的发生发展[12]。RP11-769O8.2是新发现的一种lncRNA,国内外研究尚未见相关报道。本研究通过实时荧光定量PCR法(RT-PCR法)检测HCC患者组织及细胞系中RP11-769O8.2,另通过在线数据库评估其编码能力和预测其靶基因,以揭示RP11-769O8.2的作用机制及意义。
1 材料与方法
1.1 肝癌组织、细胞系及主要试剂、仪器 手术切除的HCC组织17例份[取自广西医科大学附属肿瘤医院2016年10月~2017年3月收治的患者,男14例、女3例,年龄31~60(48.8±9.3)岁,均经病理确诊,且未进行化疗],保存于本实验室-80 ℃冰箱;另取癌旁组织(癌组织包膜1 cm外的癌周组织)作对照;临床病历资料完整,所有患者均知情同意。人HCC细胞系SK-Hep1、HepG2、Huh7、97L及人正常肝细胞系L-02由本实验室保存。DMEM高糖培养基购自美国Hy-Clone公司,胎牛血清、含EDTA胰酶购自Gibco公司,总RNA提取试剂盒购置于Omega Bio-Tek公司,逆转录试剂盒、荧光定量反应相关试剂、GAPDH内参引物购置于宝生物工程(大连)有限公司。PCR仪购自德国Biometra公司,荧光定量PCR仪购置于Eppendorf公司。
1.2 HCC组织、细胞系中RP11-769O8.2检测 采用qRT-PCR法。①HCC组织及癌旁组织:取30 mg冰上解冻的组织样品,用眼科剪剪碎后转到50 mL离心管加入1.5 mL裂解液及30 μL的β巯基乙醇,冰上放置,用高速分散匀质机破碎组织,置于冰上10 min,以4 000 r/min离心5 min,取上清,后续按试剂盒步骤进行;②HCC细胞系:用0.5 mL胰蛋白酶将处于对数生长期的细胞消化下来,并用PBS洗3次。按试剂盒步骤提取RNA。逆转录和PCR反应均严格按照TaKaRa公司提供的说明书,以GAPDH作为内参进行相对定量,每组设3复孔,在实时定量荧光PCR仪上进行检测。RP11-769O8.2:5’-TCAGATTCTGTGGACATTTGGAG-3’,5’-GCCTTAT-TATTGGCTTTGGTTG-3’;内参GAPDH引物:5’-GC-ACCGTCAAGGCTGAGAAC-3’,5’-TGGTGAAGACG-CCAGTGGA-3’。以2-ΔΔCt法代表RP11-769O8.2的相对表达量。
1.3 RP11-769O8.2编码能力评估及其靶基因预测 使用在线数据库Coding Potential Calculator Online(http://cpc.cbi.pku.EdU.cn/)预测RP11-769O8.2编码能力。根据顺式(cis)作用模式预测其靶基因,使用UCSC数据库(http://genome.ucsc.edu/)寻找RP11-769O8.2周围邻近的靶基因。
1.4 HCC组织、细胞系中YES原癌基因1(YES1)检测 采用qRT-PCR法。①HCC及癌旁组织:称取30 mg冰上解冻的组织样品,用眼科剪剪碎后转到50 mL离心管加入1.5 mL裂解液及30 μL的β巯基乙醇,冰上放置,用高速分散匀质机破碎组织,置于冰上10 min,以4 000 r/min离心5 min,取上清,后续按试剂盒步骤进行;②HCC细胞系:用0.5 mL胰蛋白酶将处于对数生长期的细胞消化下来,并用PBS洗3次。按试剂盒步骤提取RNA。逆转录和PCR反应均严格按照TaKaRa公司提供的说明书,以GAPDH作为内参进行相对定量,每组设3复孔,在实时定量荧光PCR仪上进行检测。YES1:5′-CCCTCCTCCTGAAGTAACGC-3′,5′-CTCATGAGTCGCTGCTACCG-3′;内参GAPDH:5′-GCACCGTCAAGGCTGAGAAC-3′,5′-TGGTGAAGACGCCAGTGGA-3′。采用2-ΔΔCt法计算YES1的相对表达量。
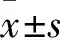
2 结果
2.1 HCC组织、细胞系中RP11-769O8.2表达比较 HCC、癌旁组织中RP11-769O8.2表达量分别为13.22±2.04、11.72±2.36,两者比较,P<0.05。SK-Hep1、Huh7、HepG2、97L细胞系中RP11-769O8.2相对表达量分别为0.32±0.01、1.50±0.04、2.35±0.24、1.21±0.15,SK-Hep1表达与其他三者比较,P均<0.05。
2.2 RP11-769O8.2表达与HCC临床病理参数的关系 结果见表1。由表1可知,RP11-769O8.2表达与HCC肝硬化程度相关(P<0.05)。
2.3 RP11-769O8.2编码能力及靶基因 Coding Potential Calculator Online在线数据库显示RP11-769O8.2的编码能力评分为-1.28,提示蛋白质编码能力弱,而作为编码RNA阳性对照的TP53 mRNA和GAPDH mRNA的编码能力评分分别为8.25和2.24,均远大于RP11-769O8.2。UCSC数据库检测显示,RP11-769O8.2是编码YES1的剪切体,由两段外显子序列转录组成,位于YES1反义链,YES1 mRNA可能有转录激活与表达调控方式,因此将YES1选为RP11-769O8.2的靶基因。

表1 RP11-769O8.2表达与HCC患者临床病理参数的关系
2.4 HCC组织、细胞系中YES1表达比较 HCC、癌旁组织中YES1表达量分别为13.22±2.04、11.72±2.36,两者比较,P<0.05。SK-Hep1、Huh7、HepG2、97L细胞系中YES1相对表达量分别为0.48±0.23、1.82±0.62、2.56±1.04、1.86±0.79,L-02与其他三者比较,P均>0.05。
2.5 RP11-769O8.2与YES1的相关分析结果 HCC组织中RP11-769O8.2、YES1的相对表达量分别为1.5±1.5、2.35±1.49;以RP11-769O8.2在HCC组织与癌旁组织中的相对表达量为X轴,以YES1在HCC组织与癌旁组织中的相对表达量Y轴,制作散点图,判断RP11-769O8.2与YES1的相关趋势,线性相关分析得到Pearson相关系数为0.597,P<0.05,显示RP11-769O8.2与YES1的表达量呈正相关。
3 讨论
原发性HCC,是由肝细胞或肝内胆管上皮细胞发生的癌肿,是我国常见恶性肿瘤之一,是一种死亡率较高的肿瘤疾病,男性中发病率高于女性。HCC组织细胞学分类较多,其中SK-Hep1为肝/腹水细胞癌细胞系;HepG2细胞系于1979年,从阿根廷一名15岁高加索男孩的原发性肝胚细胞瘤中分离出并建立,该细胞系呈上皮样,贴壁抱团生长;Huh7细胞系于1982年从一名患有HCC的57岁日本男性HCC组织标本上培养而得。该细胞AFP阳性,高度分化,细胞呈上皮样,贴壁生长;97L细胞系由上海医科大学中山医院建立,将一名我国39岁男性HCC患者的肝右叶转移病灶的手术切除标本接种于裸鼠肝内建造出人HCC裸鼠转移模型而得。
lncRNA数量比较多,大约是mRNA的3~100倍,这些类似mRNA的转录本在各种基因调控水平和胚胎发育等生物学过程中发挥作用。越来越多的证据也表明,异常表达的lncRNA在多种疾病状态中发挥重要作用,如癌症。这些RNA尽管在十几年前就已经发现,但只有少数分子的功能得到鉴定,仍有很大的研究空间。而RP11-769O8.2是新发现的一种lncRNA,其对HCC的作用及机制目前国内外尚未见相关报道。RP11-769O8.2是编码YES1蛋白的剪切体,由两段外显子序列转录组成,位于YES1的反义链上。本研究显示,HCC组织中RP11-769O8.2的相对表达量低于癌旁组织,SK-Hep1 RP11-769O8.2的相对表达量低于Huh7、HepG2、97L,RP11-769O8.2表达水平的降低与患者肝硬化程度有关。提示RP11-769O8.2表达水平可能与HCC的发生发展有密切联系。
Coding Potential Calculator Online在线数据库评估RP11-769O8.2编码能力得分为-1.28,提示蛋白质编码能力弱,其评分远远小于作为编码RNA阳性对照的TP53 mRNA编码能力评分8.25及GAPDH mRNA 2.24。cis调控就是指非编码RNA对临近mRNA的一种转录激活与表达调控方式。研究发现,基因调控可能以顺式(cis)或反式(trans)作用形式发生。其中cis调控主要依赖顺式作用元件进行,顺式作用元件是指存在于基因旁侧序列中能影响基因表达的序列,包括启动子、增强子、调控序列和可诱导元件等,它们的作用是参与核内基因表达的调控,顺式作用元件通常转录为非编码RNA,如lncRNA[13]。通过生物信息学预测发现,RP11-769O8.2位于YES1反义链上,可能通过cis调控机制影响YES1的表达,进而在癌症中发挥作用。YES1作为可以调节细胞增殖、黏附和分化的关键因子,是Src家族激酶中的一员。YES1在许多肿瘤中均有较高的表达水平[14],已被认为是许多癌症的潜在治疗目标,包括黑色素瘤、乳腺癌和横纹肌肉瘤等[15]。本研究发现,与L-02比较,YES1在SK-Hep1中表达水平最低,而在Huh7、97L中的表达水平相近,在HepG2中的表达水平最高,L-02表达与HCC各细胞系比较均无显著性差异;而YES1在HCC组织中的表达明显低于癌旁组织。相关性分析显示,RP11-769O8.2及其靶基因YES1呈正相关性。提示YES1可能是RP11-769O8.2的作用靶点,且与HCC的发生发展有密切关系。
总之,RP11-769O8.2在HCC组织标本中低表达,与患者的肝硬化程度相关,编码能力弱;且RP11-769O8.2的表达与YES1的表达呈正相关,可能是潜在的HCC预后预测分子标志物。但由于样本量不大,且缺乏进一步的分子生物学及实验室数据,关于RP11-769O8.2在HCC中的具体作用及分子机制尚需更加深入研究。

