德尔菲法对药品不良反应损害评分标准的修订及其在1494例报告中的应用
程晶晶,王 亚, 张 玲,王 卓*
(1.海军军医大学长海医院药学部,上海 200433;2.上海市杨浦区市场监督管理局,上海 200090; 3.武警河南省总队医院药剂科,郑州 450000)
药品不良反应(adverse drug reactions,ADRs)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。ADRs在临床用药中广泛存在。《药品不良反应报告和监督管理办法》[1]以“一般”和“严重”来区分ADRs的性质和后果。盛红彬等[2]把ADRs损害程度分成了10级。李利军等[3]率先在国内提出ADRs严重度指数(severity index of ADRs,SIADRs),对ADRs损害程度的分级量化做了有益的探索。 SIADRs是通过对药品ADRs严重程度进行分级赋分,对药品发生的所有ADRs个案进行评分并取其平均值,以此来反映该药品造成的ADRs严重程度的大小,以便进行各药品间损害程度的定量比较。现有ADRs日常呈报主要统计的是ADRs的发生频率,但缺乏不同ADRs造成损害程度的差异信息。若能在日常报表中加入上述ADRs损害严重程度的量化评分,则有可能获得某种或某类药品ADRs造成损害不同程度的评价信息,对现有呈报工作是一项有益的补充。用于日常评价每例个案的ADRs损害评分标准需要具备分级明确、评分公正、易于操作等条件,目前报道的仍存在一些不足。许佼等[4]制定出的ADRs损害程度评分标准,将ADRs损害程度进行了量化赋值并使其具有加和性,但其评分标准只有11级,每个评分标准指标涉及范围仍然较广,且对部分ADRs损害情况没有涵盖到。本研究以上述研究为基础,利用德尔菲法制定出更细化、层次更分明、更具可操作性的ADRs损害程度评分标准,应用其对1494例ADRs报表进行评分,并同时应用许佼等[4]制定出的ADRs损害程度评分标准(见表1)对这些报表评分,从而对两种评价标准进行分析和比较。
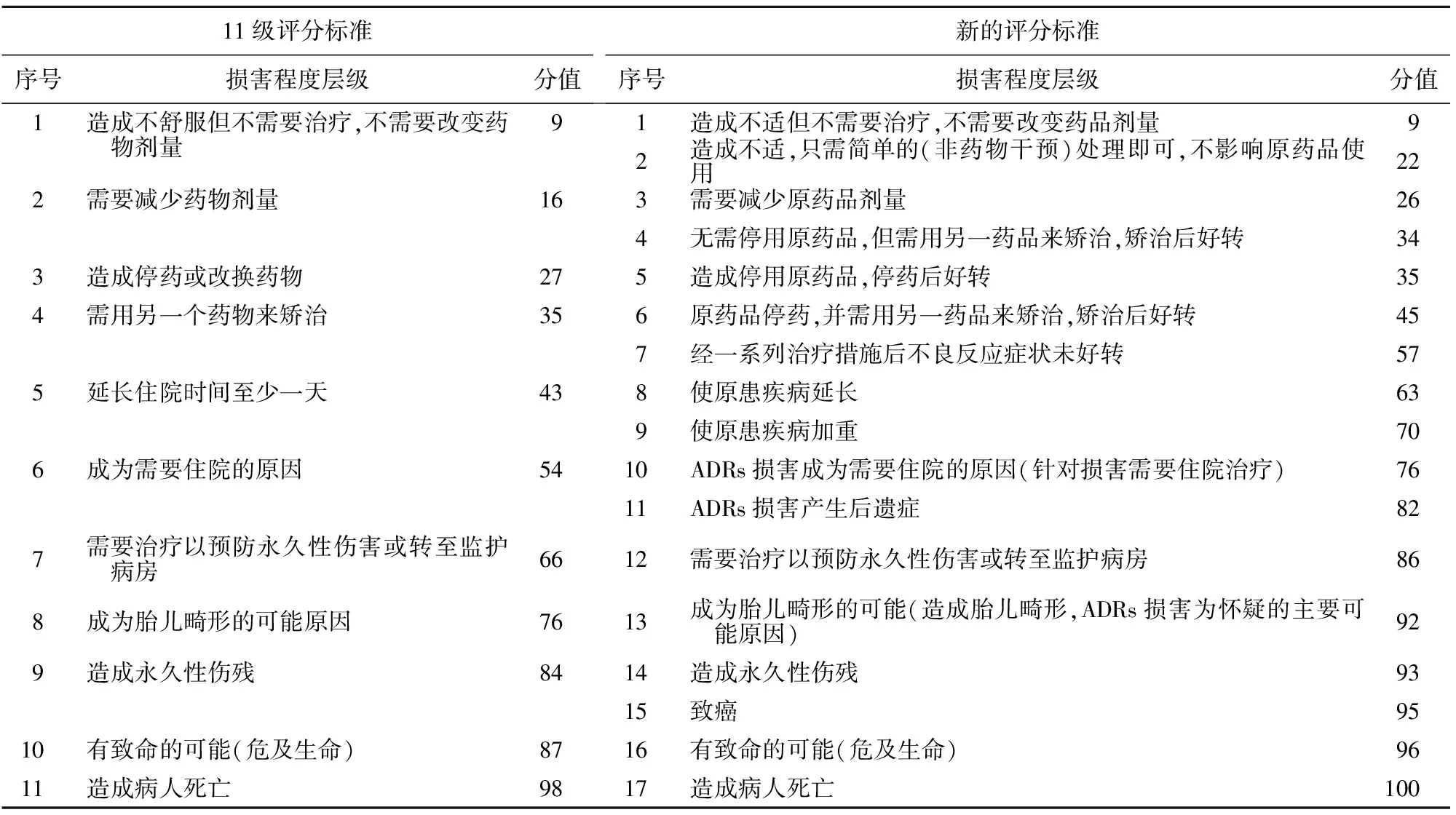
表1 11级和新的ADRs损害程度评分标准Table 1 The 11-level standards and the new rating standards for the evaluation of damage caused by ADRs
1 新ADRs损害程度评分标准的制定
1.1 ADRs损害程度的层次划分 通过咨询、查阅资料及谨慎讨论,结合原ADRs损害程度评分标准[2-4]以及海军军医大学长海医院ADRs报表中ADRs损害特点,将损害程度分为17个层级。
1.2 德尔菲(Delphi)法
1.2.1 Delphi法简介 Delphi法是以匿名的方式进行几轮咨询,征集专家们的宝贵意见。组织者对每一轮的意见进行整理分析,再将整理好的资料发放给专家们,供专家参考,得出新的见解。如此进行下去,专家意见将逐渐趋于一致,得到一个相对一致且可靠的方案或结论[5]。
1.2.2 Delphi法的应用 本次调查进行了两轮问卷调查。先制定好第一次调查问卷,发放回收后,将每个指标的四分位数及专家意见附于第二次调查问卷中供专家们参考。第二次调查问卷回收结束后,结合专家们的意见及数据,对制定的17个指标进行了部分修改及分值的确定,得到了新的ADRs损害程度评分标准,见表1。
1.3 Delphi法统计结果
1.3.1 咨询专家一般情况 参与本次专家咨询问卷调查的共20位国内医药卫生专家,他们的学历为大学本科以上;除1人无职称外,其余为药师1名、主管药师及以上10名、助理教授及以上5名、主治医师2名、主管护师1名。14名专家的专业方向为医院药学,6名专家为其他专业。
1.3.2 专家积极程度 第一次问卷调查,共发放20份问卷,实际回收16份,回收率80%。第二次发放问卷16份,实际回收13份,回收率81.25%。有文献表示,回收率>60%为很好,>70%为非常好[6,7]。
1.3.3 专家权威程度 专家权威程度由专家对问题的熟悉程度(Cs),和专家对问题的判断依据(Ca)决定。熟悉程度分为很熟悉、熟悉、一般熟悉、不太熟悉、不熟悉5种。判断依据包含实践经验、理论分析、国内外参考文献和主观直觉。判断系数满分为1[5],见表2,专家权威系数Cr=(Ca+Cs)/2,经计算得到Cr=0.91,权威程度很高。
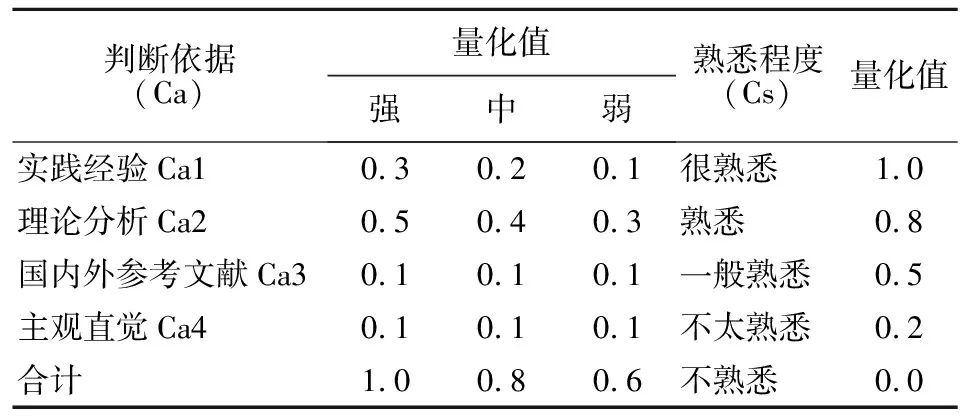
表2 对问题的判断依据和熟悉程度量化表Table 2 Rating table for judgment and familiarity of the problems
1.3.4 专家意见协调程度 专家意见协调程度表示专家对ADRs损害程度每项评价指标分歧是否严重,用协调系数(W)表示。W满分为1,其值越大,表明专家协调程度越高,专家评估结果的可信度越高。用SPSS 16.0软件对专家给出的数据进行卡方检验,两次专家咨询的W分别为0.983和0.997,P<0.05,差异有统计学意义。
2 新的ADRs损害程度评分标准的应用
2.1 ADRs严重度指数 利用李利军等[3]制定的公式SIADRs=∑S/n计算,S指某种药品某ADRs个案的损害程度评分,n指该类药品ADRs报告的例数,SIADRs可以反映该种或该类药品ADRs严重程度的大小,可用于各类药品之间的比较。本次研究将修订后的标准与许佼等[4]制定的11级ADRs损害程度评分标准进行对比。
2.2 1494例ADRs报告的基本情况数据来源 本院2013-01-01至2014-12-31网上自愿呈报的ADRs报告共1596例,通过Excel将以上报告进行处理,删除了重复报告、信息不全及并用药品的报告,实际报告1494例。通过网上自愿呈报分类方法,上述报告按照常规ADRs损害程度级别归类,以及按两种ADRs严重度评分后所得的SIADRs分析情况见表3。
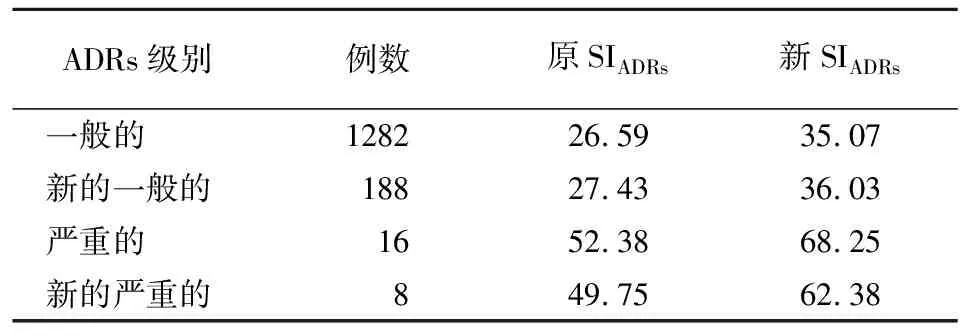
表3 ADRs损害程度级别及两种评分标准的评分值Table 3 Degrees of damage caused by ADRs and evaluation scores by the 2 rating standards
2.3 各类药物的ADRs报告例数和SIADRs排序 本研究依照许佼等[4]已做好的药物分类,本次研究共涉及34类药物。依照两种评价标准分别对每类药物进行评分,并按新SIADRs从高到低排序。原SIADRs排名前4的药物与新SIADRs相同,排名第5位往后便出现差别,见表4。

表4 各类药物的ADRs报告例数和SIADRs排序Table 4 Number of cases of ADRs reports for various drugs and the order of sequence for SIADRs
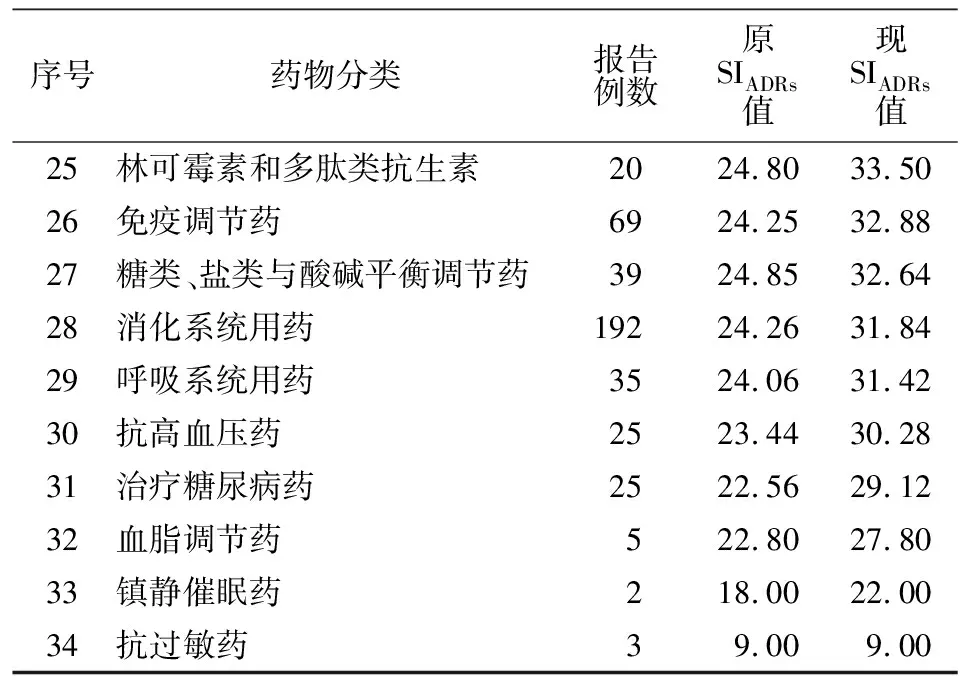
(续表4)
2.4 各种药品ADRs报告例数及SIADRs排序 通过药品的通用名对ADRs报表中包含的药品进行分类,同名不同剂型的药品将分别统计,将药品共分成359种,按新SIADRs降序排列,其中前20位见表5。
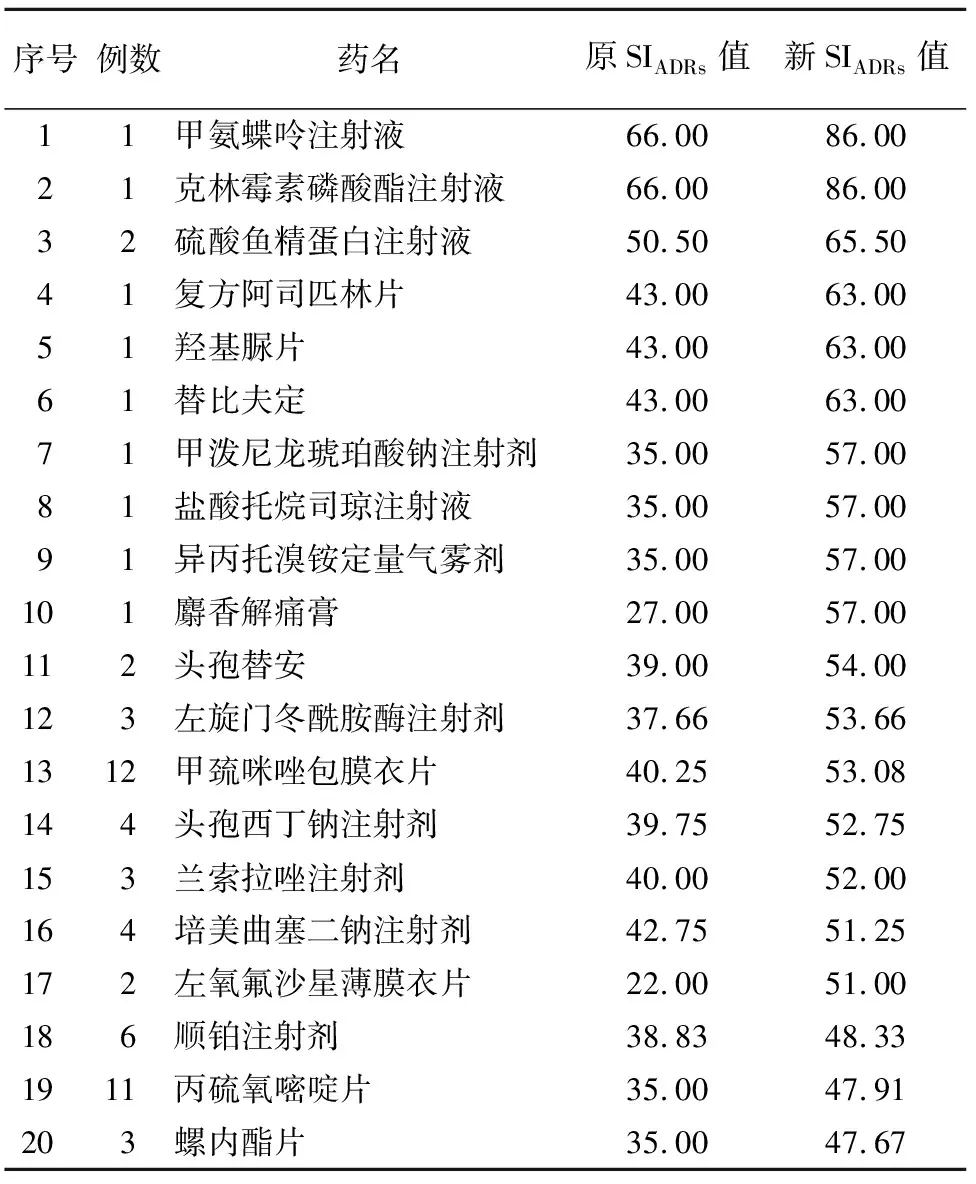
表5 新SIADRs排名前20的药品Table 5 Top 20 drugs by the new SIADRs standard
2.5 按药品剂型分类的ADRs例数及SIADRs排序 1494例ADRs报告中的药品剂型共14种,其中注射液、粉针剂、片剂占比较高。按新SIADRs值排序得表6。
2.6 按给药途径分类的ADRs例数及SIADRs排序 根据文献[8]将本次涉及到的给药途径分为静脉滴注、口服、皮下注射等13种,按新SIADRs值排序见表7。
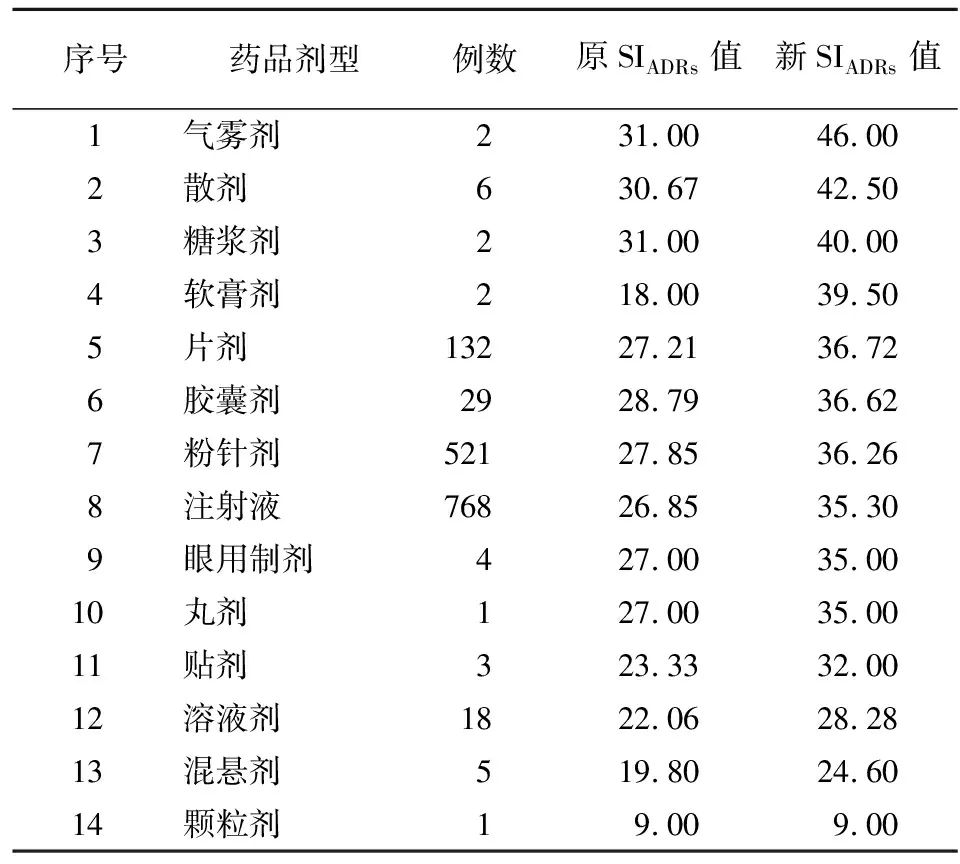
表6 药品剂型的ADRs例数Table 6 Number of ADRs reports by drug dosage forms
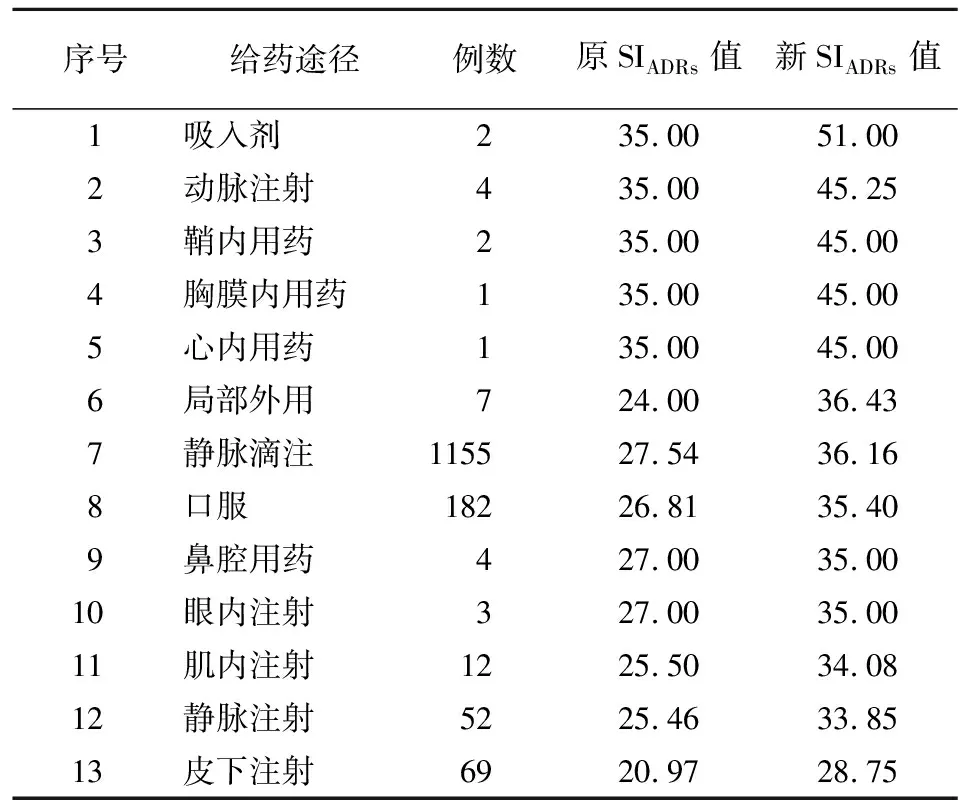
表7 ADRs给药途径的分类及排序Table 7 Classification and ranking of ADRs by application routes
2.7 ADRs累及器官/系统分布的SIADRs排序 根据WHO不良反应术语集[9]将ADRs所累及的器官/系统分为14类。由于ADRs所累及的器官/系统可能有2类以上,所以本次ADRs所累及的器官/系统例数为1740例,超过ADRs报告例数1494例。按新SIADRs值进行排序,见表8。
3 讨 论
3.1 数据可信度分析 两轮问卷调查回收率均超过80%,专家积极性强。专家权威系数Cr为 0.91,远>0.7,权威系数高。专家协调系数W两次测量均接近1.0,卡方检验P值<0.05,专家协调性非常好。说明本次调查所得数据可信度高。
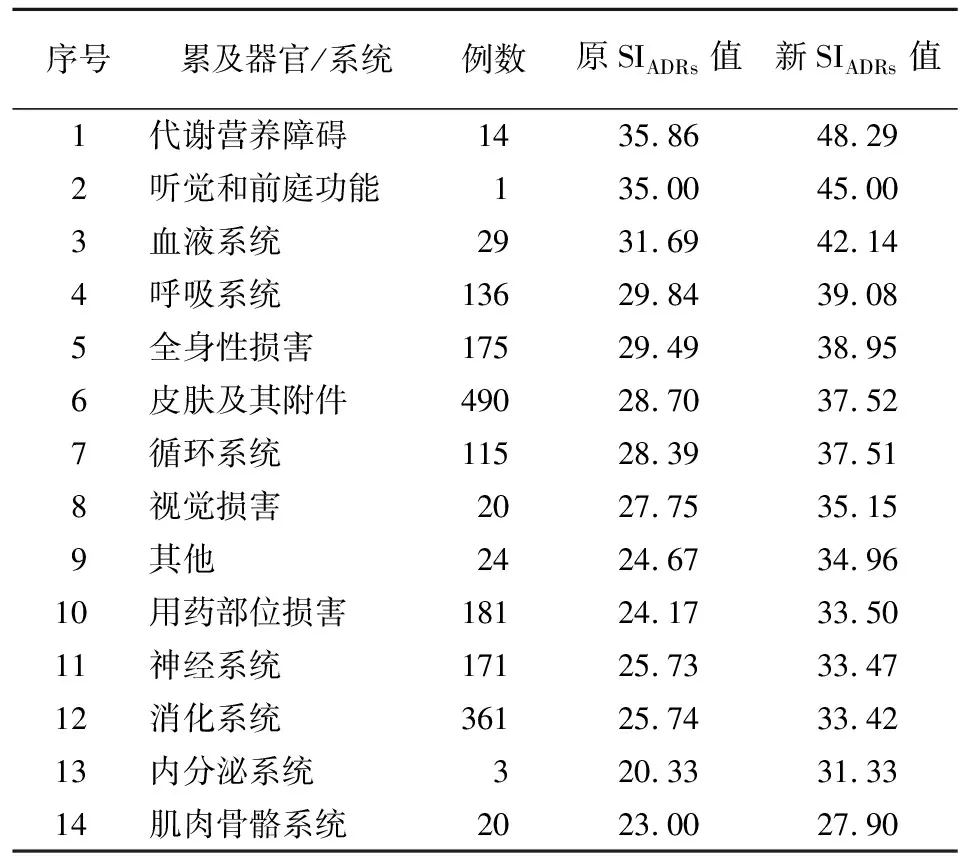
表8 ADRs累及器官/系统的SIADRs排序Table 8 SIADRs ranking of organs/systems associated with the damage by ADRs
3.2 新的、严重的 ADRs比例 1494例ADRs报告中新的、严重的ADRs占14.19%,表明具有警戒信号提取意义的ADRs报告例数不多。
3.3 两种ADRs损害程度评分标准的比较
3.3.1 两种评价标准的理论比较 许佼等[4]制定的ADRs损害程度评分标准指标少,一些ADRs损害情况没有涵盖到,部分指标有交叉重复的地方,专家问卷调查只进行1次,专家权威性、协调性未知。本次制定的新的ADRs损害程度评分标准指标为17项,各指标含义明确,基本无交叉重复的地方,问卷调查采用Delphi法,以匿名的方式让各个专家充分展示自己的观点,得到的专家数据可信度较高。
3.3.2 两种评价标准的应用比较 (1)原评价标准指标有交集重复的地方,会影响评分者的判断。比如ADRs描述为“导致肾损伤,使原患疾病加重”,两个独立评分者分别选择了“延长住院的时间至少1 d”和“需要治疗以预防永久性伤害或转至监护病房”这两个指标。从而会导致ADRs药品SIADRs值偏高或偏低,而新评分标准里用“使原患疾病加重”这个指标则完全吻合。(2)原评分指标涵盖不全,会影响药物的SIADRs值。比如抗帕金森病及治疗其他运动障碍性疾病药引起的ADRs描述为“在使用原药的基础上,通知医师予甘油果糖静滴后好转”。用原评价标准无法找到与之匹配的指标,只能选择“需用另一药物来矫治”这个指标。在这个指标中描述的是在停药、对症处理后使病人恢复,但该ADRs并未停药,所以会导致该药品原SIADRs值偏高。
3.4 新的ADRs损害程度评价标准的应用与评价
3.4.1 ADRs发生例数 由表3~6可以发现,药品的SIADRs与其发生的例数不成正比,故目前常规仅按照例数来上报ADRs的个案信息,只能提示该药品ADRs发生频次(并非发生率)的相对高低,而且无法反映其ADRs造成损害程度的大小。一般来说,评价某药品的总体安全性,一方面要考虑其发生ADRs的频次,另一方面也应考虑其ADRs造成的损害大小。故现有ADRs日常呈报信息尚缺乏此类评价ADRs造成损害程度的详细信息,更无量化评价指标。本系列研究提出的ADRs损害量化评分标准,及由其计算得出的ADRs损害严重度指数SIADRs,虽然仍存在许多不足,但也为此方面研究做出了有益尝试。
3.4.2 ADRs药品种类与累及器官/系统 ADRs损害程度大而且例数多的药品以肿瘤药、甲状腺类药品居多。ADRs累及器官/系统新SIADRs值排名前3中,代谢营养障碍引发的药品以甲状腺类药品居多;听觉和前庭功能障碍仅一例,引发药品为肾上腺皮质激素类药;血液系统损害引发药品以抗肿瘤药、抗甲状腺类药及肠内外营养药居多。
3.4.3 ADRs药品剂型与给药方式 临床上给药方式以静脉滴注和口服为主。用于静脉滴注的药品主要为注射液和粉针剂,由于药品直接进入血液,输液中pH值、内毒素、微粒等因素导致静滴时ADRs发生率高。ADRs发生率还与药品浓度、药液稳定性、给药间隔时间、静脉给药滴注速度等密切相关。口服药品的SIADRs<静脉滴注药品的SIADRs,建议临床给药时,应尽量减少静脉给药,多以口服方式给药。
3.5 当前ADRs损害程度评价标准的不足 ADRs损害情况本身具有极度复杂性,尤其是本文提到的分级评分标准全部采用描述性的分级方法,如在制定分级标准时尽可能将所有可能的损害情况列出,则会大大降低临床实用的便利性。本文对1494例ADRs报告的SIADRs按照两种分级评分方法进行了比较,SIADRs容易受到当批ADRs报告例数及其各药品不同损害程度的报告数组成影响,只能在一定程度上反映药品总体的ADRs严重程度。利用合理的分级评分方法对描述中“后遗症”、“癌”、“永久性伤残”等范畴较大的损害进行合理的细化,是提高ADRs损害分级评分标准的实用性和科学性的发展方向。

