冬凌草甲素纳米粒的制备及其在大鼠体内的药动学研究
庄倩楠, 韩 特, 吴超男, 王晓丹, 郝吉福
(泰山医学院药学院药剂学教研室,山东泰安271016)
冬凌草甲素(oridonin)是由唇形科香茶菜属植物中提取分离得到的,以贝壳杉烯为骨架的四环二萜类化合物[1]。现代研究表明,冬凌草甲素具有多种药理作用,如抗肿瘤、抗炎和抗菌等[2]。但冬凌草甲素水溶性差、生物半衰期短的缺点限制了其在临床的应用;因此,如何提高其生物利用度成为亟待解决的问题。纳米递药系统近年来成为人们关注的热点,尤其是在改善难溶性药物的水溶性、提高生物利用度方面发挥着重要作用[3]。聚乳酸(PLA)-羟基乙酸(PGA)共聚物[poly(lactic-co-glycolic acid),PLGA]作为一种被FDA批准的高分子材料,具有良好的生物相容性、生物可降解性与操作可控性,已广泛用作制备纳米粒的载体材料[4]。本研究以冬凌草甲素为模型药物,以PLGA为载体材料制备荷载冬凌草甲素的PLGA纳米粒,并对其理化性质、体内药动学特征进行研究,以期为该药物的进一步开发利用提供参考。
1 材 料
1.1 仪器 JY92-Ⅱ探头超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);超速冷冻离心机(日本日立公司);Mastersizer 3000 粒度分析仪(英国马尔文公司);VP-10A plus高效液色谱仪(日本岛津公司);XW-80A微型漩涡混合器(上海医大仪器厂);FDU-1200台式冷冻干燥机(日本东京理化株式会社);DCY-24Y圆形水浴氮吹仪(南京肯凡电子科技有限公司);JEM-1200EX透射电镜(日本电子株式会社)。
1.2 药品和试剂 冬凌草甲素(纯度98%,批号20150709,西安昊轩生物科技有限公司);冬凌草甲素对照品(纯度99.7%,批号111721-201704,中国食品药品检定研究院);PLGA(PLA∶PGA=50∶50, 相对分子质量为55 000,批号20160312,济南岱罡生物材料有限公司);聚乙烯醇(PVA,美国Sigma Aldrich公司);其余试剂均为色谱纯或分析纯。
1.3 动物 雄性SD大鼠,体质量(230±20) g,购自济南朋悦实验动物繁育有限公司,实验动物合格证号SCXY(鲁)20140007。
2 方法和结果
2.1 冬凌草甲素PLGA纳米粒的制备 采用乳化超声-溶剂挥发法制备荷载冬凌草甲素的PLGA纳米颗粒[5]。精确称取10 mg冬凌草甲素,100 mg PLGA,共同溶于4.5 ml乙酸乙酯中作为油相,以0.25%的PVA水溶液20 ml作为水相,在磁力搅拌下将油相加入到水相中,置探头式超声粉碎仪超声3 min(超声功率400 W),形成外观均一的乳剂。旋转蒸发以除去残留的有机溶剂,所得到的纳米混悬剂以1.002×104×g超速离心15 min,弃去含有游离药物的上清液,沉淀用蒸馏水分散,洗涤两次,收集沉淀,加入3%甘露醇作为冻干保护剂进行冷冻干燥,得冬凌草甲素PLGA纳米粒,备用。同法制备不含冬凌草甲素的PLGA空白纳米粒。
2.2 理化性质的表征 取将制备的冬凌草甲素PLGA纳米粒冻干加入适量蒸馏水分散,稀释,用激光粒度分析仪测定其粒径分布。将冬凌草甲素PLGA纳米粒稀释后滴加在覆盖碳膜的铜网上制样,以2%磷钨钼酸进行负染,透射电镜观察其粒径形态。结果表明所制备的冬凌草甲素PLGA纳米粒平均粒径为180 nm,多分散指数(PDI)为0.103,外观呈规则球状,无粘连。粒径分布及透射电镜结果见图1。
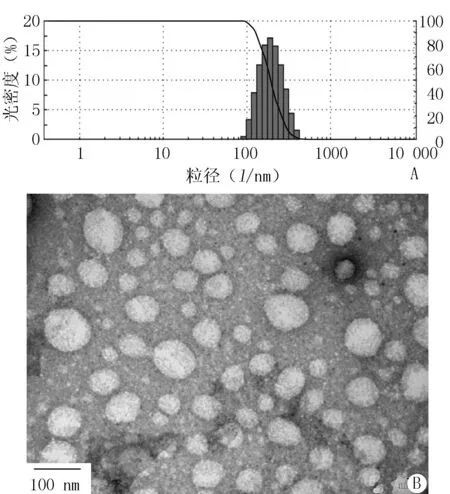
图1 冬凌草甲素PLGA纳米粒粒径分布及透射电镜图Figure 1 Particle size distribution and transmission electron microscopy of oridonin PLGA nanoparticlesA:粒径分布图;B:透射电镜图;PLGA:聚乳糖-羟基乙酸
2.3 包封率及载药量的测定
2.3.1 冬凌草甲素含量测定色谱条件 色谱柱:Hypersil C18柱(250 mm×4.6 mm,5 μm),预柱(4 mm×4 mm,5 μm);流动相:甲醇-水(60∶40);检测波长:238 nm;流速:1 ml/min;柱温:30 ℃;进样量:20 μl。
2.3.2 标准曲线的制备 精密称取冬凌草甲素对照品9.8 mg至10 ml容量瓶,用甲醇溶解并定容,摇匀,作为储备液。分别精密量取冬凌草甲素对照品储备液0.1、0.5、1.0、2.0、5.0 ml置10 ml容量瓶中,以流动相稀释并定容至刻度,进样测定。以峰面积(A)为纵坐标,浓度(c)为横坐标进行线性回归,得回归方程为:A=10 621c-2 736(r=0.999 8),结果表明冬凌草甲素在9.8~490 μg/ml范围内线性关系良好。
2.3.3 含量测定方法学考察 精密称取空白纳米粒冻干品适量, 加氯仿超声溶解, 1×104×g离心15 min后分取上清液,定量加入冬凌草甲素对照品储备液适量,配制浓度分别为0.05、0.25 和0.45 mg/ml的溶液各5份,置氮吹仪中挥干溶剂,残渣用流动相溶解并稀释至浓度为0.05、0.25 和0.45 mg/ml,经0.22 μm滤膜过滤后,取滤液20 μl进样测定,评价测定方法的精密度、稳定性及回收率。结果低、中、高3个浓度下测得的精密度分别为97.6%、99.3%和98.5%,RSD 分别为2.36%、1.57%和2.64%(n=5)。稳定性实验结果表明冬凌草甲素在12 h内稳定,RSD均<3%(n=5)。空白回收率分别为97.1%、98.2%和97.9%,RSD分别为3.18%、1.90%和2.30%(n=5)。
2.3.4 包封率及载药量的测定 精密称取冬凌草甲素PLGA纳米粒冻干粉适量,加入氯仿后超声溶解,将得到的溶液置于氮吹仪中除去溶剂,残渣用流动相溶解并稀释至一定浓度,经0.22 μm滤膜过滤后按2.3.1项下色谱条件进样测定并记录峰面积,根据标准曲线计算得到的冬凌草甲素含量作为包载于PLGA纳米粒内的药量(m包载),根据投药量(m总量)及所用PLGA的重量(mPLGA),分别按下列公式计算包封率(entrapment efficiency,EE)与载药量(drug loading,DL)。EE(%)=(m包载/m总量)×100%,DL(%)=[m包载/(m总量+mPLGA)]×100%。结果表明,冬凌草甲素的包封率及载药量分别为(87.7±7.7)%及(7.5±0.8)%(n=3)。
2.4 大鼠体内药动学评价
2.4.1 血浆样品处理方法 精密吸取血浆样品100 μl,置1.5 ml离心管中,精密加入乙腈300 μl,涡旋3 min混合均匀,超高速离心机1.002×104×g离心10 min,取上清液20 μl进样分析。
2.4.2 血浆样品中冬凌草甲素含量测定方法
2.4.2.1 色谱条件 同2.3.1项下色谱条件。
2.4.2.2 方法专属性考察 分别取受试大鼠的空白及含药血浆100 μl,按2.4.1项下方法处理血浆样品,进样20 μl测得空白及含药血浆的色谱图。结果表明,血浆中的内源性物质不干扰冬凌草甲素的测定,冬凌草甲素色谱峰的保留时间约为6.2 min,结果见图2。
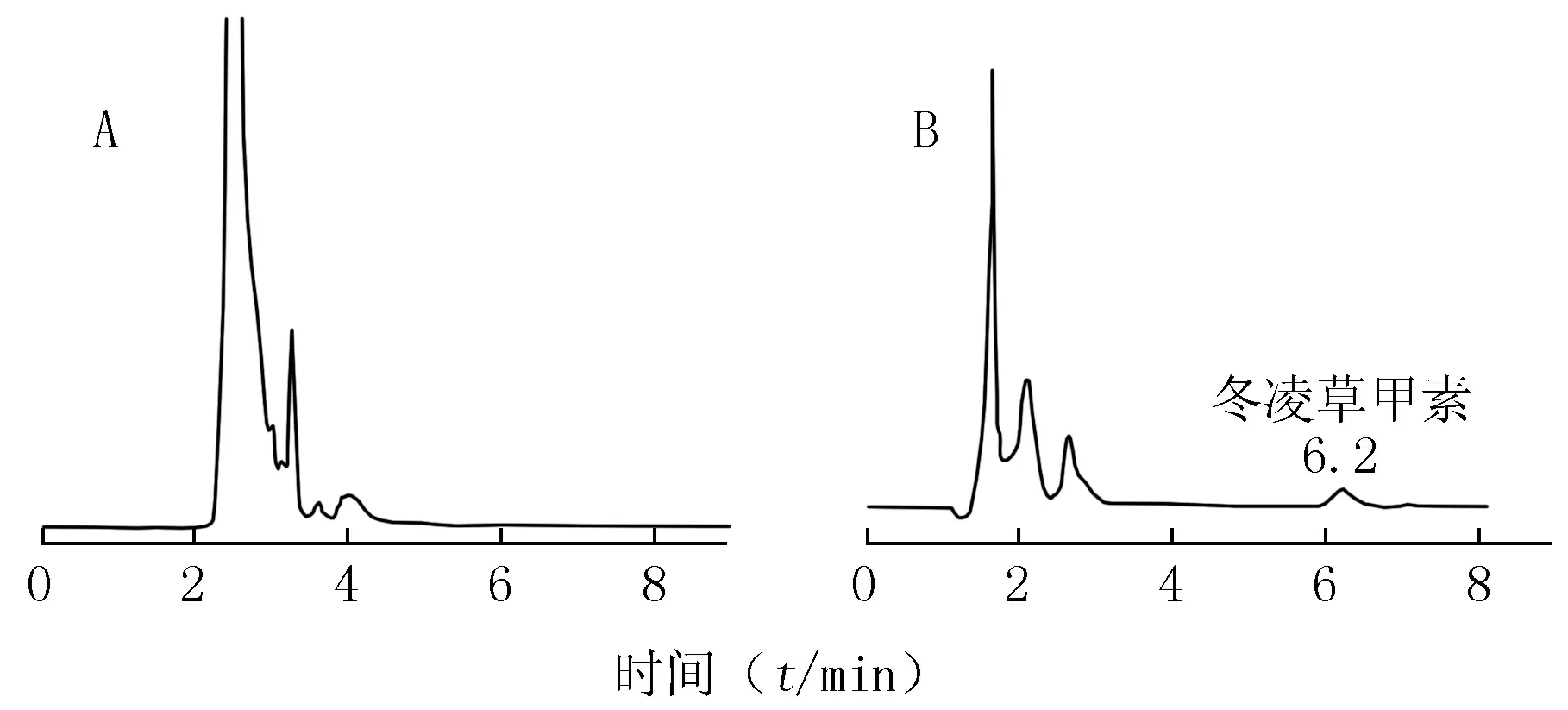
图2 冬凌草甲素的HPLC谱图Figure 2 HPLC chromatograms of oridoninA:空白血浆;B:含药血浆
2.4.2.3 血浆样品测定的方法学考察 精密称取冬凌草甲素对照品5.11 mg 置10 ml 容量瓶中,加适量甲醇使其充分溶解并定容至刻度,得511 μg/ml的标准储备液,再稀释成梯度浓度分别为0.303、6.06、12.12、24.24、30.3 μg/ml的对照品溶液备用。取空白血浆50 μl共5份,加入上述系列浓度的冬凌草甲素对照品溶液100 μl,制备成含药血浆对照品溶液,按2.4.1项下方法处理后进样分析,得回归方程为:A=11 012c+4 083(r=0.999 8)。结果表明冬凌草甲素在0.202~20.2 μg/ml范围内线性关系良好。精密度、稳定性及加样回收率实验测得的RSD均<10%,能满足生物样品的测定要求。
2.4.3 大鼠体内药动学实验 取SD大鼠5只,实验前禁食12 h 以上,自由饮水。尾静脉注射2.1项下制备的冬凌草甲素PLGA纳米粒混悬液0.6 ml, 给药剂量为4 mg/kg,分别于给药后0.5、1、2、3、4、8、10、24 h眼内眦取血约0.2 ml,置于肝素化离心管中,2.8×103×g离心10 min。分取血浆,按2.4.1项下方法处理,绘制血药浓度-时间曲线,结果见图3。
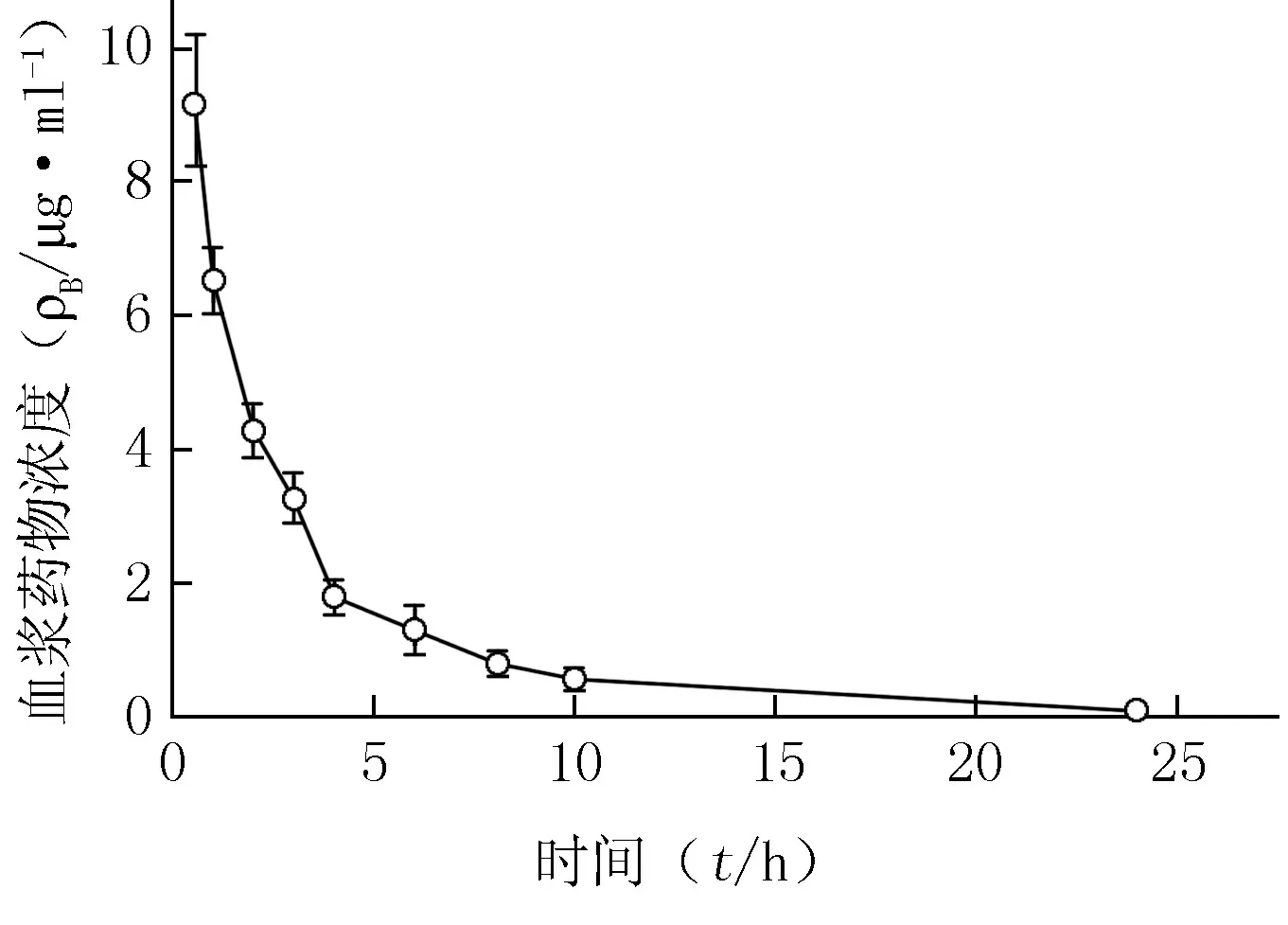
图3 大鼠尾静脉注射冬凌草甲素PLGA纳米粒后的平均血药浓度-时间曲线Figure 3 The mean plasma concentration-time curve oforidonin after intravenous administration of oridonin PLGA nanoparticles through caudal vein in ratsPLGA:聚乳糖-羟基乙酸;
将所得到的平均血药浓度-时间数据用DAS(Drug and Statistics)软件进行房室模型拟合,并计算药动学参数。以拟合优度值、Akaike’s information criterion(AIC)确定合适的模型。结果表明,大鼠尾静脉注射冬凌草甲素PLGA纳米粒后,其体内过程符合二室模型。主要的药动学参数如下:分布半衰期(t1/2α)为2.115 h,消除半衰期(t1/2β)为69.315 h,血药浓度曲线下面积(AUC)为42.463 mg·h·L-1,清除率(CL)为0.094 L·h-1·kg-1,表观分布容积(V)为0.4 L/kg。
3 讨 论
冬凌草甲素的结构特点决定了其难溶于水。为改善冬凌草甲素的水溶性并提高生物利用度,近年来有关其制剂的研究包括制备成包合物、长循环脂质体、固态脂质纳米粒等剂型。在本研究中,结合冬凌草甲素易溶于氯仿、乙酸乙酯等有机溶剂的性质,利用生物可降解材料PLGA为载体材料,将冬凌草甲素及PLGA共同溶解在乙酸乙酯中作为油相,加入到含有稳定剂PVA的水溶液中,通过超声分散,能够形成包含药物及PLGA载体材料的小油滴,通过溶剂挥发,可以降低PLGA与冬凌草甲素的溶解度,以骨架型结构共同析出形成纳米粒。在制备PLGA纳米粒的前期工作中发现,PLGA纳米粒的理化性质与PLGA的规格、药物与PLGA的比例、稳定剂PVA的浓度、超声时间与超声功率等有关系。PLGA的分子量越大,越易形成纳米粒,但分子量越大,其降解速度越慢,如考虑发挥长效缓释作用可以选择分子量较大的PLGA。当处方中PLGA的比例较高时,可以增加对药物的包封率,但相应地会影响载药量。而PVA除了作为乳化剂降低油水两相之间的表面张力,有利于形成乳剂之外,还可以分散在油滴之间,阻碍油滴与油滴之间的聚集,防止在溶解挥发过程中油滴相互合并而增大粒径。同时,在制备过程中超声功率越大、超声时间越长,能够为体系的乳化环节提供更大的机械能,可以使油滴分散得更细腻、更均匀,有利于减少纳米粒的粒径[6]。
大鼠体内药动学结果经DAS药动学软件分析,分别按照一室、二室及三室模型进行拟合,其中二室模型的AIC 值最小,提示在该实验条件下, 静脉注射冬凌草甲素PLGA纳米粒的药动学模型符合二房室模型,权重为1/C2时拟合最好。其中冬凌草甲素的分布半衰期、消除半衰期分别为2.115和69.315 h,表明以消除过程为主,同时消除半衰期接近70 h,体现出冬凌草甲素PLGA纳米粒在体内具有较好的缓释特点。在以后的工作中需要进一步比较和评价冬凌草甲素PLGA纳米粒与普通冬凌草甲素制剂的特点及其抗肿瘤作用。

