药物涂层球囊微粒兔肾栓塞风险的探讨
宋精忠,龙汉,刘艳芬,王阁奇,江巍,王刚
(先健科技(深圳)有限公司,深圳 518063)
近年来血管腔内介入治疗的发展非常迅速,血管内植介入医疗器械使用期间微粒脱落引起了科研人员、临床医师和监管机构的高度重视,特别是药物涂层球囊导管这一类产品,对其微粒脱落的风险评估格外重要。微粒的体外研究主要包括理化特性,如尺寸、形态、溶解性、强度、数量、分布等[1]。一般来说,微粒尺寸越大,风险越高,然而也有文献介绍大量的小微粒所产生的风险和少量的大微粒的风险一样[2]。可见,体外模拟测试无法直接评估微粒的栓塞风险,微粒在体内的行为结果是一个复杂的过程,必须设计体内方法评估。
Kolodgie等[3]在健康猪体内分别植入IN.PACT与Lutonix 035药物涂层球囊,解剖靶部位下游远端肌肉,病理切片观察是否有缺血导致的组织坏死,比较二者栓塞风险。Babcock等[4]通过介入手术对照不同涂层的球囊导管和裸球囊导管,对目标组织(心肌和下游肌肉)和主要脏器进行组织病理学观察,未发现有可见微粒。类似的研究很多,结果大多未发现有明显的微粒栓塞。而在临床实验和真实病例中,仍然有远端肌体的梗死或坏疽,这些临床表现可能与器械微粒有一定的关系。分析原因可能是设计的临床前动物试验评估微粒风险的分辨力不足,得到了假阴性的结果。
肾由肾动脉供血,肾动脉是腹主动脉的分支,肾动脉二级支之间不吻合,肾远端血管无代偿,独立供应一定区域的肾实质。肾是高灌注器官,对缺血性栓塞较敏感[5]。从肾血管解剖结构分析,如果肾动脉发生栓塞,则会影响到远端供血,从而导致整个肾组织坏死;如果肾动脉远端的侧枝(如叶间动脉)发生闭塞,则会导致肾局部区域的坏死,因此选择肾作为本次试验的主要观察对象。
本研究通过股动脉入路,将药物球囊导管输送至兔腹主动脉,在近心端扩张,将微粒尽可能的引导进入双肾,在设定的时间点观察双肾是否有堵塞、坏死等异常现象。以此评估药物球囊在动物体内是否有产生栓塞的风险,并探索建立兔肾坏死程度的度量标准,以及闭塞的血管直径与微粒粒径的对应关系。
1 材料与方法
1.1 材料
1.1.1 实验动物
21只普通级新西兰兔,10周龄,体重2.0 ~ 2.5 kg,雌雄不拘,购于南方医科大学实验动物中心【SCXK(粤)2011-0015】。实验地点为先健科技(深圳)有限公司动物实验室【SYXK(粤)2016-0153】。实验方案经先健科技(深圳)有限公司实验动物管理和使用委员会IACUC的伦理审查及审批【TP082-002】。
1.1.2 实验试剂
戊巴比妥钠(美国Sigma);甲基丙基酸甲酯(天津大茂);过氧化苯甲酰(天津大茂);甲醛(西陇化工);二甲苯(天津大茂);伊红(碧云天);苏木素(碧云天);氨苄西林钠(哈药集团兽药厂);无水乙醇(安徽安特)。
1.1.3 实验仪器
自动组织处理脱水机(Leica ASP200S,德国);自动染色机(Leica ST5020,德国);包埋机(Leica EG1150C德国);摊片机(Leica HI1210,德国);石蜡切片机(Leica RM2235,德国);显微测量系统(Leica DM2500,德国);数字病理切片扫描仪(Pannoramic SCAN,匈牙利)。
1.1.4 实验样品及分组
试验样品为自制冠脉药物球囊及冠脉裸球囊,规格分别为3.0 mm × 40 mm及3.0 mm × 20 mm。实验动物随机分组,分组信息如下表1。

表1 实验分组及动物编号Table 1 Grouping and number of animals in this experiment
1.2 方法
1.2.1 手术方法
实验动物固定,经兔耳缘静脉推注3%戊巴比妥钠(1 mL/kg)麻醉,腹股沟区域备皮消毒,切开皮肤逐层分离,分别暴露双侧股动脉,穿刺后置入导丝。沿一侧导丝输送裸球囊(封堵用球囊)至腹主动脉双肾的远心端,沿另一侧导丝输送药物球囊(试验用球囊)至腹主动脉双肾的近心端,确保肾动脉通畅。
实验时,先充盈裸球囊,维持充盈压力,堵住腹主动脉的远端,然后扩张药物球囊。药物球囊反复充盈/泄压2次,依靠血压的作用,使过程中产生的微粒尽可能的流入肾。扩张完毕,裸球囊卸压并撤出体外,药物球囊随后撤出。B组三倍剂量实验,在药物球囊扩张完成以后,裸球囊泄压但不撤出,药物球囊撤出后再植入下一个药物球囊,直到三个药物球囊全部植入完毕,裸球囊最后才撤出。D组裸球囊对照试验,近心端腹主动脉的试验球囊也使用裸球囊,并反复充盈/泄压2次。E组空白对照试验,对兔不做任何处理,正常饲养。
所有器械撤出体外后,结扎穿刺点近端和远端,缝合创口,待实验动物自然苏醒后送回饲养间,每天喂食抗凝药。实验动物饲养至表1中预定时间时,静脉注射肝素抗凝,空气栓塞法处死,切开腹部,暴露肾,肉眼观察肾是否有异常,随后取出肾,用10%甲醛溶液固定。
1.2.2 组织切片
将4%甲醛固定后的组织标本修整好,流水充分冲洗后,再依次用70%、80%、90%、95%(每个浓度下20 min)及100%(共两次,每次10 min)酒精梯度脱水,石蜡包埋切片,切片厚度5 μm,进行常规苏木精-伊红染色(H&E染色)。将切片在光学显微镜下或用数字病理扫描仪扫描后进行观察。
2 结果
2.1 实验动物一般情况
实验组和裸球囊对照组手术成功率100%,造模成功,模型可操作性强。所有实验动物均存活至预定观察终点,精神尚好,饮食正常,活动正常。
2.2 肾大体观察
A组7 d时肾表面可见散在白色梗死灶,大小不一。28 d时,肾表面粗糙,遍布大量的小凹坑(图1A)。切开后可见梗死灶肾皮质与髓质界限不清或已累及到近髓质,肾小盏、肾大盏、肾盂及输尿管等其他部位均未见明显异常。
B组7 d 时肾表面有多个较大面积的梗死灶,呈灰白色、凹陷,触感质硬[6]。切开坏死部位,发现坏死部位呈楔形,坏死深度已经接近皮质与髓质的交界处。28 d时,肾体积明显萎缩、不等大,大范围出现较大白色梗死灶,约2 mm × 5 mm(图1B),凹陷较深,已呈现瘢痕化[7]。切开发现坏死部分已延伸到髓质部位。
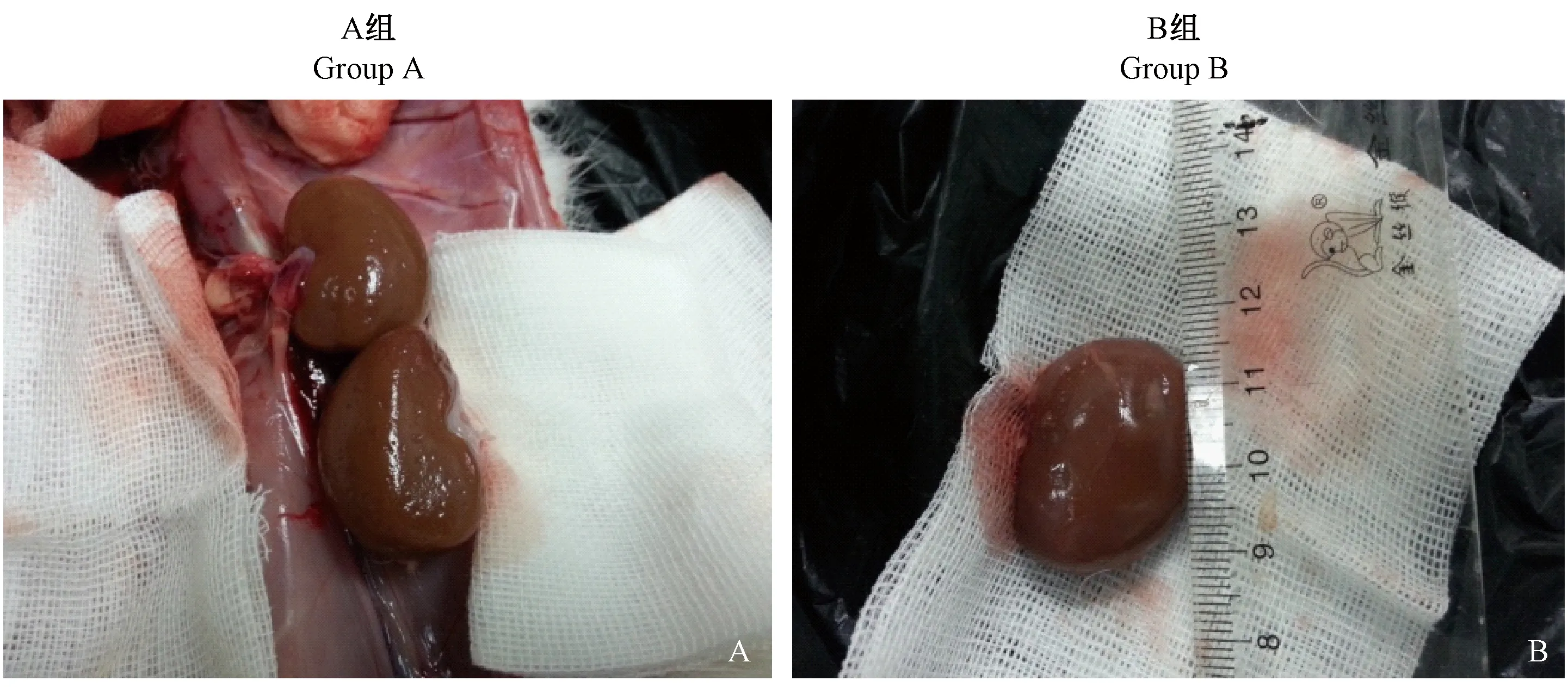
图1 随访时28 d肾大体观察图Figure 1 Gross observation of the 28 d rabbit kidneys at follow-up
C组7 d及28 d各三只兔中,均有一只兔双侧肾未见有明显异常现象。其他病变肾现象是表面散布有极少量白色梗死灶或微小凹点,但数量和整体严重程度要小于A组及B组。D组(裸球囊对照组)和E组(空白对照组)的肾形态、大小、色泽均正常。
2.3 肾病理学检查
对A组(3.0 mm × 40 mm,单倍剂量)7 d异常肾制作H&E染色病理切片,未见炎症,皮髓质界限清晰,在皮质部位可见部分坏死区域,坏死点部位肾小球囊腔内充满红细胞,肾小管上皮细胞死亡,细胞核溶解,细胞结构消失,胞质崩解融合成为一片淡红色均质,疑为皮质层小叶间动脉堵塞,造成肾小管和肾小球缺血缺氧,继而发生坏死[8]。在正常组织与坏死组织交界处可见肾小球充血,其周围小血管也发生充血。交界处肾小管上皮细胞核浓缩,立方上皮细胞萎缩变扁,呈坏死趋势。可见有零散的呈不规则形状的黑色物质分布,在高倍镜下可见黑色物质不具细胞形态(图2A、2B),形貌不规则,疑为药物球囊扩张后掉下来的药物涂层微粒。28 d时,未见黑色物质,在两条皮质迷路之间的髓放线处局部有炎性细胞聚集(图2C、2D)。呈纤维化趋势,炎性灶周围肾小管上皮细胞变性。

图2 A组肾病理图片(3.0 × 40 mm,单倍剂量)Figure 2 Histological changes in the rabbit kidneys of the group A (3.0 mm× 40 mm, single dose)
对B组(3.0 mm × 40 mm,三倍剂量)试验后7 d异常肾进行病理分析可见在肾皮质部位有部分坏死区域,在正常组织与坏死区域交界处肾小球充血(图3A)。肾小管上皮细胞死亡,细胞核溶解,细胞结构消失,胞质崩解融合成为一片淡红色均质,在皮质外层近表面处有黑色物质分布(图3B)。28 d时,未见黑色物质,H&E染色可见梗死灶纵向病变已累及近髓质部分,在皮质近表面凹陷,部分组织已完全坏死呈现纤维化,在未完全坏死部位可见细胞核发生溶解,同时有少量炎性细胞聚集[9],在个别区域发现有肾小球萎缩、结构消失现象(图3C、3D)。
对C组(3.0 mm × 20 mm,单倍剂量,28 d)异常部位进行病理分析,皮质部分未见异常,在皮质和髓质交界处出现少量纤维化,靠近纤维灶边缘肾小管上皮细胞出现脂肪变性,在纤维化组织附近有少量炎性细胞(图4A、4B)。对D组(裸球囊对照组)和E组(空白对照组)的肾病理切片分析,皮髓质分界清晰,肾小球结构正常,无充血,肾小管上皮细胞未见异常,无变性坏死,均正常(图4C、4D)。
此外,通过测量组织发生病变处附近的血管,大致判断栓塞位置的血管尺寸。将切片中有关血管尺寸汇总,阻塞动脉血管位于肾皮质与髓质的交界处,推测为弓形动脉,血管直径大小约为50 μm ~ 200 μm。阻塞动脉血管位于肾皮质内,推测为小叶间动脉,血管直径大小约为20 ~ 50 μm。
3 讨论
肾组织坏死呈现区域性,并非完全坏死,肾动脉通畅,肾门附近正常,说明堵塞并不在肾动脉位置。切开肾坏死部位、并对坏死区域组织做病理切片,发现坏死深度多位于肾皮质内,较少有累积扩散到肾髓质,说明堵塞的位置极有可能位于肾皮质内的血管中,如弓形动脉和小叶间动脉[10]。
针对异常部位制作H&E染色病理切片,7 d时在梗塞部位有呈不规则形状的黑色物质分布,常位于肾小球内,在高倍镜下可见黑色物质不具细胞形态,疑为药物球囊扩张后掉下来的药物涂层微粒。28 d时目视可见遍布大量的凹坑,体积明显收缩,H&E染色可见纵向病变已累及近髓质部分,在皮质近表面处部分组织已完全坏死,呈现纤维化。说明在试验后28 d,栓塞于肾组织中的药物已被吸收或吞噬,而局部组织坏死,导致炎性反应发生,继而发生纤维性修复。在正常组织与坏死组织交界处可见肾小球充血,其周围小血管也发生充血。在未完全坏死部位可见组织细胞核发生溶解,在个别区域发现有肾小球无核现象,同时有少量炎性细胞聚集。
A组和B组肾存在不同程度的梗死灶,B组的坏死区域面积及程度明显比A组的严重,C组坏死的程度明显比A组及B组轻,D组(裸球囊对照组)和E组(空白对照组)的肾均正常。这是由于剂量增加导致产生的微粒数目增加引起的病理学改变。说明兔肾坏死的严重程度与球囊规格及药物剂量有关,大规格球囊及大药物剂量更容易导致肾坏死。
组内比较发现,7 d时多呈现局部的梗死灶,坏死部位仅限于皮质内,未延伸到髓质;随时间的推移,28 d时主要呈现二种现象,一是大范围的小凹坑,二是梗死灶部位内陷形成大凹坑,坏死部位延伸到髓质。说明肾坏死的病理历程是从皮质到髓质,由外及里。兔肾药物微粒栓塞之后,随时间的推移,未见有自愈好转[11]。
通过实验现象归纳,判断微粒栓塞生物学效应的几个观察指标,包括a)病变动物数占比,单肾异常还是双肾异常;b)肾体积是否萎缩;c)表面是否整体粗糙,或出现大量的凹坑;d)出现梗死灶的大小,数量;e)病理切片是否有炎症、细胞坏死,病变延伸程度,肾结构异常等[12]。
邹强等[13]通过介入手术,经导管注入海藻酸钠微球与碘海醇的混合液,对肾动脉进行栓塞,随访造影观察肾动脉栓塞情况,并对肾进行组织病理学观察,用以评价海藻酸钠微球的栓塞性能、降解性和生物相容性。通过肾动脉向肾注射栓塞剂的方式,作为评价栓塞剂性能的模型已经比较成熟,而通过模拟器械使用过程,评价器械使用过程中脱落的微粒在体内的栓塞风险的研究,笔者尚未见有报道。本研究通过设计对照试验发现,实验组肾有不同程度的坏死,异常肾病理都呈现出典型的血管梗塞组织坏死征象,而裸球囊对照组和空白对照组肾均正常。说明设计的动物模型可以用来评估药物球囊在体内的栓塞风险,特别是用于比较产品之间或产品改进前后的微粒栓塞风险。不过,对于微粒栓塞的众多生物学效应指标,本研究尚未确定半定量和定量指标,综合判断微粒栓塞的风险仍需要一定的专业知识和经验。
参考文献
[1] AAMI TIR42: 2010 Evaluation of Particulates Associated with Vascular Medical Devices [S]. AAMI Technical Information Report, 2010.
[2] Bukofzer S, Ayres J, Chavez A, et al. Industry perspective on the medical risk of visible particles in injectable drug products [J]. PDA J Pharm Sci Technol, 2015, 69(1): 123-139.
[3] Kolodgie FD, Pacheco E, Yahagi K, et al. Comparison of particulate embolization after femoral artery treatment with IN.PACT Admiral versus Lutonix 035 paclitaxel-coated balloons in healthy swine [J]. J Vasc Interv Radiol, 2016, 27(11): 1676-1685.
[4] Babcock DE, Hergenrother RW, Craig DA, et al. In vivo distribution of particulate matter from coated angioplasty balloon catheters [J]. Biomaterials, 2013, 34(13): 3196-3205.
[5] Wen X, Murugan R, Peng Z, et al. Pathophysiology of acute kidney injury: a new perspective [J]. Contrib Nephrol, 2009, 165(165): 39-45.
[6] 程新宝,袁曙光. 四氧化三铁微粒栓塞兔肾动脉价值研究 [J]. 实用放射学杂志, 2003, 19(9): 774-776.
Cheng XB, Yuan SG. Research value of embolic rabbit renal arteries by using microspheres of Fe3O4[J]. J Pract Radiol, 2003, 19(9): 774-776.
[7] 朱国庆,虞希祥,肖池金,等.三丙烯微球栓塞肾动脉的实验研究 [J]. 介入放射学杂志, 2013, 22(7): 578-581.
Zhu GQ, Yu XX, Xiao CJ, et al. Tris-acryl gelatin microspheres used as an embolic agent for renal artery embolization: an experimental study in rabbits [J]. J Intervent Radiol, 2013, 22(7): 578-581.
[8] 宋松林.白及微球栓塞兔肾动脉的实验研究 [D]. 华中科技大学,2012.
Song SL. Experimental research of embolization of rabbit renal artery with Bletilla Striata microspheres [D]. Huazhong University of Science &Technology, 2012.
[9] 肖程程,张杰.肾纤维化的细胞和分子基础 [J]. 中国医药导报, 2017, 14(7): 45-48.
Xiao CC, Zhang J. The cellular and molecular basis of renal fibrosis [J]. Chin Med Herald, 2017, 14(7): 45-48.
[10] 朱海云,刘振堂,李兴华. 土贝母皂甙微囊的特性及其用于肾动脉栓塞的实验研究 [J]. 中华放射学杂志, 2001, 35(2): 107-109.
Zhu HY, Liu ZT, Li XH. Characteristics of ethylcellulose microcapsules containing tubeimoside and its usage in the experimental study of renal arterial chemoembolization [J]. Chin J Radiol, 2001, 35(2): 107-109.
[11] 马园园,刘成海,陶艳艳.肾纤维化动物模型特点与研究进展 [J]. 中国实验动物学报, 2018, 26(3): 398-403.
Ma YY, Liu CH, Tao YY. Research progress of animal models of renal fibrosis and their characteristics [J]. Acta Lab Anim Sci Sin, 2018, 26(3): 398-403.
[12] 马艳苗,王永辉,周然. 肾病理损伤评价在实验和临床研究中的应用前景[J]. 世界中西医结合杂志, 2010, 5(3):266-268.
Ma YM, Wang YH, Zhou R, et al. Application prospect of renal pathological injury evaluation in experimental and clinical research [J]. World J Integr Tradit Western Med, 2010, 5(3): 266-268.
[13] 邹强,佟小强,王健,等.海藻酸钠微球肾动脉栓塞的动物实验研究 [J]. 中国医学影像技术, 2008, 24(4): 479-482.
Zou Q, Tong XQ, Wang J, et al. Experimental study of renal artery embolization with alginate microspheres [J]. Chin J Med Imaging Technol, 2008, 24(4): 479-482.

