DTI在慢性肾脏病患者早期肾脏功能损害中的临床应用价值
刘治玲,李 旭,黄召勤,韩 雪
(山东省立医院 山东第一医科大学附属省立医院①医学影像科,②超声诊疗科,山东 济南 250021)
慢性肾脏病(chronic kidney disease,CKD)具有发病率逐年上升、病程长、治疗费用较高、较难早期发现等特点,已成为全球范围内公共健康问题之一[1-2]。目前临床上多用血清肌酐值及估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)评价肾脏功能,但该方法敏感度较低,当数值发生变化时肾脏功能损伤已达一定程度,且无法反映疾病的进展过程[3]。DTI是一种无创的影像学检查手段,可通过部分各向异性(fractional anisotropy,FA)定量评价水分子的流动方向及流动速度,通过ADC体现组织的弥散情况。由于肾脏管状结构(小管、血管及肾盂等)沿肾脏皮、髓质呈放射状分布,液体流动具有一定方向,使得DTI评价肾脏损伤成为可能[4-6]。DTI可显示肾髓质小管的走行方向、长度及数量,已初步应用于肾脏结构的评估[7-8]。本研究重点研究3.0 T MRI DTI及扩散张量示踪成像(DTT)评价CKD患者肾脏功能变化的价值,尤其是对早期、eGFR尚未减低患者的诊断价值。
1 资料与方法
1.1 一般资料 收集我院肾内科住院患者50例(病变组),男37例,女13例;年龄15~62岁,平均(35.9±14.2)岁。其中IgA肾病12例,狼疮肾炎6例,局灶阶段性肾小球硬化4例,膜性肾病18例,微小病变型肾小球肾炎6例,紫癜肾炎4例。纳入标准:结合临床、实验室、影像学及病理检查结果,均满足CKD诊断标准;均排除可能造成肾脏结构、功能改变的系统性疾病,如原发性高血压、糖尿病、其他血管源性的疾病;均无恶性肿瘤病史;发病时间均<3年,超声提示肾脏均无明显的萎缩及纤维化。排除标准:因幽闭恐惧症、大量腹水等无法完成MRI检查、MRI图像上伪影影响分析及MRI图像上皮髓质分界不清者。选择19例无肾脏病及可能造成肾脏损害的系统性疾病的健康人为对照组,男11例,女8例;年龄15~53岁,平均(33.6±11.0)岁。该研究为前瞻性研究,经我院伦理委员会批准,所有参与者均签署知情同意书。
2组均于MRI检查前3 d内测量血清肌酐值。eGFR根据CKD-EPI公式获得[9]。
由于FA值与eGFR呈显著的正相关,按照K/DOQI提出的CKD分期方法,将病变组分为4个亚组:Ⅰ期,eGFR≥90 mL/min;Ⅱ期,eGFR 60~<90 mL/min;Ⅲ期,eGFR 30~<60 mL/min;Ⅳ期+Ⅴ期,eGFR<30 mL/min。本研究Ⅳ及Ⅴ期例数少,且此时治疗以肾脏替代疗法为主,因此将2期患者合并。
1.2 仪器与方法 受检者均于MRI检查前禁食、禁水4 h。采用Siemens 3.0 T MRI扫描仪,以及体线圈加8通道相控阵表面线圈。检查前受检者行屏气训练。首先行双肾MRI常规序列,包括冠状位T2WI TR 1 400 ms,TE 92 ms,层厚5 mm,层距1 mm,层数27,视野380 mm×380 mm,矩阵256×179,回波间隙3.82 ms,采集次数2,带宽781 Hz/pixel);横轴位Fs-T2WI TR 4 070 ms,TE 93 ms,层厚5 mm,层距1.5 mm,层数39,视野380 mm×310 mm,矩阵320×144,回波间隙8.44 ms,采集次数3,带宽260 Hz/pixel;VIBI序列TR 3.92 ms,TE 1.39 ms,层厚3 mm,层距0.6 mm,层块64,视野380 mm×310 mm,采集次数1,矩阵182×320,翻转角9°,带宽400 Hz/pixel。后行双肾冠状位呼吸触发的DTI序列扫描,TR 2 000 ms,TE 90 ms,层厚4 mm,层数11,视野400 mm×400 mm,b=0、400、600 s/mm2,20个弥散方向,矩阵192×192,回波间隙0.77 ms,采集次数2,带宽2 170 Hz/pixel。双肾周放置饱和带。DTI序列的总采集时间4~8 min,主要由受检者呼吸频率及幅度决定。
1.3 图像分析 所有解剖及DTI图像均由1名经验丰富的影像诊断医师采用随机盲法分析,使用Siemens Neuro 3D Task Card软件包。
按照CAUDIANO等[8]的肾脏皮髓质分界方法,在DTI b=0 s/mm2或FA图上对皮髓质分界进行分级:1级,皮髓质分界不清;2级,皮髓质尚可模糊显示或部分模糊显示;3级,皮髓质分界能够清晰显示。本研究仅纳入CMD 2级或3级的DTI图像。
以FA图作为参考,取肾门区域的2层图像为DTI数据测量层面,按LANZMAN等[6]提出的测量方法,避开肾窦及肾周血管,于髓质上手动画5个圆形ROI,每个ROI为10~15个体素;皮质上绘制一个不规则形ROI,形态与皮质形态类似,大小50~100个像素;在中心层取2个ROI(图1),尽量避开囊肿区域。得出每个ROI的ADC值和FA值,计算其平均值。由于eGFR代表平均肾功能,最终计算双肾的平均DTI参数值作为参考值。
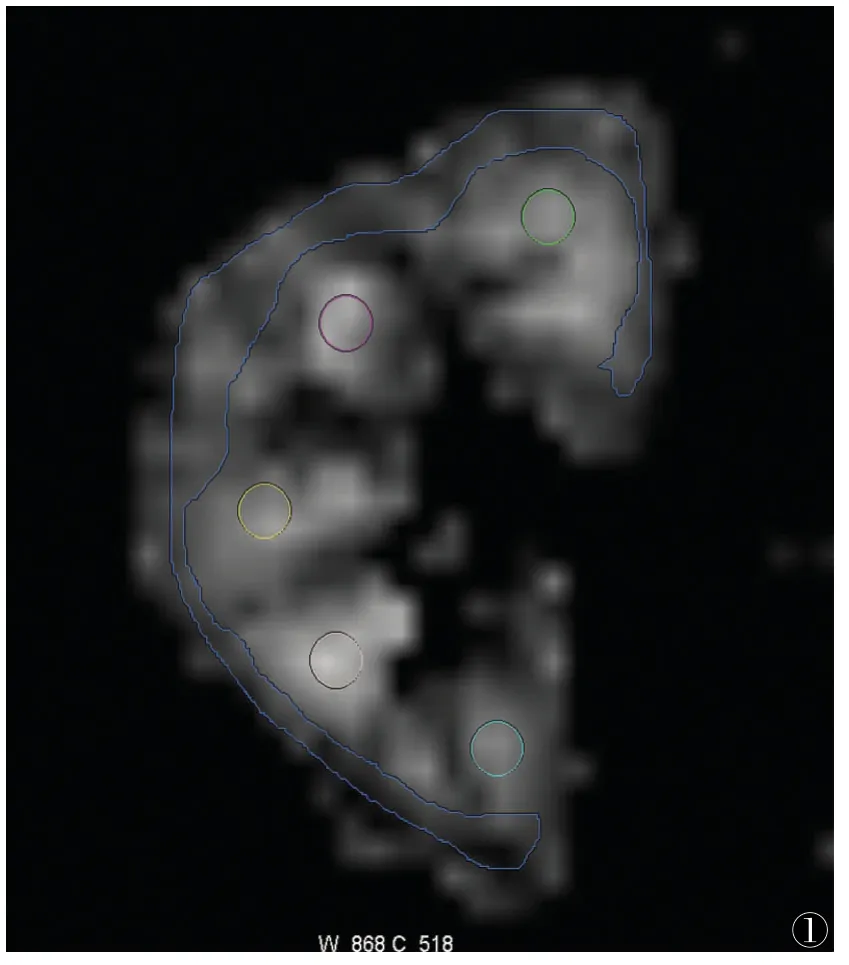
图1 ROI绘制方法示例
DTT能够反映水分子的优先弥散方向,即肾髓小管、血管的走向。选取肾门层面为种子点层面,DTT图像会自动生成,最小FA 0.200,最小角度30°,伪彩标注;观察肾髓质小管及血管的数量、长度及走行。
1.4 统计学分析 使用Prism 5.0(GraphPad Software,Inc.)软件进行数据分析。以P<0.05为差异有统计学意义。
双肾DTI参数值的差别采用配对样本t检验。病变组与对照组间DTI参数值差别采用独立样本t检验。Pearson相关分析检验FA及ADC值与eGFR的相关性;进一步行二次回归分析,eGFR为横坐标,肾脏的DTI参数为纵坐标。
单因素方差分析(ANOVA)评价FA值在不同CKD分期及对照组间的差异,两两比较行Turkey检验。ROC曲线分析比较对照组与CKD Ⅰ期间的差异性。
2 结果
2.1 形态学分析 对照组CMD均为3级,2例检出薄壁小囊肿。病变组因明显图像运动伪影,1例被排除;1例CMD分级1级被排除,余DTI图像CMD分级均为2或3级;10例检出薄壁小囊肿;5例少量腹水。
2.2 2组DTI参数比较(表1,2) 2组左右肾间FA及ADC值差异均无统计学意义(均P>0.05)。2组肾皮质FA值均低于髓质,病变组肾皮质、髓质FA值均低于对照组(均P<0.001)。对照组与病变组肾皮质及髓质ADC值差异均无统计学意义(均P>0.05)。2组DTI参数图图像差别见图2。
表1 2组双肾肾皮质及髓质的FA值比较()
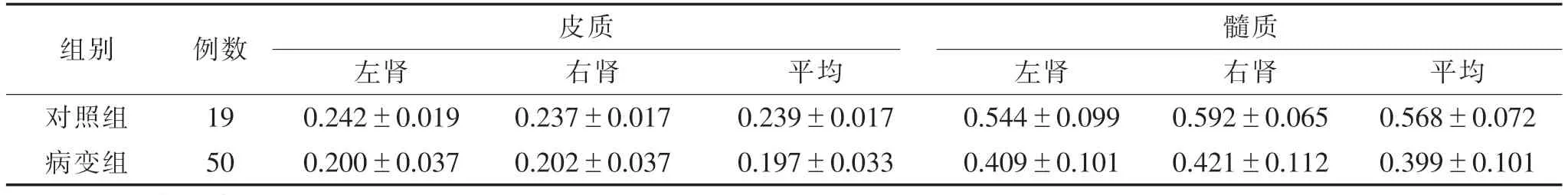
表1 2组双肾肾皮质及髓质的FA值比较()
注:FA,部分各向异性。
表2 2组双肾肾皮质及髓质的ADC值比较(×10-3 mm2/s,)
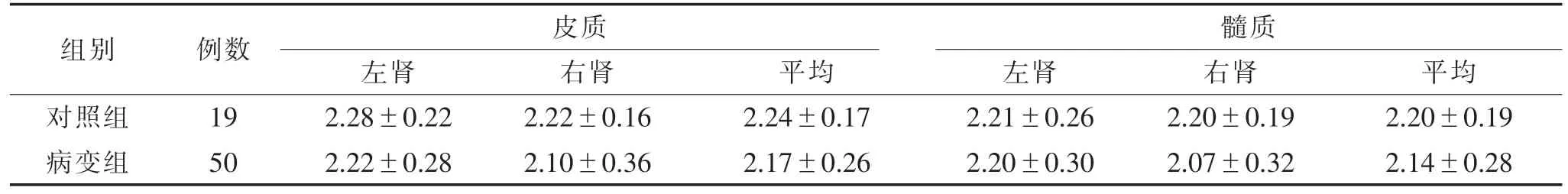
表2 2组双肾肾皮质及髓质的ADC值比较(×10-3 mm2/s,)
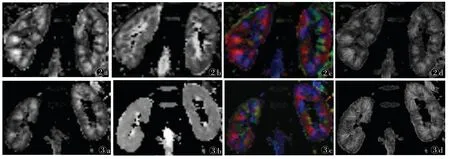
图2 男,37岁,健康志愿者的DTI参数图图3 女,30岁,慢性肾脏病(CKD)患者(病理分型为IgA肾病)的DTI参数图。图2a、3a为灰度标记的各项异性(FA)图,显示皮髓质信号对比明显;图2b、图3b为ADC图,显示皮髓质信号差别较难分辩;图2c、3c为伪彩标记的FA图,伪彩颜色代表纤维束方向,图2c较图3c图方向感更强,髓质放射状形态更形象;图2d、3d为FA纹理图,图2d较图3d图纹理清晰
2.3 CKD患者FA、ADC值变化 ANOVA示不同CKD分期的FA值差异均有统计学意义(皮质:F=26.038,P<0.001;髓质:F=26.611,P<0.001)。且任何临床分期的FA值均低于对照组,包括eGFR尚正常的CKD Ⅰ期患者。不同CKD分期的ADC值差异无统计学意义(皮质,F=1.815,P=0.137;髓质,F=1.790,P=0.142);CKD Ⅰ期与对照组的ADC值差异无统计学意义(P>0.05)(表2,图3)。
病变组的皮、髓质FA及ADC值与eGFR均呈正相关关系(FA:皮质r=0.708,髓质r=0.684;ADC:皮质r=0.355,髓质r=0.380)(图4)。
2.4 FA评价CKD由于CKD Ⅰ期与对照组间FA值差异有统计学意义,2组间进一步行ROC曲线分析:皮质AUC 0.787,最佳截断值0.229 5,敏感度73.33%,特异度84.21%;髓质AUC 0.863,最佳截断值0.532,敏感度83.3%,特异度73.68%(图5,6)。
2.5 DTT评价CKD髓质结构变化 以肾门层面为种子层面的DTT显示健康肾脏肾髓质小管、血管密集放射状分布于肾门及周围,CKD患者肾功能损害,髓质管状结构数量减少、过早中断,且CKD越严重,DTT图像变化越显著(图7~12)。
表2 不同CKD分期患者的DTI参数值()
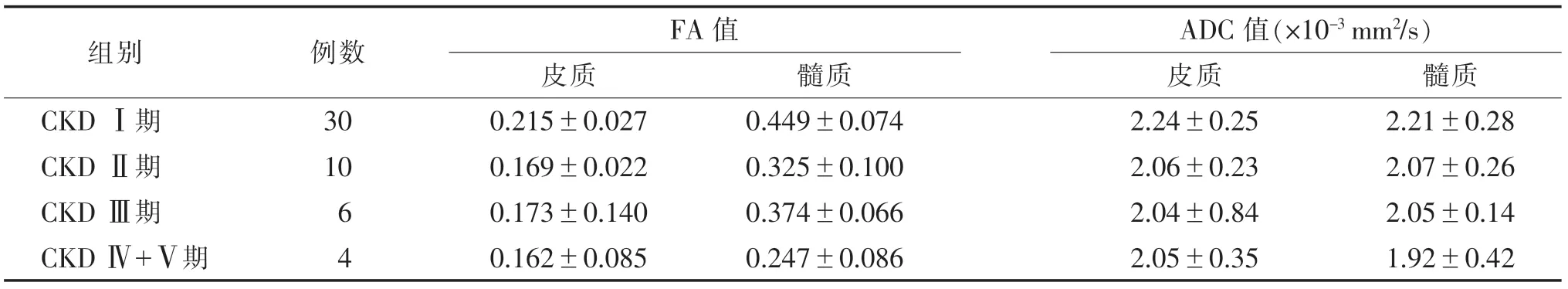
表2 不同CKD分期患者的DTI参数值()
注:CKD,慢性肾脏病。
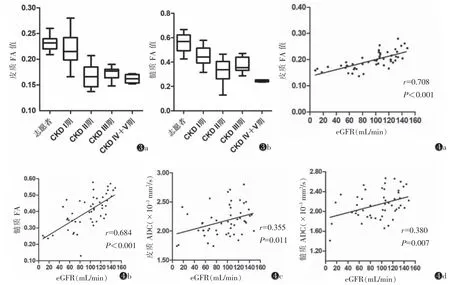
图3a,3b 不同CKD亚组及对照组间的FA值箱式图分布特点图4 肾病组DTI参数值与肾小球滤过率(eGFR)的相关关系散点图图4a,4b eGFR为横坐标,FA值为纵坐标图4c,4d eGFR为横坐标,ADC值为纵坐标。实线表示直线回归趋势
3 讨论
肾脏DTI作为一种无创的MRI检查手段,可在肾脏结构发生变化前评价其生理指标的变化。DTI在自体肾及移植肾肾功能评价方面,其可重复性及稳定性较好,组间差异较小[6,8,10]。本研究重点分析DTI序列评价肾功能的能力,尤其对早期(肾功能正常或升高、临床分期为Ⅰ期、eGFR≥90 mL/min)CKD患者的诊断价值。
本研究采用呼吸门控3.0 T DTI序列,能较好地分辨肾脏皮、髓质,可重复性好,能够达到临床诊断需求[11]。定位时双肾周加6条饱和带,可减少肠管内气体及肠道蠕动产生的图像伪影。本研究仅分析双肾弥漫损害的原发性CKD患者,2组双肾皮、髓质间的DTI参数值均无差异。
2组肾皮质FA值均低于髓质,病变组皮、髓质FA值均低于对照组,原因可能是:①宏观上肾小管、集合管及血管均呈放射状排列,管内的水分子按一定方向流动;②微观上,肾脏小管及血管的排列方向性髓质明显优于皮质,反映水分子弥散方向的FA值皮质小于髓质;③不能忽视组织微灌注对肾脏FA值的影响[5,7-8,12]。因此,当肾脏生理代谢发生变化,影响到肾脏微循环、甚至破坏肾脏的微结构时,均可造成FA值降低。FA值可评价肾功能尚未降低的早期CKD患者,敏感度及特异度较高。
DTT能反映健康者与CKD患者之间肾脏功能结构的变化,重建参数相同时,CKD患者微管状结构数量减少、走行混乱、过早中断,且严重程度能反映疾病的临床分期,与既往研究结论相似[7-8]。
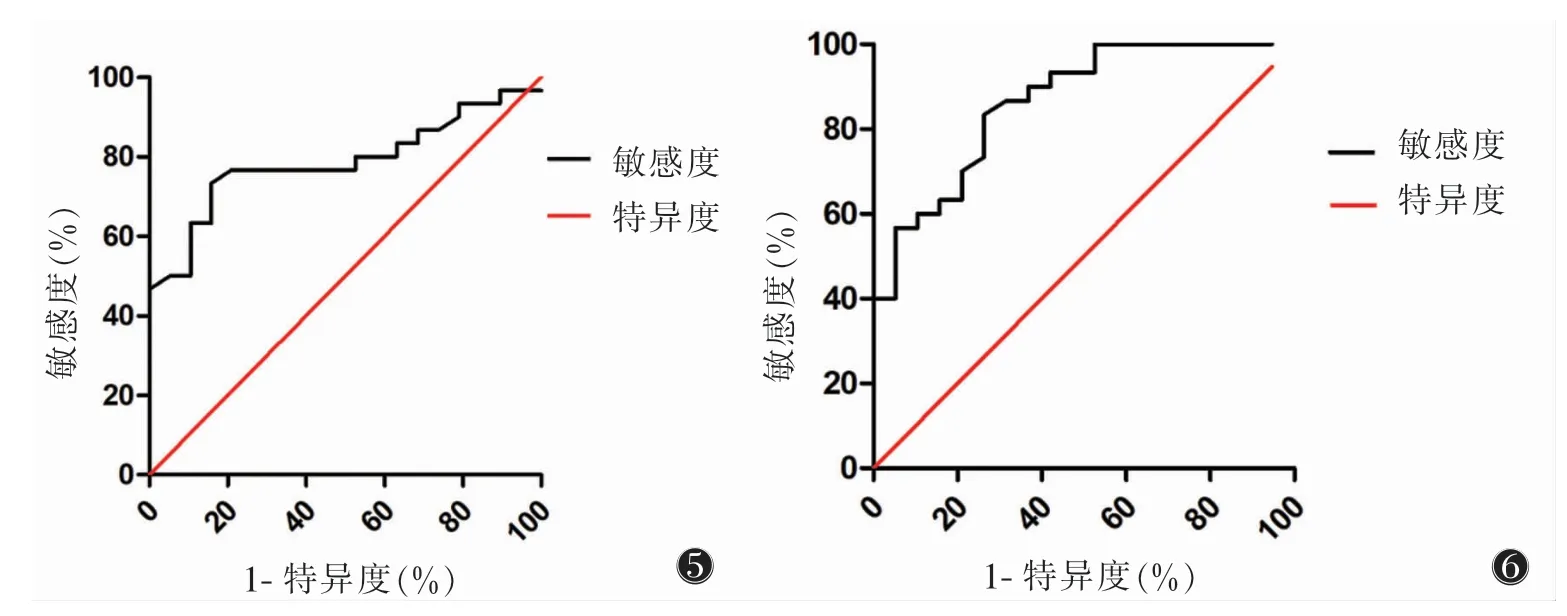
图5 皮质FA值区分对照组与慢性肾脏病(CKD)Ⅰ期患者的ROC曲线,AUC为0.787图6 髓质FA值区分对照组与CKDⅠ期患者的ROC曲线,AUC为0.863
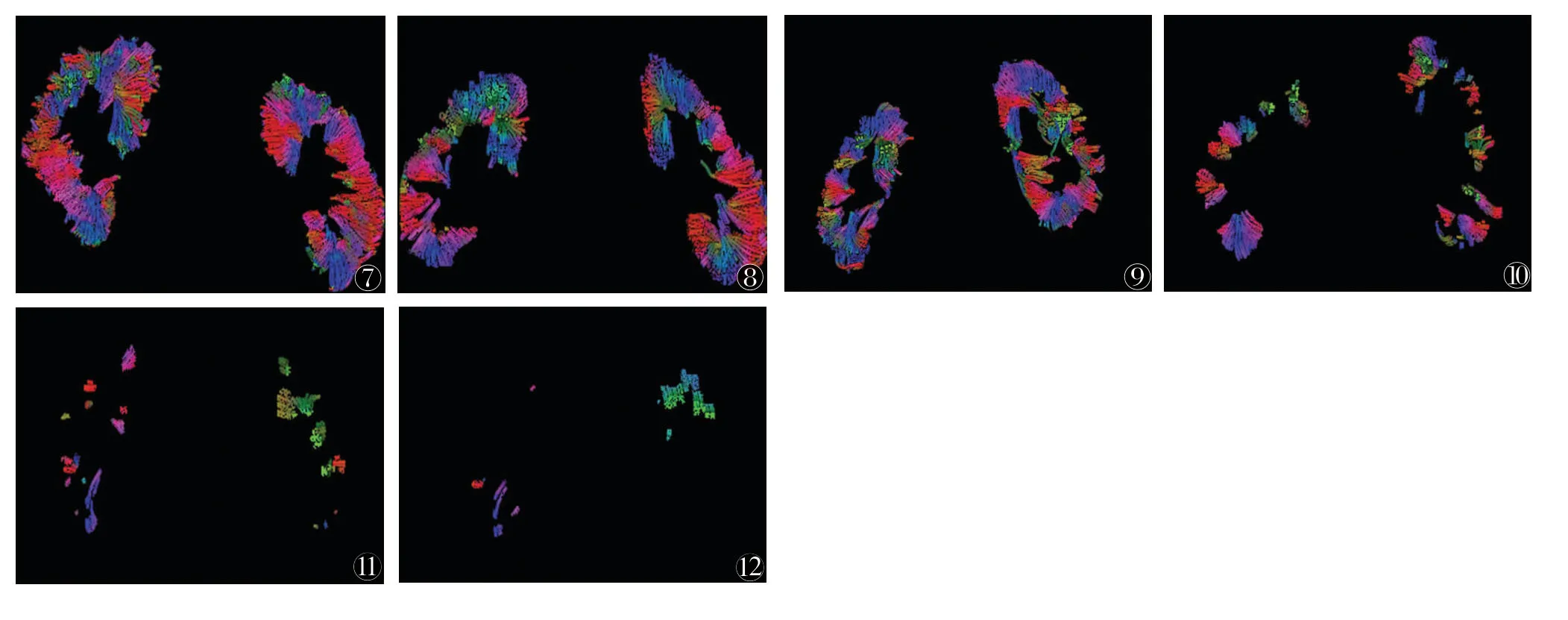
图7~12 健康志愿者及慢性肾脏病(CKD)患者的扩散张量示踪成像(DTT)图图7 男,21岁,对照组健康人,显示正常人的髓质管状结构密集放射状排列图8 女,27岁,CKD Ⅰ期,肾小球滤过率(eGFR)128 mL/min,狼疮性肾炎,显示CKD Ⅰ期患者的髓质管状结构形态尚可,但数量较对照组略减少图9 男,50岁,CKD Ⅱ期,eGFR 71mL/min,IgA肾病,显示CKD Ⅱ期患者管状结构数量进一步减少,但髓质形态大部分可显示图10 男,43岁,CKD Ⅲ期,eGFR 40 mL/min,IgA肾病,显示髓质管状结构数量进一步减少,长度变短,仅少部分髓质放射状形态可显示图11 女,58岁,CKD Ⅳ期,eGFR 18 mL/min,新月体性肾小球肾炎,显示髓质管状结构数量稀少、过早中断,大部分髓质放射状结构不可显示图12 男,36岁,CKD Ⅴ期,eGFR 8 mL/min,高血管病性肾损害,仅少数髓质管状结构可显示,髓质形态不显示
本研究中,ADC值无法区分CKD Ⅰ期患者;且无法精确区分肾脏皮、髓质,与以往结论[13-15]相似。因此,FA值较ADC值能更早、更敏感地评价CKD患者肾功能变化[8]。ADC值反映的是水分子在组织中的平均扩散情况,而FA值显示水分子在组织中定向扩散的情况,两者评价水分子扩散特性不同[8]。b值的大小及数目会影响ADC值,但对FA值无影响[16],单指数运算的ADC值受组织微灌注及液体流动的影响[14],而FA值主要由水分子在管状结构内的定向运动决定。
本研究存在不足:所有受检者的血液标本未严格在MRI检查之前采集,但能确保血液采集与DTI检查的水和状态一致,不同参与者间的水和状态一致,尽管有研究[4]表明水和状态可能不影响肾脏皮、髓质的FA值。
综上所述,肾脏DTI能够无创、准确、敏感地反映CKD患者肾脏功能的变化,其中FA值的降低能反映肾功能损害,即使eGFR尚未变化的CKD Ⅰ期患者,肾实质的FA值也会显著减低。DTI能够动态评价肾脏结构及功能的变化,可用于CKD的早期诊断、临床分期及随访。

