土壤细菌群落对湿热灭菌蚕沙还田的响应
王 谢,邓虎军,林超文,姚 莉,唐 甜,张建华*
(1.四川省农业科学院土壤肥料研究所,四川 成都 610066; 2.农业农村部西南山地农业环境重点实验室,四川 成都 610066;3.郫都区环境保护局,四川 成都 611730)
【研究意义】蚕沙是由蚕粪、残留的桑叶和蚕的脱皮等所组成,其中,蚕粪含氮量很高,尤以可溶性尿酸的含量最为丰富;残桑含有大量的蛋白质、纤维素、糖类和磷脂等,可溶糖高达4.72 %;蚕脱皮主要由蛋白质所组成[1]。因其富含有机质和矿质养分,被认为是生物有机肥的重要原料[2],但蚕沙携带有大量致病性很强的病源微生物[3],严重地威胁到家蚕的养殖和生产,因而蚕沙的无害化处理被认为是蚕沙综合利用的一个关键课题。为了抑制蚕的肠道微生物对蚕沙养分在外界环境中的有害自然发酵,减少蚕沙养分的消耗,防止还有微生物生长分泌有毒副作用物质,控制蚕病病原微生物的扩散,可利用物理或化学的方法杀死或除去蚕沙物料中一切有生物物质,其中湿热灭菌技术为常用的灭菌方法。【前人研究进展】湿热灭菌法是指利用饱和蒸汽进行灭菌的方法。由于蒸汽具有很强的穿透能力,在冷凝时会释放大量的冷凝热,可使得生物体内一些重要的蛋白质,如酶类,发生凝固、形变,导致微生物无法生存而死亡[4]。当前,蚕沙还田的研究主要针对堆肥处理的蚕沙[5],对于湿热灭菌无害化处理的蚕沙研究上属于空白。【本研究切入点】本文研究湿热灭菌蚕沙还田对该部分研究作为适当的补充。土壤微生物是土壤生态系统物质循环和能量交换的重要枢纽,是衡量植被恢复效益好坏的敏感指标,能较早地指示土壤生态系统功能的变化[6]。鉴于蚕沙本身对土壤所具有的潜在培肥能力,本研究希望在排除自身携带外源微生物条件下。【拟解决的关键问题】明确土壤细菌群落结构对于蚕沙养分资源的快速响应状况,以揭示土壤微生物对蚕沙还田的协同响应状况,为蚕区土壤生态系统功能稳定性的维持提供科学的参考依据。
1 材料与方法
1.1 供试材料与试验设计
1.1.1 供试土壤 供试土壤为过2 mm筛的风干土,土壤类型为红棕紫泥土,采至四川省资阳市雁江区坡耕地,土壤采集地无养蚕历史。土壤的pH平均值为8.8,有机质平均含量16.52 g/kg,全氮平均含量1.22 g/kg,碱解氮平均含量77.11 mg/kg,有效磷平均含量18.11 mg/kg,速效钾平均含量177.00 mg/kg,阳离子交换量23.77cmol(+)/kg。
1.1.2 供试蚕沙 供试蚕沙为无菌蚕沙,即利用手提式高压灭菌锅将有菌蚕沙在121 ℃下湿热处理5 h后得到无菌蚕沙。其中,有菌蚕沙为2016年春蚕养殖后晒干的干蚕粪,来自四川省乐山市井研县,以烘干基计算,该蚕沙含有机质65.02 %、氮1.54 %、五氧化二磷0.41 %和氧化钾2.89 %。
1.1.3 试验设计 室内恒温培养试验设置2个处理:①供试土壤(CK,对照组),不加蚕粪;②供试土壤+无菌蚕沙(SS,处理组);各处理重复9次。实验时取灭菌的玻璃杯(高度13 cm,体积310 mL),先杯子底部放入1 cm厚湿热灭菌的棉花,再称取150 g供试土壤,然后根据处理加入3 g供试蚕粪,再然后用无菌注射器加入50 mL无菌水,然后用保鲜膜封住杯口,并在保鲜膜上用注射器针头均匀扎扎50个小孔,最后置于光照恒温培养箱中培养30 d,培养时模拟白日温度28 ℃、光照时间12 h,模拟黑夜温度24 ℃、光照时间12 h。为保证培养条件一致,每天早上8点加水5 mL。
1.2 16s DNA测序与物种注释
1.2.1 DNA提取及测序 准确称取0.1 g土样,采用MoBio试剂盒法,提取土样的总DNA。经1 %琼脂糖凝胶电泳测定DNA完整性、MiniDorp测定DNA纯度和浓度。将9份重复样分为3组,每组3份。从每组的3份样品中取等量样品混匀,于-20 ℃保存、备用。对照组的3个重复分别命名为CK1、CK2和CK3;处理组的3个重复分别命名为SS1、SS2和SS3。参考Caporaso等[7]的方法,通过细菌16S rDNA V4区段引物来扩增各样品,其引物为515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。DNA扩增条件为98 ℃预变性1min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸60 s,30个循环,72 ℃延伸5 min[8]。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序。
1.2.2 物种注释 准确称取将所测得原始序列截去Barcode序列和引物序列,利用FLASH(V1.2.7)拼接[9]获得原始Tags数据;利用Qiime(V1.7.0)软件[10]过滤处理原始Tags数据获得高质量的Tags数据,并与Gold database数据库进行比对,检测并去除其中的嵌合体序列[11],获得有效数据。测序深度为每个文库原始reaSS数不少于4万条,以97 %相似性为依据,利用UPARS Epipeline软件将各序列聚类成为可执行的分类操作单位(Operational taxonomic units,OTUs)。
1.2.3 物种多样性统计 为获得土壤样品中微生物物种的多样性信息,用Mothur方法与SILVA(http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0),统计界、门、纲、目、科、属和种7个分类水平上的样本的群落组成。使用PyNAST(V1.2)软件与GreenGene数据库中的 "Core Set" 数据信息进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。
1.3 统计分析
1.3.1 α多样性指数计算 使用Qiime(V1.7.0)软件计算土壤样本微生物群落α多样性的相关指数,用Chao I指数和ACD指数表征菌群丰度,用Shannon多样性指数和Simpson多样性指数表征菌群多样性,并利用R软件对α多样性指数进行事后检验。
1.3.2 群落结构差异性分析 为揭示组件微生物群落结构差异,并指明分类水平下组间的差异物种,首先利用R软件做组间差异的多响应排列分析[12](Multi Response Permutation Procedure of Within- versus Among-Group Dissimilarities,MRPP分析);其次,利用R软件用于进行组间的T-test检验,找出差异显著(P<0.05)的物种;最后,采用组间群落差异分析[13](LDA Effect Size,LEfSe分析)方法,寻找处理组之间具有统计学差异的Biomarker,并根据每个组分(物种)丰度对差异效果影响的大小(即为 LDA Score)绘制 LDA值分布柱状图,以展示了LDA Score大于4的物种。
2 结果与分析
2.1 湿热灭菌蚕沙还田对土壤OUT数目的影响
由图1可知,SS和CK两者共有的OTU为2427个,具有差异OUT为1623个。在差异的OTU中,60.26 %为CK独有,39.74 %为SS独有。从SS下的土壤微生物的OUT只有CK的90.22 %可知,湿热灭菌蚕沙还田后会使得土壤细菌的种类减少。
2.2 湿热灭菌蚕沙还田对土壤细菌群落α多样性的影响
从图2可知,CK和SS稀释曲线最终均趋于平缓,表明本次测序量已基本覆盖个样品中的大多数细菌类群。SS中发现物种数目、Chao I指数和ACE指数分别为1801.50±19.09,1989.90±146.29和2058.92±133.9,分别只有CK的75.55 %、72.66 % 和75.4 %。SS处理下土壤细菌群落的Shannon多样性指数和Simpson多样性指数为8.16±0.17和0.9875±0.0049。由此可知,蚕粪丢弃物会降低土壤细菌群落的α多样性。
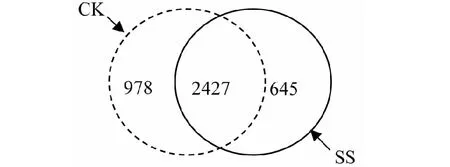
CK:对照组;SS:处理组CK: Control group; SS: Treatment group图1 OUTs韦恩图Fig.1 OUTs venn diagram
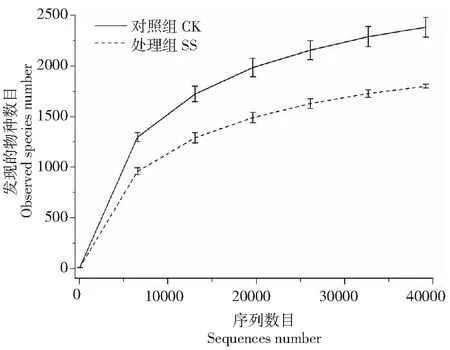
CK:对照组;SS:处理组CK: Control group; SS: Treatment group图2 样品稀释曲线图Fig.2 Rarefaction curves of samples
Wilcox秩和检验结果表示,CK和SS之间的Chao I指数、Shannon多样性指数和Simpson多样性指数存在显著的差异,其中,P值分别为0.047、0.030和0.033(P<0.05)。这表明湿热灭菌蚕沙还田可以显著地改变土壤细菌群落的α多样性。
2.3 湿热灭菌蚕沙还田对土壤细菌群落结构及优势细菌类群的影响
由表1可知,SS与CK之间的组间差异大于组内差异(A>0),这表明湿热灭菌蚕沙还田对土壤细菌结构具有一定的影响,但这种影响尚不显著(表1,P=0.1)。
在门水平上,SS中相对丰富度排名前10的依次分别为变形菌门(46.38 %±6.09 %)、放线菌门(15.46 %±5.78 %)、拟杆菌门(14.51 %±1.27 %)、厚壁菌门(12.10 %±8.16 %)、酸杆菌门(3.39 %±1.68 %)、疣微菌门(2.14 %±0.66 %)、蓝菌门(1.71 %±1.08 %)、芽单胞菌门(1.11 %±0.43 %)、浮霉菌门(1.03 %±0.08 %)和绿弯菌门(0.63 %±0.46 %),其细菌的相对丰度分别是CK的0.94、2.53、1.33、5.04、0.29、0.57、2.51、0.20、0.45和0.31倍。
在纲水平上,SS中相对丰富度排名前10的依次分别为α-变形菌纲(18.57 %±7.37 %)、未鉴定的放线菌纲(13.91 %±4.47 %)、γ-变形菌纲(12.96 %±1.82 %)、β-变形菌纲(11.54 %±2.25 %)、鞘脂杆菌纲(8.37 %±2.11 %)、梭菌纲(6.56 %±5.70 %)、芽孢杆菌纲(4.26 %±2.50 %)、δ-变形菌纲(2.99 %±1.20 %)、未鉴定的酸杆菌纲(2.77 %±4.39 %)和未鉴定的芽单胞菌纲(1.11 %±1.61 %),其细菌的相对丰度分别是CK的1.56、3.45、0.98、0.67、1.50、6.99、3.28、0.44、0.28和0.20倍。

表1 MRPP分析Table 1 Results of MRPP analysis
在目水平上,SS中相对丰富度排名前10的依次分别为黄色单胞菌目(9.98 %±2.10 %)、鞘脂杆菌目(8.37 %±2.11 %)、链霉菌目(8.29 %±4.77 %)、伯克氏菌目(7.83 %±2.48 %)、梭菌目(6.56 %±5.69 %)、根瘤菌目(5.230 %±1.03 %)、柄杆菌目(4.79 %±2.95 %)、红螺菌目(4.32 %±3.04 %)、鞘脂单胞菌目(3.16 %±1.73 %)和Subgroup 6(1.27 %±2.97 %),其细菌的相对丰度分别是CK的0.93、1.50、16.53、0.61、7.00、1.88、2.87、1.94、0.69和0.21倍。
在科水平上,SS中相对丰富度排名前10的依次分别为链霉菌科(8.29 %±4.77 %)、黄色单胞菌科(7.23 %±2.00 %)、噬几丁质菌科(6.25 %±1.87 %)、柄杆菌科(4.77 %±2.98 %)、丛毛单胞菌科(4.13 %±2.80 %)、红螺菌科(3.00 %±2.85 %)、鞘脂单胞菌科(3.00 %±1.58 %)、毛螺菌科(2.70 %±2.49 %)、梭菌科(2.28 %±2.44 %)和芽单胞菌科(0.82 %±1.20 %),其细菌的相对丰度分别是CK的16.63、0.87、1.51、3.15、0.46、2.86、0.72、13.08、6.80和0.21倍。
在属水平上,SS中相对丰富度排名前10的依次分别为链霉菌属(8.18 %±4.75 %)、短波单胞菌属(3.58 %±2.58 %)、溶杆菌属(3.54 %±2.20 %)、Flavisolibacter(1.81 %±0.68 %)、固氮螺菌属(1.65 %±1.93 %)、珊瑚放线菌属(1.24 %±0.23 %)、新鞘氨醇杆菌属(0.69 %±0.21 %)、丝杆菌属(0.63 %±0.18 %)、寡养单胞菌属(0.57 %±0.26 %)和纤维微菌属(0.27 %±0.07 %),其细菌的相对丰度分别是CK的17.83、4.26、0.53、1.24、7.31、4.54、1.35、2.05、1.20和1.57倍。
对比SS和CK从门到属5个等级的分类水平上细菌类群相对丰度排名前10的差异,不难发现,湿热灭菌的蚕沙还田会影响土壤的优势种群。
2.4 处理组与对照组之间组间差异物种分析
组间的T-test检验结果表明,在门水平有2个类群的细菌存在显著差异(P<0.05),在纲水平有10个类群的细菌存在显著差异(P<0.05),在目水平有16个类群的细菌存在显著差异(P<0.05),在科水平有43个类群的细菌存在显著差异(P<0.05),在属水平有46个类群的细菌存在显著差异(P<0.05),在种水平有14个类群的细菌存在显著差异(P<0.05)。在种水平上,SS中较CK的显著增加细菌物种有10种(P<0.05),分别为Shimazuellasp. 3-435、胶质类芽孢杆菌(Paenibacillusmucilaginosus)、黄色氢噬胞菌(Hydrogenophagaintermedia)、Chitinophagafiliformis、噬菌蛭弧菌(Bdellovibriobacteriovorus)、Shinellakummerowiae、黄褐粘球菌(Myxococcusfulvus)、Paenibacillusprovencensis和星形诺卡菌(Nocardiaasteroides),其相对丰度较CK增加倍数分别为11.63、9.00、7.33、6.90、6.61、3.31、2.94和1.87。而SS较CK显著减少的细菌物种有5种(P<0.05),分别为GemmatimonadetesbacteriumLX87、uncultivated soil bacterium clone C002、AcidobacteriabacteriumWWH111、BacteriumWX65、Jahnellathaxteri,其相对丰度仅为CK的31.25 %、14.29 %、12.50 %、11.76 %和11.11 %。
2.5 湿热灭菌蚕沙还田后土壤中的潜在生物标记物
LEfSe分析结果(图3)显示,CK的特征细菌类群以酸杆菌门和芽单胞菌门为代表,而SS的特征细菌类群以放线菌、厚壁菌门和拟杆菌门为代表。其中,在纲水平上潜在指示湿热灭菌蚕沙还田的标记菌有未鉴定放线菌纲、梭菌纲、鞘脂杆菌纲、芽孢杆菌纲和黄杆菌纲5类;在目水平上潜在指示湿热灭菌蚕沙还田的标记菌有链霉菌目、梭菌目、芽孢杆菌目、鞘脂杆菌目、根瘤菌目和黄杆菌目6类;在科水平上潜在指示湿热灭菌蚕沙还田的标记菌有链霉菌科、毛螺旋菌科和噬几丁质菌科3类;在属水平上潜在指示湿热灭菌蚕沙还田的标记菌有链霉菌属、短波单胞菌属和假黄单胞菌属3类。从CK土壤的潜在生物标记物中可以发现:湿热灭菌蚕沙还田对土壤原有的噬纤维菌科、芽单胞菌科和丛毛单胞菌科3类细菌具有一定的抑制作用。
3 讨 论
3.1 湿热灭菌蚕沙还田后参与纤维素降解的主要细菌类群
湿热灭菌蚕沙还田对土壤细菌结构无显著的影响这一结果暗示了测试土壤的微生物群落结构和功能的稳定性,并彰显出了其自修复能力。蚕沙湿热灭菌后还田会向土壤中带入了大量的未分解和半分解的纤维素,故而湿热灭菌蚕沙还田后土壤细菌群落表现出的主要功能倾向为纤维素降解。本研究结果显示,湿热灭菌蚕沙还田后土壤厚壁菌门和放线菌门细菌分别增加了5.04和2.5倍,而这两大类细菌都是在纤维素降解中占据优势地位的细菌类群[14-16]。其中,厚壁菌门的梭菌目和放线菌门的链霉菌目最具代表性,本研究中湿热灭菌蚕沙还田后梭菌目和链霉菌目细菌分别增加了7.00和16.53倍、梭菌科和链霉菌科细菌分别增加了6.80和16.63倍、链霉菌属细菌增加了17.83倍;梭菌目下毛螺菌科细菌增加了13.08倍。
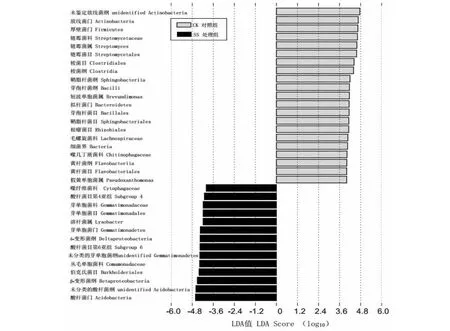
CK:对照组;SS:处理组CK: Control group; SS: Treatment group图3 样品中潜在生物标记物分析(LDA>4)Fig.3 Analysis of potential biomarkers in samples (LDA>4)
厚壁菌门下毛螺菌科的细菌主要来源于动物的肠道[17-19],高凤芹在研究两种驯化瘤胃液的细菌物种多样性时指出毛螺菌科细菌的增多可能有利于纤维素降解[20]。此外,厚壁菌纲下芽孢杆菌目也是一个不容忽略的重要细菌类群,不论从基础研究还是应用开发都有很多的报道[21]。李康宁在研究浑善达克沙地生物土壤结皮纤维素降解细菌菌群时利用选择性培养基筛选出的16株纤维素降解细菌中芽孢杆菌属和链霉菌属相对丰度分别为43.8 %和25 %,为优势菌属[22]。本研究也发现SS处理的土壤中在厚壁菌纲下芽孢杆菌目下的Shimazuellasp. 3-435、胶质类芽孢杆菌(P.mucilaginosus)和P.provencensis比CK增加了11.63、9.00和2.94倍。刘欣利用木聚糖为唯一碳源筛选出一类芽孢杆菌(Paenibacillussp. E18),经底物特异性分析表明其对桦木木聚糖、大麦葡聚糖、地衣多糖、昆布多糖等具有较好的水解能力[23]。而与之相关的β-葡萄糖苷酶(EC3.2.1.21;β-D-glucosidase)水解纤维二糖中的p-1,4-糖苷键,直接影响着纤维素的降解效率[24]。鉴于木聚糖是半纤维素中的代表性组分,是自然界中含量仅次于纤维素的第二丰富的多聚糖[22]。认为类芽孢杆菌属的胶质类芽孢杆菌(P.mucilaginosus)和P.provencensis细菌在湿热灭菌蚕沙的降解中具有不可或缺的重要作用。
放线菌门下链霉菌科细菌作为典型的好氧纤维素降解菌,可通过分泌游离的纤维素酶协同降解纤维素[25],在纤维素的降解功能上已经十分明确[26-28],本研究结果也与之相吻合,故此不再重复。
除了厚壁菌门和放线菌门外,变形菌门细菌在纤维素降解中也具有重要的作用。首先,在变形菌门下,本研究就发现短波单胞杆菌属和固氮螺旋菌属细菌增加了4.26和7.31倍,它们分属于α-变形菌纲下的柄杆菌科和红螺菌科;就短波单胞杆菌而言,它密切参与着纤维素的降解工作,罗立津等[29]在研究耐低温木质纤维素降解菌群时就支出该菌为25 ℃培养条件下的优势种群;而就固氮菌而言,蒲一涛等[30]就指出固氮菌和纤维素分解军的混合培养可以加速生活垃圾的降解。其次,S.kummerowiae增加了3.31倍,它属于β变形菌纲下红环菌目、红环菌科、Shinella属,属于Shinella根瘤菌家族成员;这暗示了湿热灭菌蚕沙还田后在纤维素降解过程中会增加土壤部分有益微生物菌群,促进矿质养分的释放[31]。再则,本研究结果还显示假黄单胞菌属可作为湿热灭菌蚕沙还田后的潜在生物标记物,而该菌在分类地位上也属于变形菌门,从属于γ-变形菌纲下的黄单胞菌科[32],已经被证明在在降解木质纤维素上具有很高的研究和应用价值[33-34]。
上述纤维素降解的优势菌群基本与当前的研究结果相一致。除此之外,本研究还发现拟杆菌门下鞘脂杆菌纲下泉发菌科噬几丁质菌属下C.filiformis显著增加了6.90倍,但目前对于该菌的生态功能研究相对较少,无所比较,鉴于几丁质本分就是β-1,4糖苷键连接的线性同源多聚体[35],属于土壤碳循环的重要部分[36],故而本研究猜测该菌的存在可辅助纤维素降解。
3.2 湿热灭菌蚕沙还田后噬菌蛭弧菌显著增加
本研究中SS处理条件下噬菌蛭弧菌(B.bacteriovorus)的相对丰度较CK增加了6.61倍;该菌也属于变形菌门,从属于δ-变形菌纲、蛭弧菌目、蛭弧菌科、蛭弧菌属,是1962年Stolp和Petzold等在土壤样品中发现的一类细菌的寄生菌,它广泛存在于自然环境中[37],如植物根际、河流、海洋、污水、肠和鸟类和哺乳动物粪便,甚至在牡蛎和螃蟹的鳃中[38]。而最重要的一点是该菌被认为可能是环境自然净化的因素之一[37]。噬菌蛭弧菌虽然不能利用碳水化合物,但它以不完全的三羧酸循环为主要代谢途径,可以利用多肽及氨基酸作为能源和碳源,具有极强的蛋白质分解能力[39]。由于该菌对人体没有危害,它不仅被用于污水处理,还被用于生物防治一些农作物的病原菌[38]。
3.3 蚕沙湿热灭菌后依然存在的环境安全风险
本研究还发现放线菌亚纲下棒杆菌亚目下诺卡氏菌科的星形诺卡菌(N.asteroides)比CK增加了1.87倍。该菌广泛分布于土壤等自然环境中,为腐物寄生菌,能引起人或动物急性或慢性诺卡菌病[40]。苑美玉指出该菌可通过呼吸道引起人的原发性、化脓性肺部感染,出现肺结核的症状[41]。虽然该菌在蚕病中未见报道,但在浮游生物、甲壳类动物、滤食性贝类、海龟蛋和鱼类中皆有发现[42-44],故而建议加强养蚕环境条件下星形诺卡菌(N.asteroides)的研究,并适当考虑在未来养蚕环境安全评估中将星形诺卡菌(N.asteroides)的相对丰度作为评估指标之一。
4 结 论
土壤细菌群落的结构和功能相对稳定,湿热灭菌蚕沙还田后会快速激活了与纤维素代谢相关的细菌类群,并通过增加这些细菌类群相对丰度的方式促进土壤的自我修复。此外,噬菌蛭弧菌相对丰度的增加进一步暗示了土壤的自净能力。

