高表达衰老标记蛋白30对高钙诱导人晶状体上皮细胞株SRA01/04氧化应激的影响
李松蔓,陈 曦,韩子豪,THU THU WIN AINT,衷 昕,唐东永,梁 皓
(广西医科大学第一附属医院眼科,广西壮族自治区南宁530021)
白内障是一种由氧化损伤、钙紊乱、晶状体蛋白异常、年龄、遗传等因素所致的致盲性眼病,其发病机制尚未完全确切[1-4]。既往研究发现,白内障晶状体内Ca2+浓度显著高于透明晶状体,白内障晶状体上皮细胞(lens epithelial cell,LEC)内形成高钙甚至钙紊乱状态,可加剧细胞内氧化应激水平,最后导致LEC受损,形成白内障[5-6]。衰老标 记 蛋 白 30(senescence marker protein 30,SMP30)是一种具有多重细胞保护功能的钙调节蛋白,又称Regucalcin(RGN),其表达量与年龄呈负相关,不受性别因素影响[7]。国内外研究证实,SMP30与白内障病因密切相关,其表达与LEC的凋亡、增殖调控、氧化应激存在联系,同时发现SMP30在H2O2诱导人LEC细胞株SRA01/04急性氧化应激时表达上调,在H2O2诱导SRA01/04慢性氧化应激构建细胞衰老模型时表达下调[8-10]。由此,我们猜测,SMP30作为一种钙调节蛋白,其在LEC内表达量的变化,可能在一定程度上影响细胞氧化应激水平,从而在白内障进程中起到调控性的保护作用。然而,目前国内外有关SMP30含量对高钙诱导LEC氧化应激水平的影响的研究较少,故本研究拟通过慢病毒转染技术,使SRA01/04细胞(人LEC株)内SMP30高表达,在体外构建的高钙培养状态下,检测细胞增殖活力及氧化应激水平等指标,进一步探讨SMP30对人LEC氧化应激的影响及潜在的保护作用。
1 材料与方法
1.1 细胞培养
用含100 mL/L的胎牛血清(美国Gibco公司)的RPMI1640培养基(美国Gibco公司)培养人LEC细胞株SRA01/04(广州吉妮欧生物科技公司)(复苏冻存细胞时,胎牛血清体积分数为150 mL/L),细胞置于内环境为37℃、含体积分数5%CO2的细胞培养箱(美国Thermo Scientific公司)中培养。必要时往完全培养基中加入100 U/mL 青霉素和 100 μg/mL(pH 7.4)(美国Sigma公司)。倒置相差显微镜(日本Olympus公司)观察细胞。
1.2 慢病毒转染法构建SMP30高表达SRA01/04细胞模型
构建细胞模型的方法参考于我们前期预转染实验结果[9]:SRA01/04细胞易感于慢病毒载体,可通过慢病毒转染技术构建SMP30高表达SRA01/04细胞模型。最佳感染条件为在感染复数(multiplicity of infection,MOI)等于5的条件下,用含5 μg/mL polybrene(助感染试剂)的完全培养基感染SRA01/04细胞。本实验共有2组慢病毒载体,分别为SMP30高表达组(SMP30 overexpressed group,OE)慢病毒载体(LV-RGN)及阴性对照慢病毒空载体组(negative control overexpressed group,NCOE)(上海吉凯基因化学技术有限公司构建)。其中,上述慢病毒载体用绿色荧光蛋白(green fluorescence protein,GFP)基因作为报告基因,在转染后可通过观察SRA01/04细胞内GFP的表达情况分析转染结果。
在正式转染实验中,选择生长状态良好的SRA01/04细胞,以2×104个每孔均匀接种于6孔板,待每孔细胞贴壁率达到20%~30%时,更换新配置的含适量慢病毒载体(MOI=5)+5 μg/mL polybrene的完全培养基去感染细胞。感染后24 h观察细胞状态,再吸走细胞上清,更换为正常完全培养基,继续置于培养箱培养。随后定期显微镜观察细胞形态、生长状况及GFP的表达。在转染细胞生长状态良好,细胞贴壁率达80%~90%时,更换含2 μg/mL嘌呤霉素的完全培养基以去除转染失败的细胞,在随后的传代培养中用含1 μg/mL嘌呤霉素的完全培养基持续筛选稳定表达的转染细胞。
1.3 建立高钙诱导SRA01/04细胞氧化应激模型
建立高钙诱导细胞氧化应激模型的实验方法参考我们前期研究报道[11]所述:SRA01/04细胞在含有15 mmol/L CaCl2的完全培养基中培养24 h,此时CCK-8检测结果显示细胞存活率约为50%。由此可将15 mmol/L CaCl2作为SRA01/04细胞的半致死量,处理细胞24 h,用于后续构建高钙应激细胞模型的实验。
1.4 BrdU法检测细胞增殖活力
按每孔2×103个细胞0.1 mL均匀接种于96孔板,在高钙培养状态下,于细胞贴壁后第1天、4天对每组细胞的增殖活力进行检测,每组设3个复孔。检测当天于每孔加入用培养基稀释后的BrdU试剂(瑞士Roche公司)10 μL(稀释比例1∶100),作用8 h。吸弃培养基,每孔加0.2 mL FixDenat(试剂盒自带),室温避光固定30 min。吸弃固定液,加入10%的BSA室温避光封闭30 min。吸弃封闭液,加入抗体(Anti-BrdU-POD工作液0.1 mL/孔),室温避光反应90 min。随后每孔加入用无菌双蒸水稀释后的washing buffer(稀释比例1∶10;试剂盒自带)200~300 μL,洗板3次,待干。将待测的培养板放在一个盛有无菌水的细胞板盖子中(无菌水没过培养孔),拍干,擦干。每孔加入Substrate solution(试剂盒自带)100 μL,室温避光反应5~30 min,待反应液变为蓝色。最后每孔加入50 μL 10%H2SO4,在酶标仪(瑞士Tecan公司)检测OD450nm值。每组实验重复3次。
1.5 超氧化物歧化酶(SOD)活性、氧化型谷胱甘肽/总谷胱甘肽(GSSG/T-GSH)的测定
细胞内SOD活性用总SOD测定试剂盒(WST-1法)(南京建成生物工程研究所)检测。细胞用0.25%胰蛋白酶(美国Gibco公司)消化、离心收集细胞沉淀(264×g,5 min)后,用500 μL PBS(北京索莱宝科技有限公司)轻吹洗涤细胞1次,离心收集细胞沉淀(264×g,5 min)。再加入500 μL PBS轻吹匀,于冰水浴超声破碎细胞(300 W,3~6 s,共4次,间隔30 s一次)。将该原液稀释成梯度浓度样本待用。酶标仪读取测定OD450nm,结合公式计算SOD抑制率,选取抑制率在40%~50%内的样本稀释后使用。核酸微量检测仪测定样本蛋白浓度,结合公式计算SOD活力。使用GSSG/T-GSH试剂盒(南京建成生物工程研究所)检测细胞内GSSG/T-GSH的大小。细胞处理步骤同上,加入500 μL试剂四(试剂盒自带)混匀后超声破碎。酶标仪测出OD450nm数值,结合公式计算GSSG/TGSH比值。每组实验重复3次。
1.6 统计学方法
采用SPSS 22.0统计学软件做统计处理。本实验对细胞增殖(ODday4/ODday1)及氧化应激(SOD与GSSG/T-GSH)数据进行多组样本的比较,经正态性检验和方差齐性检验后,各组数据以均数±标准差(±s)表示,多组间均数的比较用单因素方差分析,组间两两比较采用LSD检验。检验水准以P<0.05为差异有统计学意义(双侧检验)。
2 结果
2.1 显微镜下观察SRA01/04及转染细胞
在光学倒置显微镜下观察SRA01/04细胞为贴壁生长的上皮细胞,大部分呈不规则的多边形、长梭形,胞浆伸展,可见胞核,细胞无色透明,遮光性强。荧光显微镜下观察各组转染细胞可见有大量GFP表达,转染效率接近80%。高钙培养SRA01/04 24 h后,可见大部分细胞变形皱缩,边界不清,部分细胞呈长条形并长触角,有细胞出现碎裂、溶解,细胞周边杂质较多(图1)。
2.2 高钙状态下SMP30对SRA01/04及转染细胞增殖活力的影响
本实验用BrdU法检测各组细胞的增殖活力,以各实验组第4天OD450nm值与第1天OD450nm的比值(ODday4/ODday1)表示。结果显示,在高钙状态下,OE组(3.89±0.20)相对细胞增殖活力均高于NCOE组(2.82±0.34,P=0.000)及 SRA01/04组(2.96±0.25,P=0.000),NCOE组与SRA01/04组相比差异无统计学意义(P=0.447;图2)。
2.3 高钙状态下SMP30对SRA01/04及转染细胞氧化应激的影响

图1 SRA01/04及转染细胞在光学和荧光显微镜下图像Fig.1 The optical and fluorescence microscope images of SRA01/04 and transfected cells
使用总SOD测定试剂盒(WST-1法)检测,结果显示,在高钙状态下,OE组(47.5±4.3)SOD活力(U/mg)显著高于NCOE组(30.6±4.2,P=0.000)及SRA01/04组(26.8± 1.5,P=0.000),NCOE组与SRA01/04组相比差异无统计学意义(P=0.147;图3A)。
采用GSSG/T-GSH检测试剂盒法检测,结果显示,在高钙状态下,OE组GSSG/T-GSH比值(2.36±0.51)明显低于NCOE组(16.36±2.48,P=0.000)及 SRA01/04组(20.12± 2.54,P=0.000),NCOE组和SRA01/04组相比差异无统计学意义(P=0.091;图3B)。
3 讨论
本实验结果提示,SMP30在一定程度上可延缓人LEC细胞株SRA01/04因高钙诱导细胞氧化损伤的进展,其保护机制主要从增加细胞增殖活力、提高抗氧化能力及降低氧化应激水平等方面起作用。虽已有研究证实SMP30与LEC细胞凋亡及白内障具有相关性,但本实验是目前国内外首次探讨人LEC中SMP30蛋白含量的改变对高钙诱导细胞氧化损伤的影响及潜在保护作用的研究。

图2 高钙状态下高表达SMP30对SRA01/04细胞增殖活性的影响Fig.2 Effect of overexpression of SMP30 on SRA01/04 cell proliferation under high-calcium mediated stress conditions
SMP30是一种广泛存在于高等动物细胞中的钙信号转导蛋白,其表达量随机体组织器官结构和功能完善成熟而增加,随机体衰老而逐渐减少,不受性别和雄激素的影响,具有抑制细胞凋亡[12]、增殖调控[9,13]、抗氧化应激[14]、维持细胞钙稳态[15]、参与维生素C(抗坏血酸)合成[16]等多重保护作用。近年来,在相关临床研究中已证实,SMP30主要表达于人LEC细胞质,细胞核内有少量表达,在晶状体囊膜周边部表达强,中央部表达弱,凋亡LEC的空间分布特性与SMP30相反,此外,SMP30在白内障患者LEC中表达量明显高于正常LEC,且SMP30在白内障患者LEC的表达量具有年龄相关性,60岁以上患者LEC中SMP30的表达量低于≤60岁患者[17-18];在细胞功能实验中,高表达的SMP30还具有延缓紫外线损伤、抑制人LEC活性氧的产生、促进LEC增殖活力及抑制细胞凋亡的作用[9,19];在动物模型实验里,SMP30基因敲除小鼠在紫外线B(ultraviolet radiation B,UVB)照射诱导下,因内源性维生素C(抗坏血酸)生成障碍而更易出现晶状体混浊[20],综上研究结果可得出,SMP30与LEC活性、抗氧化损伤密切相关,其在LEC中的表达可能具有防止或延缓白内障发生发展的保护作用。
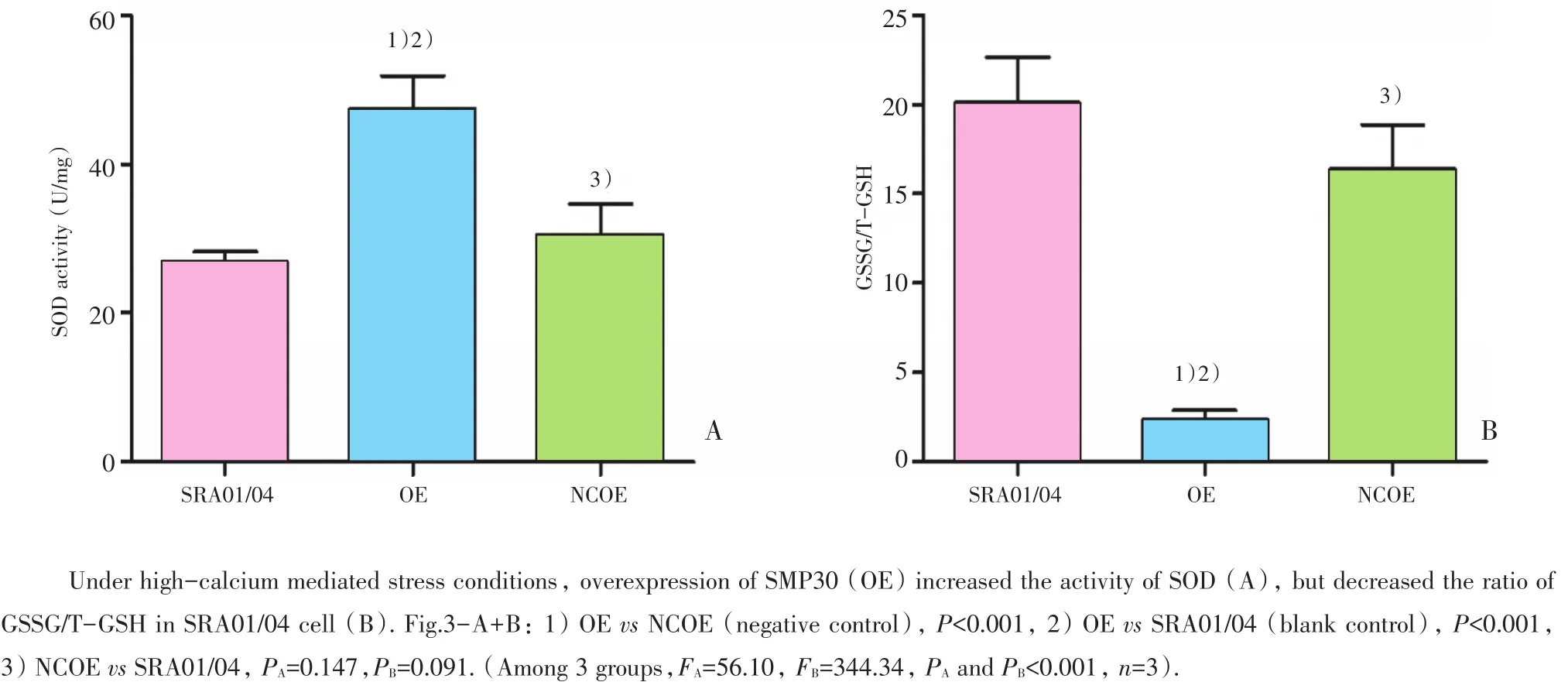
图3 高钙状态下高表达SMP30对SRA01/04细胞氧化应激的影响Fig.3 Effect of overexpression of SMP30 on oxidative stress in SRA01/04 cell under high-calcium mediated stress conditions
结合目前白内障的基础研究成果,已知高钙、氧化损伤及细胞凋亡等方面与年龄相关性白内障存在联系。LEC是晶状体前囊下的单位上皮细胞,也是晶状体内代谢最活跃的部位,LEC的代谢是自我调节的,正常的代谢活性是保证晶状体透明性、完整性和光学性能的前提。Ca2+是LEC代谢的主要离子之一,在晶状体的生理和病理中都发挥着重要的作用。在既往体外培养实验中,有相关学者采用含高钙的培养基培养晶状体,均发现晶状体的混浊与体外 Ca2+浓度升高有关[1,21]。同时,LEC内还具有防止或延缓晶状体氧化应激损伤的抗氧化系统,如SOD(酶性氧化清除剂)、还原性谷胱甘肽(glutathione,GSH;非酶性氧化清除剂)等[22-23]。当LEC外环境中Ca2+浓度的升高,细胞内Ca2+超载可能触发晶状体一系列事件,如纤维膜破坏、细胞质凝集、晶状体蛋白降解等[24-25],导致细胞抗氧化系统功能减弱。此外,线粒体是活性氧产生的最主要来源,当胞内Ca2+超载使线粒体结构受损,线粒体Ca2+内流增加,Ca2+蓄积可促进黄嘌呤脱氢酶和黄嘌呤氧化酶的转化从而使氧自由基生成加速;线粒体膜磷脂大量降解,电子传递链活性降低,呼吸链的损伤使线粒体合成ATP受阻,线粒体功能障碍,又可加速Ca2+内流及氧自由基生成,形成恶性循环[6,26]。由此可见,高钙培养状态可诱导LEC细胞氧化应激反应的加剧,最终加速细胞凋亡,故在本次实验中,我们通过增加培养液中Ca2+浓度,体外构建高钙诱导LEC氧化损伤模型,结合我们前期实验所得结果,采用含特定浓度15 mmol/L CaCl2的培养基处理SRA01/04细胞24 h,进行后续白内障发病机制的相关研究。
慢病毒载体是一种可将目的基因导入至宿主细胞的理想的逆转录病毒载体,具有转染细胞类型广泛、转染效率高、可长期稳定表达及可同时转染分裂期和非分裂期细胞等优点[27-28]。同时,在我们前期预转染实验已证实,可通过慢病毒转染技术成功构建高表达SMP30细胞模型。结合此基础,在本实验中,我们使用慢病毒转染构建高表达SMP30 SRA01/04细胞模型,并检测在高钙培养状态下每组细胞增殖活力、氧化应激水平等指标的改变。
在实验中我们发现,在高钙状态下,SMP30高表达SRA01/04(OE组)的细胞增殖活力明显增加。Fujita等[29]用 Ca2+载体促使 Ca2+内流来诱导Hep G2细胞死亡时,发现SMP30过表达组的细胞存活率显著高于对照组,得出SMP30可通过促进Ca2+外流可达到拯救细胞因钙超载而死亡的作用,上述与我们的研究成果一致,由此我们认为,SMP30作为一种钙调节蛋白,在高钙应激状态下,可能在SRA01/04细胞中也发挥其维持钙稳态的作用,进而在一定程度上增加SRA01/04细胞增殖活力,减少细胞死亡。Son等[30]通过pcDNA3载体使多能小鼠胚胎癌P19细胞中的SMP30过表达,并发现SMP30对P19细胞增殖有抑制作用,提示SMP30可能是一种肿瘤生长抑制因子,这与本研究结果相反,我们考虑可能的原因为:在不同细胞系及肿瘤微环境的影响下,SMP30对细胞增殖的调控可能扮演着正反两个角色。
SOD和GSH是晶状体主要的超氧自由基清除因子,对机体氧化和抗氧化平衡起着至关重要的作用,其含量可间接反映细胞抗氧化损伤能力。其中谷胱甘肽在体内以GSH和GSSG 2种形态存在,正常情况下,GSSG含量较少(GSH:GSSG比例为100∶1),当细胞受氧化应激损伤时,GSH因氧化而生成大量GSSG,通过测定GSSG/T-GSH可在一定程度上反映胞内氧化应激水平[31]。在实验中我们发现,在高钙状态下,与对照组相比,SMP30高表达SRA01/04细胞(OE组)GSSG/TGSH比值减小(提示GSH含量相对较多),SOD活力值相对增加,提示SMP30高表达的SRA01/04细胞内氧化应激水平相对降低,细胞抗氧化应激能力相对提高。由此我们认为,在高钙诱导的氧化应激下,SMP30可能通过增加SOD活力,降低GSSG/T-GSH水平来提高SRA01/04细胞抗氧化应激能力。滕贺等[19]通过真核表达质粒构建SMP30高表达HLE-B3细胞(人LEC株)发现,SMP30可抑制UVB诱导细胞活性氧的形成。田黎明等[32]在研究H2O2诱导人皮肤成纤维细胞衰老表型时发现,高表达SMP30可上调细胞SOD的活性。上述研究均提示高表达SMP30具有抗氧化的细胞保护作用,与我们的实验结果一致。
本研究是在白内障研究领域中首次探讨SMP30对高钙诱导人LEC氧化应激的影响。在研究中,我们发现在体外建立的高钙培养状态下,增加SMP30蛋白含量可增加SRA01/04细胞的增殖活性、SOD活力及降低GSSG/T-GSH水平以提高人LEC抗氧化应激能力,由此提示SMP30在一定程度上参与到高钙诱导细胞损伤的进程中,起到一定的细胞保护作用。本实验的不足在于仅从细胞功能水平上浅谈SMP30在LEC的作用机制,没有对LEC内SMP30敲除及SMP30可能存在的钙调控功能、信号通路等方面进行更深入研究。但本实验成果也可为今后研究SMP30在人LEC的潜在调控机制提供新的基础及方向。
综上所述,在高钙诱导的细胞氧化应激下,SMP30对人晶状体上皮细胞株SRA01/04具有增加细胞增殖活力、提高抗氧化应激能力的保护作用,其程度与细胞内的表达量相关。由此我们得到提示,SMP30可能是晶状体上皮细胞中一个潜在的多功能性蛋白,在今后的临床应用上,或许可以通过制备SMP30相关的滴眼剂、口服药物、靶向治疗药等方式增加其表达或者调控其参与的通路,可更有效地预防和延缓白内障的发生发展。

