LncRNA与凋亡相关基因在小鼠肠缺血再灌后肠黏膜表达谱中的变化及共表达网络关系
许 淼,杨 勇,邓绮文,沈建通,刘卫锋,杨文静,刘克玄
(1.中山大学附属第一医院麻醉科,广东广州510080;2.广州市第一人民医院神经内科,广东广州510180;3.南方医科大学南方医院,广东广州510515;4.郑州大学附属第一医院,河南郑州450052)
肠缺血再灌注(ischemia/reperfusion,I/R)损伤是围术期常见的病理生理过程,它常出现在严重创伤、感染、休克、肠缺血性疾病,以及某些外科手术(如小肠移植术,肝移植术、腹主动脉瘤手术及心肺转流术等)中[1]。肠I/R不仅可引起肠道的局部损害,还可因肠损伤后肠内细菌、内毒素的移位导致全身炎症反应综合征,进而导致肠外远隔器官损害、多器官功能不全甚至死亡[2],其发病机制一直是国内外学者研究的重点和难点。研究表明凋亡是肠I/R后肠黏膜上皮细胞死亡的主要形式[3],寻找调控肠I/R后肠黏膜上皮细胞凋亡的靶点是防治肠I/R肠损伤的关键。近年来发现,长链非编码RNA(long noncoding RNA,lncRNA)在众多疾病的发生发展中,通过调控细胞凋亡起到重要作用[4]。然而,lncRNA和肠I/R损伤关系的研究目前尚未见报道,其在肠I/R过程中是否发生了改变、是否在肠黏膜上皮细胞的凋亡中发挥作用亟待探讨。
1 材料与方法
1.1 肠I/R损伤动物模型
SPF级雄性C57Bl/6小鼠,由广东省医学实验动物中心提供,动物体质量范围为19~20 g,许可证号:SYXK(粤)2010-0108。小鼠在中山大学附属第一医院动物实验中心集体饲养,饲养条件遵照《实验动物环境及设施国家标准(GB14925-2001)》规定。1%戊巴比妥钠溶液50 mg/kg腹腔注射麻醉后仰卧固定于手术台,常规消毒,经腹正中切口,分离肠系膜上动脉(superiormesenteric artery,SMA),无创微动脉夹夹闭,缝合切口。60 min后经原切口进腹,取出动脉夹,恢复血供,于再灌注后2 h留取小肠黏膜标本。
1.2 实验分组和取材
12只雄性C57Bl/6小鼠随机分为2组:假手术组(sham operation group,S组):仅行开腹,分离SMA但不夹闭;肠缺血再灌注损伤组(I/R injury group,I/R组):分离SMA,微动脉夹夹闭之后缝合切口。60 min后经原切口进腹,松开动脉夹,恢复血流进行再灌注。
建立小鼠肠缺血再灌注损伤模型成功,于再灌注后2 h,在深麻醉下断颈处死实验动物。距回肠末端5 cm处相同部位取一约1 cm肠段,除去外膜脂肪组织,置于40 g/L多聚甲醛溶液固定12 h,常规石腊切片,用于形态学检测。紧接其后取5 cm肠段,4℃PBS溶液冲洗后置于冰面上迅速刮取肠黏膜后液氮保存,用于lncRNA芯片筛选和验证,采用Array star小鼠lncRNA芯片V3.0(上海康成生物技术有限公司)。
1.3 小肠组织光镜观察和病理学评分
小肠组织石蜡切片、HE染色。在光学显微镜下观察S组和I/R组小鼠小肠黏膜形态学变化,采用改良Chiu’s评分法[5]对肠黏膜损伤程度进行评价,评分越高,表明损伤越严重(表1)。
1.4 基因芯片筛选肠黏膜中差异 lncRNA和mRNA
Arraystar小鼠LncRNAV3.0芯片可描述小鼠全局LncRNA和蛋白质编码转录本谱,能够检测约35 923个LncRNA和24 881个编码转录本。
两组样品随机选择两组各3个样品,经总RNA提取后,采用Agilent表达谱芯片配套的RNA扩增及单标试剂盒并按标准操作流程,对总RNA进行放大和标记,并用RNeasy Mini Kit(Qiagen)纯化标记后的cRNA,并用NanoDrop ND-1000检测浓度和活性;按照Agilent基因芯片试剂盒操作流程,使用Agilent surehyb进行杂交实验。在滚动杂交炉中65℃,10 r/min(r=10 cm),滚动杂交 17 h,杂交 cRNA上样量为1.65 μg,并在洗缸中洗片;完成杂交的芯片采用Agilent DNA Microarray Scanner芯片扫描,用Feature Extraction软件V11.0.1.1读取数据,用Gene Spring GX V12.1进行标准化处理,把图像信号转化为数字信息。原始数据标准化后经过筛选高质量探针(某探针在6个样品中至少有3个被标记为Present或Marginal)进行进一步分析。两组样品间具有统计学意义的差异表达lncRNA或差异表达mRNA通过P-value/FDR筛选。两个样品间差异表达lncRNA或差异表达mRNA通过Fold Change筛选。
1.5 对差异mRNA的GO生物信息分析
对差异表达基因进行非监督层次聚类分析,通过计算多个样品两两之间的距离,构成距离矩阵;随后合并距离最近的两类为一新类,计算新类与当前各类的距离,再合并、计算,直至只有一类为止。用挑选的差异基因的表达情况来计算样品直接的相关性,同一类样品能通过聚类出现在同一个簇中,聚在同一个簇中的基因可能具有相似的生物学功能。
对筛选到的差异表达mRNA进行基因本体论(Gene Ontology,GO)分析,这是基因功能国际标准分类体系。通过GO分类号和GO数据库相关分析工具将类别与具体基因联系起来,从而对这个基因的功能进行描述。通过芯片的数据分析,可以发现哪些变化的基因共同属于一个GO功能分支,并用统计学方法测定该分类是否具有统计学意义,从而得出这些变化基因各自可能参与的生物功能。
1.6 qRT-PCR验证上下调最明显的差异lncRNA
采用Primer 5.0软件设计上/下调最明显的6个差异长链非编码 RNA的引物(表 2),并由Invitrogen公司合成。按前述方法提取两组各6个样品的RNA,配制退火混合物,混合液在65℃水浴5 min,冰上放置2 min。12 000×g短暂离心后,在离心管中依次加入Reverse Transcriptase反应液,混合后37℃恒温1 min,50℃温育60 min,70℃温育15 min使酶失活,置冰浴待用或-20℃保存。将所有cDNA样品分别配置Realtime PCR反应体系,12 000×g短暂离心。将8 μL混合液加到384-PCR板对应的每个孔中,再加入对应的2 μL cDNA,小心粘上Sealing Film封口膜,并短暂离心混合置于冰上,最后置于Realtime PCR仪上进行PCR反应。

表1 肠粘膜损伤的改良Chiu’s评分Table 1 The modified Chiu score for intestinal mucosa injury

表2 挑选长链非编码RNA双向引物序列表Table 2 Primers used for qRT-PCR
反应条件:95℃预变性10 min,95℃变性10 s,60 ℃退火1 min,共40个循环。利用 2-ΔΔCT相对定量法分析,以管家基因GAPDH为内参,以非处理组为校准样本检测样品中长链非编码RNA的转录水平,每个样品平行3次试验取均值进行计算。
1.7 共表达CNC(coding-noncoding gene coexpression)网络生物信息分析
1.7.1 结合GO、Pathway分析及文献支持,比对芯片中差异肠I/R相关凋亡基因 根据第一部分芯片基因GO、Pathway分析的“凋亡”相关条目,同时参考大量肠I/R文献报道的凋亡基因,挑选代表性的mRNAs,并比对在本芯片中它们的差异变化,观察P值。
1.7.2 将上述凋亡mRNAs和所有差异lncRNA进行CNC共表达分析 将lncRNA基因标准化后的数据,以及相同蛋白编码基因存在多个转录本时,不同转录本的数据求均值作为作为基因的表达值。通过计算Pearson相关系数对上述凋亡mRNA和所有差异LncRNA之间的表达相关性(标准化后的信号强度)进行分析,筛选Pearson相关系数绝对值(pcc)≥0.995,FDR≤0.01,P<0.05的共表达关系对。根据上述Pearson相关系数结果,利用Cytoscape工具绘制lncRNA和mRNA共表达的网络图。
1.8 统计学方法
采用SPSS17.0统计软件分析数据,所有实验均重复3次,计量资料以均数±标准差(±s)表示,组间比较采用双侧t检验,以P<0.05为差异有统计学意义;基因芯片部分实验结果利用t检验的P值和Fold Change倍数变化值进行差异基因筛选,筛选的标准为上调或者下调倍数变化值≥2.0,且P值<0.05。共表达分析以Pearson相关系数绝对值(pcc)≥0.995,FDR≤0.01,P<0.05为条件筛选。
2 结果
2.1 小鼠小肠组织光学显微镜下形态学及改良Chiu’s评分变化
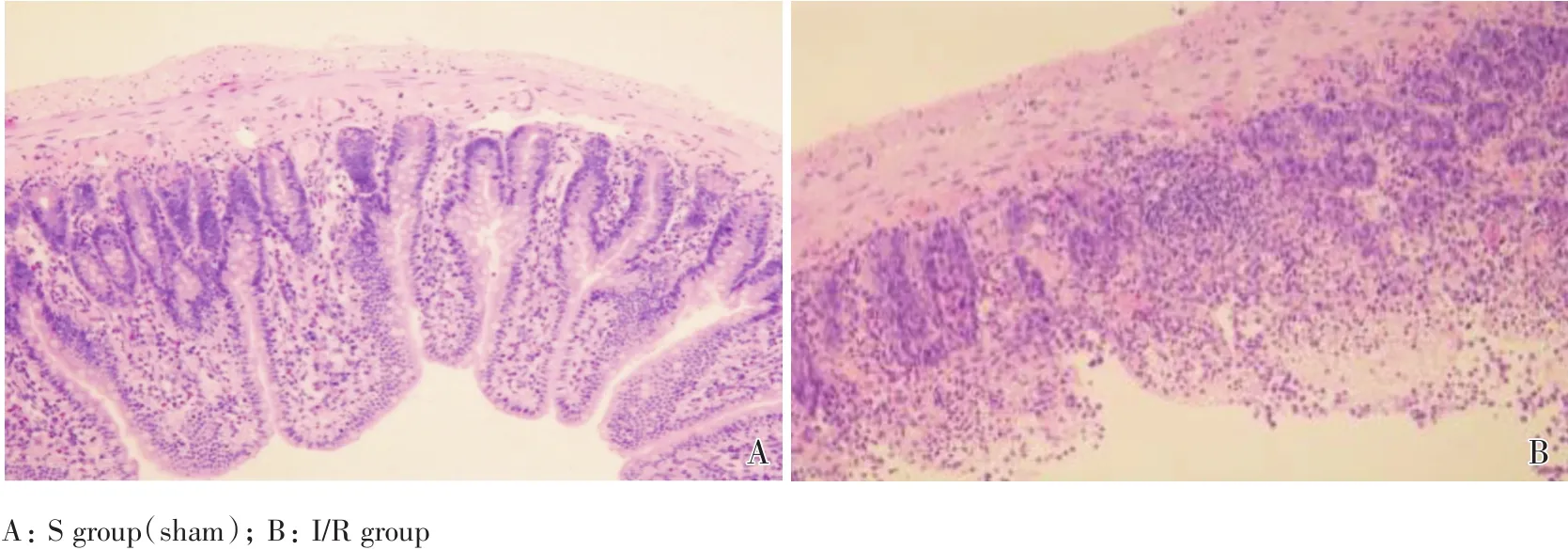
图1 小鼠小肠组织光学显微镜下形态学成像图(×200)Fig.1 Morphological imaging of mouse intestinal mucosa under optical microscope(×200)
再灌注2 h后,S组小鼠的肠黏膜组织完整,未见明显出血及炎症现象;I/R组小鼠的肠绒毛高度水肿,上皮细胞明显脱落,腺体损伤严重,上皮下间隙扩大并与固有层分离,固有层水肿、肠黏膜出现大片的出血和溃疡,血管、淋巴管高度扩张,损伤明显(图1)。与S组(0.37±0.18)比较,I/R组(3.56±0.45)小鼠的小肠组织改良Chiu’s评分升高,差异具有统计学意义(t=15.842,P=0.000,n=6/group,图2),表明本研究中小鼠肠缺血60 min再灌注120 min后,发生了肠损伤,该模型制备成功。
2.2 基因芯片筛选获得小鼠肠I/R损伤肠上皮中差异表达的lncRNA及mRNA
结果对检出的原始芯片数据进行计算和分析,与S组比较,肠I/R损伤后小鼠肠上皮细胞中lncRNA及mRNA发生了明显改变(P<0.05),其上、下调前20位的lncRNA及mRNA聚类结果见图3。
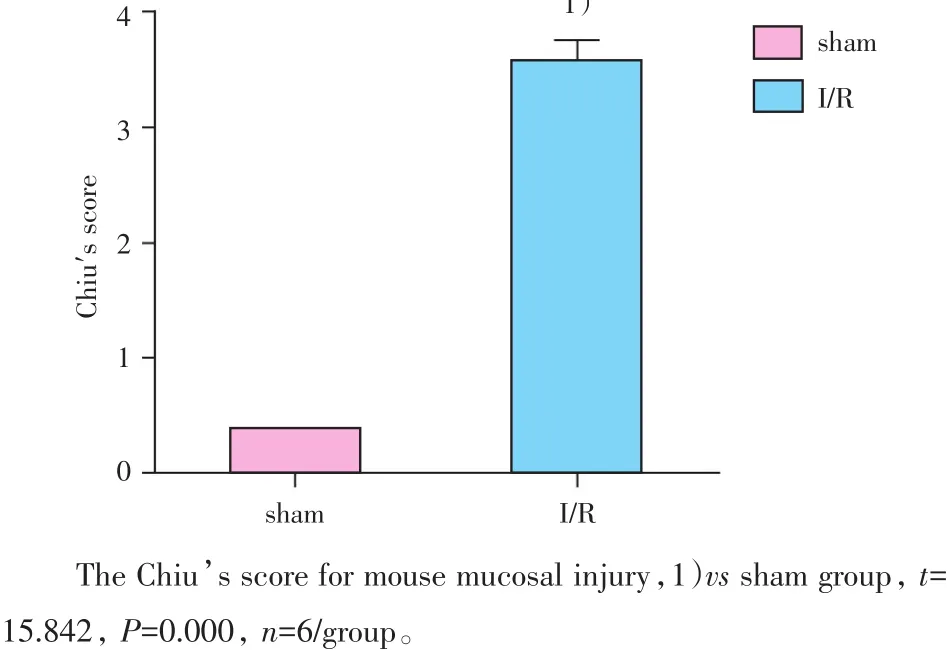
图2 小鼠肠粘膜形态学改良Chiu’s评分变化Fig.2 The Chiu’s score for mouse mucosal injury
总体上,I/R组筛选到差异表达的lncRNA共3 602个,其中差异表达上调的lncRNA有1 503个(Fold change≥2,P<0.05);差 异 表 达 下 调 的lncRNA 有 2 099个(Fold change≥2,P<0.05)。并且在此结果中,差异倍数10倍以上升高的共11个(表3);差异倍数10倍以上降低的共313个(Fold change≥10,P<0.05)。
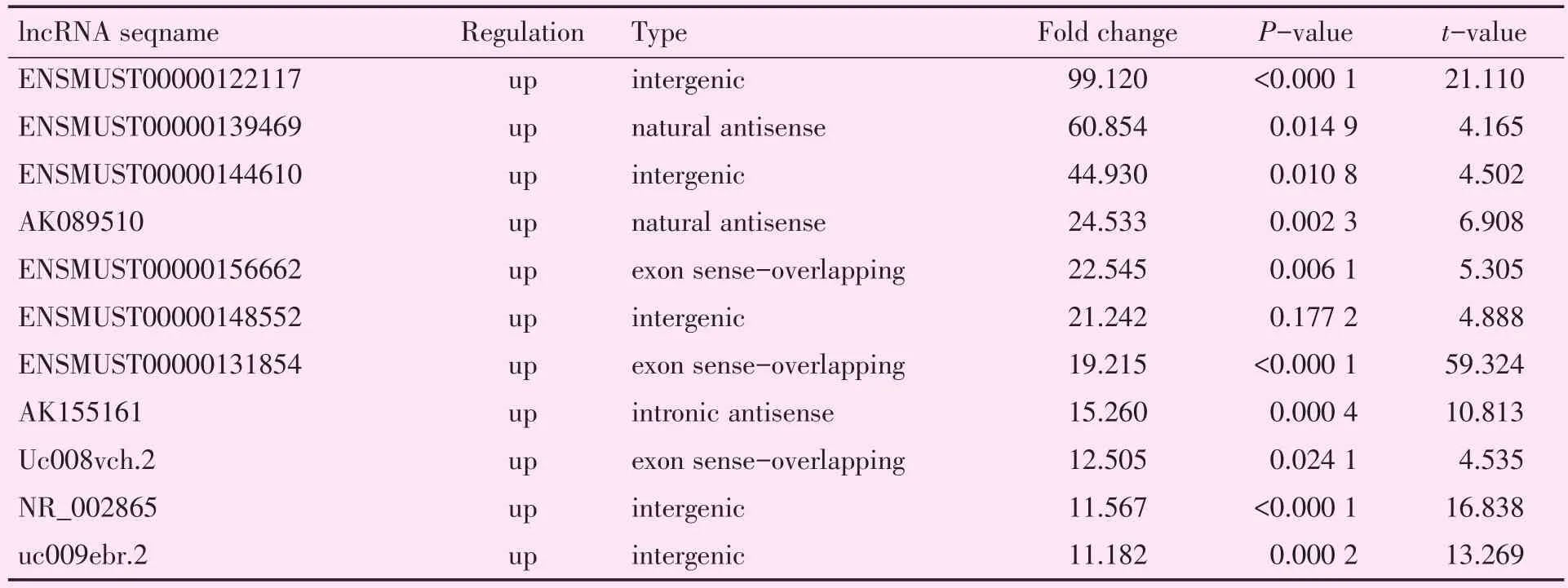
表3 差异表达10倍以上上调的lncRNA(I/R比Sham组)Table 3 Differentially expressed lncRNA(>10.0 fold change,I/R vs Sham)(n=3/group)
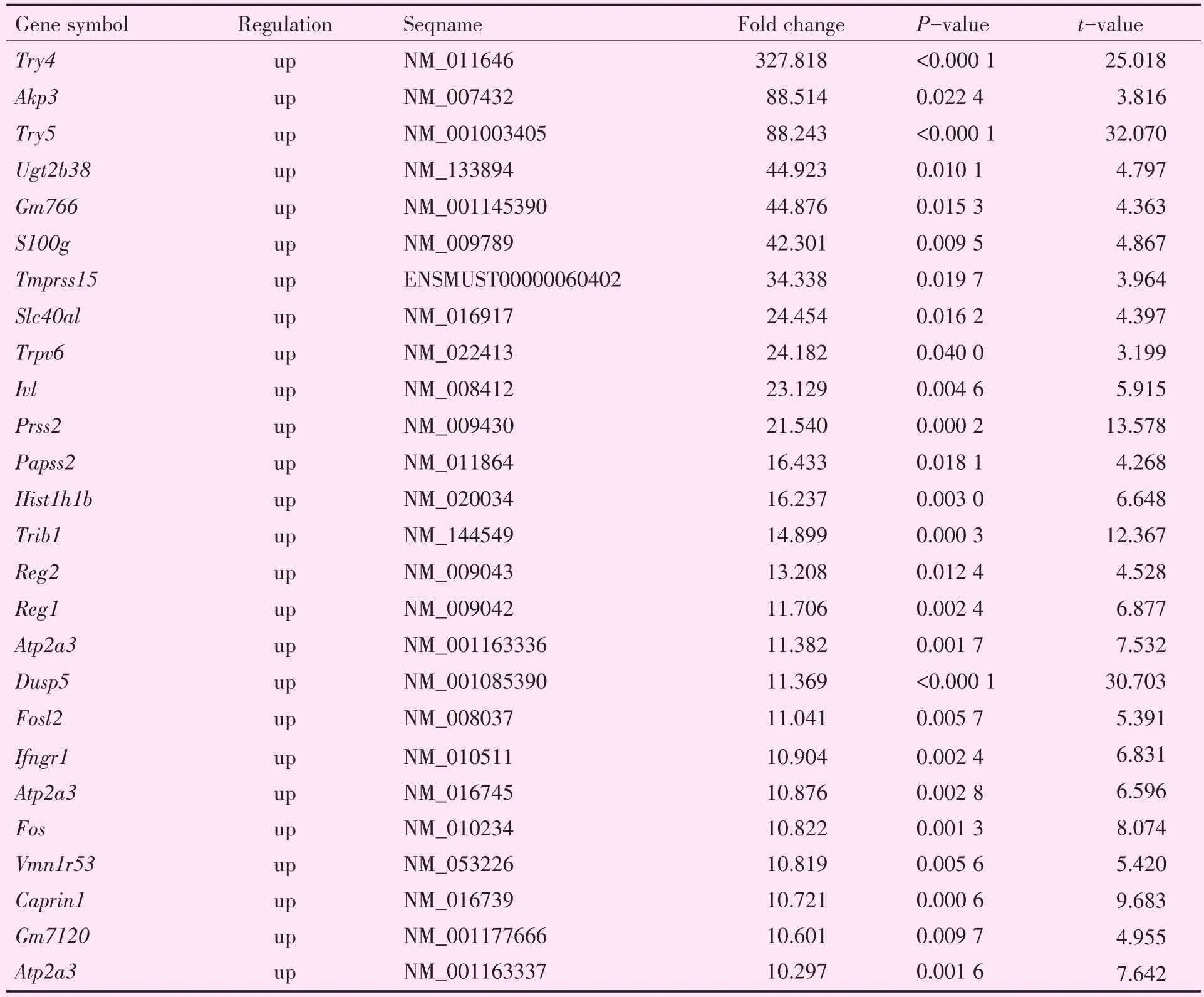
表4 差异表达10倍以上上调的mRNA(I/R比Sham组)Table 4 Differentially expressed mRNA(>10.0 fold change,I/R vs Sham) (n=3/group)
此外,基因芯片还筛选到差异表达的mRNA共3 158个,其中差异表达上调的mRNA有1 528(Fold change≥2,P<0.05);差异表达下调的mRNA有1 630个(Fold change≥2,P<0.05)。10倍以上上调的有26个(表4),10倍以下下调的有410个(Fold change≥10,P<0.05)。经文献检索,在上述上调的mRNA中,“Trpv6、Fos、Papss2、Trib1、Reg2、Reg1、Dusp5、Fosl2”可能跟凋亡相关[6-11]。
2.3 GO数据分析
2.3.1 GO分析差异表达的基因的生物学过程 基因芯片筛选小鼠肠I/R损伤中肠上皮差异基因分析如下:上调的mRNAs主要与脂代谢过程、氧化还原反应、应激、正性调控凋亡过程/程序性细胞死亡、细胞周期、线粒体凋亡改变、MAPK级联、凋亡的诱导/执行、炎性反应、p53介导凋亡、钙离子等有关。差异下调表达相关mRNA,主要与多细胞生物信号、神经冲动转导、细胞分化、解剖结构发展、离子转运、化学稳态、分泌、细胞生长发育、Wnt受体信号通路、负向调控凋亡、内皮细胞增殖、组织重构、VEGF受体信号通路等有关(图4)。
2.3.2 GO分析中的“凋亡”相关条目 从本芯片GO分析的结果中,我们发现差异变化的基因富含了大量的“凋亡”相关功能条目(表5),共29条,其中包括:凋亡的外源性/内源性阶段,凋亡的诱导/执行,凋亡的正性/负性调控,以及不同细胞定位和类型的凋亡调控等。
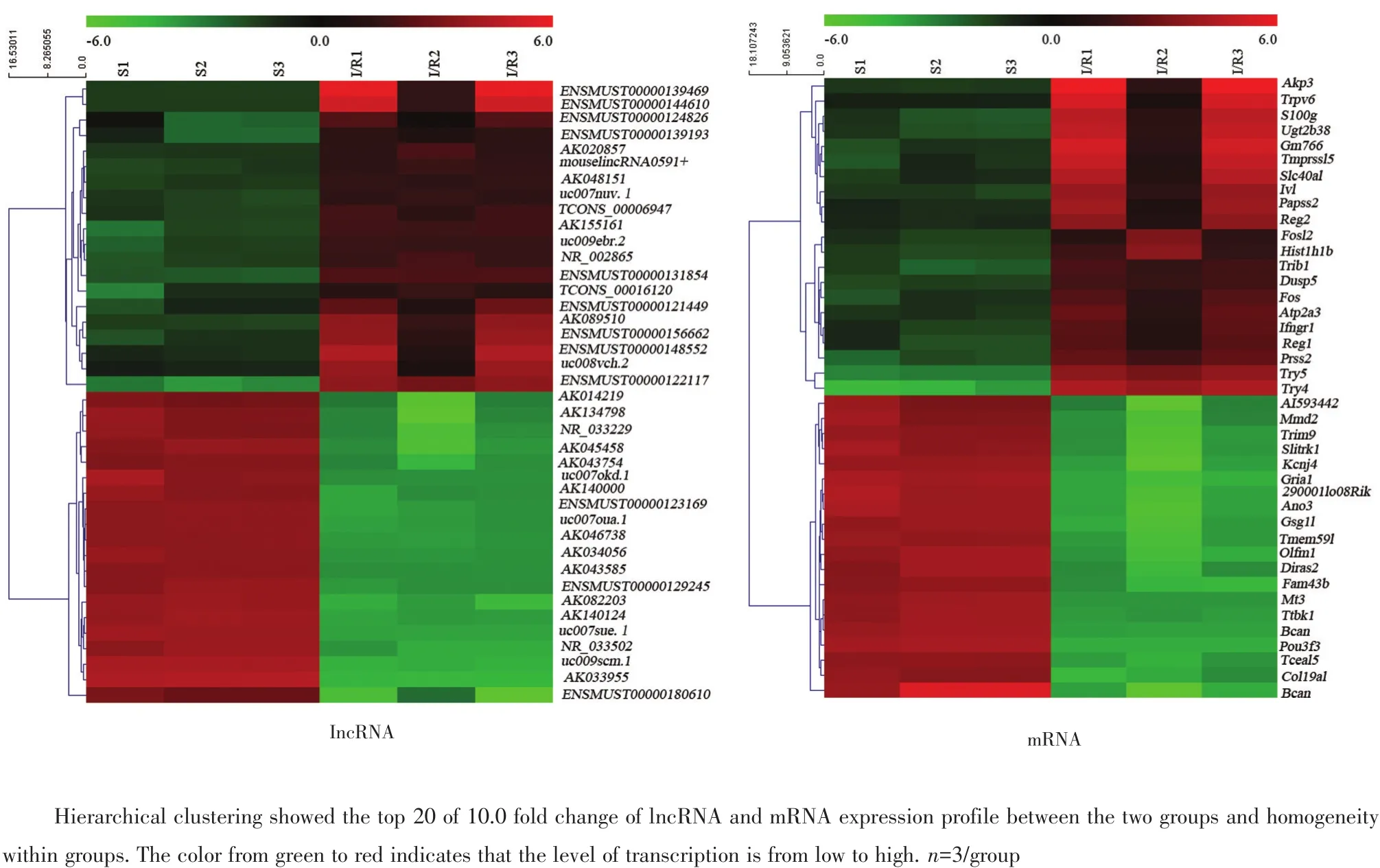
图3 前20位的10倍以上差异表达的lncRNA和mRNA聚类图(I/R比Sham组)Fig.3 The top 20 of hierarchical clustering about 10 fold change of lncRNA and mRNA expression profile(I/R vs Sham)
2.4 实时荧光定量PCR验证上/下调最明显的差异lncRNA
在芯片中,随机挑选了6个显著差异表达的lncRNA,其中 3个上调(ENSMUST00000122117、AK089510、NR_002865),3个下调(uc007oua.1、ENSMUST00000129245、AK014219)。
经实时定量PCR验证发现:与假手术组样本表达水平相比,AK089510(t=8.499,P=0.011 8)、NR_002865(t=8.518,P=0.005 8)在I/R样本内的表达水平显著升高,具有显著统计学意义,而另外两个 ENSMUST00000129245(t=7.760,P=0.025 3)、AK014219(t=5.850,P=0.045 0)在I/R样本内的表达水平明显降低(图5);其中AK089510上调的倍数最高,ENSMUST00000129245下调的倍数最高。qRT-PCR结果与基因芯片表现出较好的一致性。
2.5 将上述验证的lncRNA和所有差异mRNA进行CNC共表达分析
2.5.1 结合go、pathway分析及文献支持,挑选差异凋亡相关基因,在芯片结果中比对信息 通过在芯片GO、Pathway分析结果中上调的凋亡mRNA中进行比对,挑选了与肠I/R文献表达相符的10个mRNA,分别为:Stat3、Vdac1、Casp8、Fasl、Gadd45a、Casp6、Dusp6、Aifm1、Atf4、Bad( 表6)[12-15]。
2.5.2 经过CNC共表达生物信息学分析,将10个凋亡mRNA和存在高度相关性的 lncRNA构建了共表达网络关系图 通过分析上述10个mRNA和芯片所有差异lncRNA的CNC共表达关系,尤其关注第一部分已行qPCR验证的4个lncRNA(AK089510、NR_002865、ENSMUST00000129245、AK014219),构成了如下具有高度相关性的CNC共表达网络关系图(图6、表7)。

图4 GO分析差异表达的基因的生物学过程Fig.4 Biological process of GO analysis for differentially expressed mRNAs
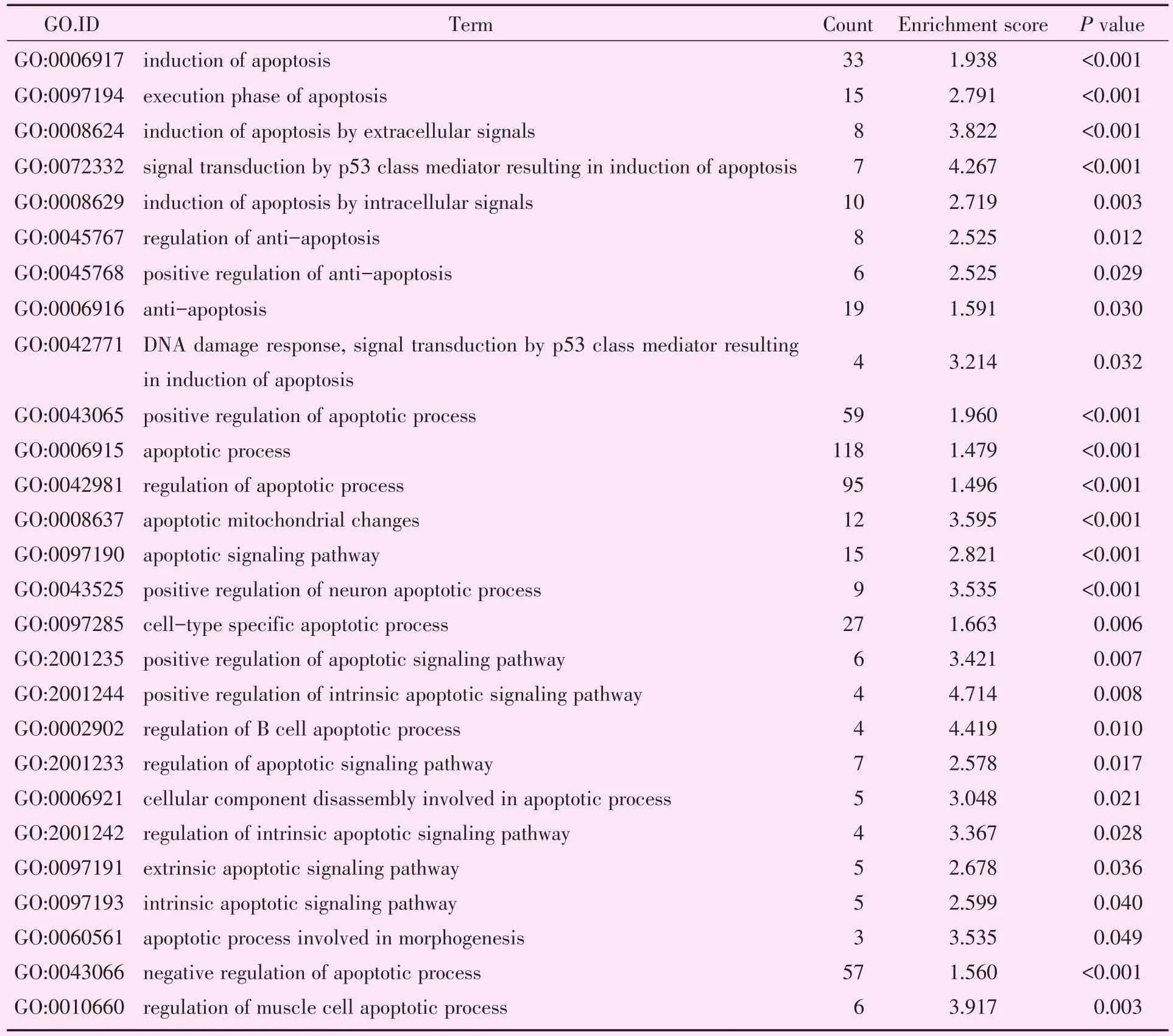
表5 凋亡相关GO分析条目Table 5 Apoptosis associated GO analysis items
CNC共表达结果示,上述凋亡mRNA和大量差异表达的lncRNA存在高度相关性,是一对多的关系。在此图中共有726个结点,其中10个为上述mRNA,其余716个为lncRNA,它们共同组成了885对高度相关的共表达基因对。
红色为芯片所有差异表达的lncRNA,绿色为经qPCR验证的lncRNA,蓝色node为挑选的差异凋亡mRNA。图中实线表示两个结点内的基因之间存在正相关性,虚线则表示两个两个结点内的基因之间存在负相关性,mRNA和lncRNA对的共表达程度用实线或虚线的长度进行表示。
3 讨论
3.1 肠I/R后小鼠肠上皮细胞lncRNA表达谱发生显著变化
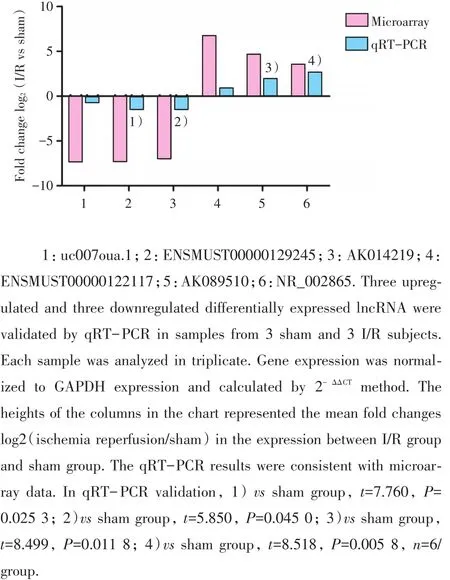
图5 随机挑选6个lncRNA的microarray和qRT-PCR验证结果比较Fig.5 Comparison of 6 randomly selected lncRNAs expression level between microarray and qRT-PCR validation
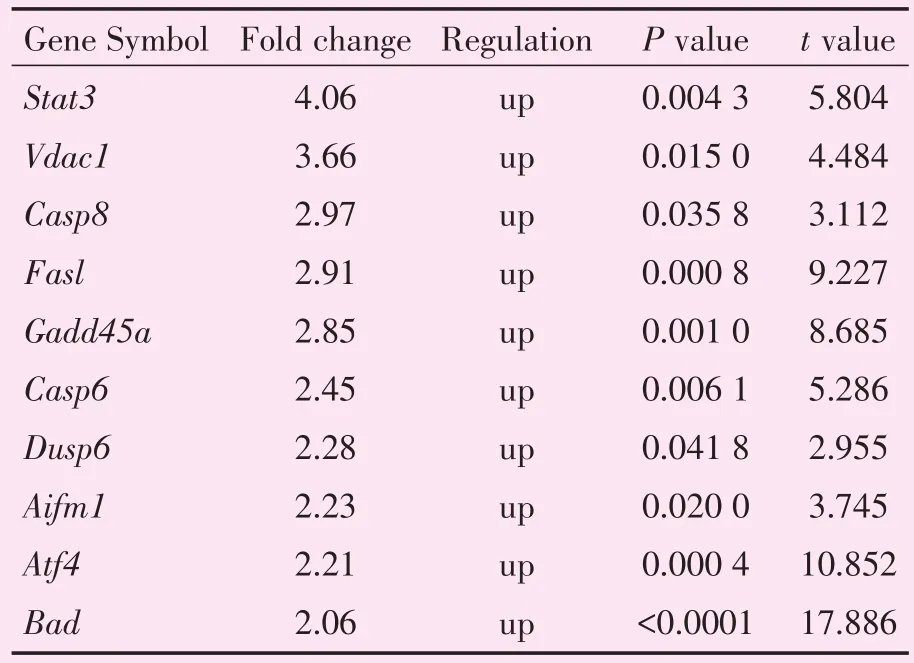
表6 挑选的10个凋亡mRNA在芯片结果中的比对信息Table 6 Ten apoptosis associated and differentially expressed mRNA in the microarray profiling(n=3/group)

表74 个验证的lncRNA与上述凋亡相关mRNA的共表达分析Table 7 The co-expression analysis of 4 validated lncRNA and the above apoptosis associated mRNA
近年来,曾被误认为基因转录“暗物质”的长链非编码RNA成为研究的热点。在人类基因组中,和大约只有1%比例的具有蛋白编码功能的RNA相比,占绝大部分比例的lncRNA虽然没有或很少具有蛋白质编码功能,但却被发现参与了重要的生物学功能,如调控细胞增殖、细胞周期、细胞分化、细胞凋亡等[16]。lncRNA的异常表达与人类疾病密切相关,比如肿瘤、代谢性疾病等,且在相关领域中有望成为诊断和治疗的新型靶点[17-18]。然而,lncRNA的变化和作用在器官I/R损伤的研究中只是冰山一角[19-21],尤其在肠I/R中尚无深入而全面的报道。
本研究成功的复制了小鼠肠缺血再灌注模型,并且在SMA缺血60 min再灌注120 min的时间点获取肠黏膜组织,应用Arraystar小鼠lncRNA V3.0基因芯片技术对其进行差异表达lncRNA的筛选。结果显示,与假手术组相比,肠I/R后小鼠肠上皮细胞lncRNA表达谱发生了显著变化。经聚类分析发现,总共有3602个lncRNA发生了差异性表达,其中差异倍数2倍以上共有上调lncRNA 1 503个,下调2 099个;差异倍数10倍以上的共有11个lncRNA上调,313个下调。
与此同时,本芯片筛选出小鼠肠I/R后mRNA在肠上皮细胞的表达也发生了明显的改变。差异表达的mRNA总共有3 158个,其中差异倍数2倍以上共有1 528个上调,1 630个下调;差异倍数10倍以上26个上调,410个下调。
为了进一步验证芯片结果的可靠性,我们结合lncRNA差异倍数、P值、长度、表达水平等多种方法,挑选了6个lncRNA行实时定量 PCR检测,结果发现AK089510、NR_002865、ENSMUST00000129245和 AK014219的验证结果和芯片一致;其中AK089510上调的倍数最高,ENSMUST00000129245下调的倍数最高。该结果提示AK089510、NR_002865、ENSMUST00000129245、AK014219在肠I/R损伤的发生发展中可能发挥了重要功能,为后继研究打下基础。

图6 10个凋亡mRNA和其高度相关的lncRNA共表达网络图(pcc≥0.995,FDR≤0.01)Fig.6 The co-expression networks of 10 apoptosis associated mRNAs and their highly correlated lncRNAs(pcc≥0.995,FDR≤0.01)
3.2 凋亡是肠I/R后小鼠肠上皮差异lncRNA表达谱富集的重要功能
肠缺血再灌注损伤是一个多因素作用的复杂病理生理过程,受氧化应激、氧自由基、钙超载、细胞因子、细菌感染及内毒素刺激、肠道菌群和毒素移位、免疫反应等多因素独立或共同作用[22-23]。本研究结果通过计算GO分析的富集指数分析出,上调的mRNA主要与脂代谢过程、氧化还原反应、应激、正性调控凋亡过程/程序性细胞死亡、细胞周期、线粒体凋亡改变、MAPK级联、凋亡的诱导/执行、炎性反应、p53介导凋亡、钙离子等有关。同时,差异下调表达相关mRNA主要与多细胞生物信号、神经冲动转导、细胞分化、解剖结构发展、离子转运、化学稳态、分泌、细胞生长发育、Wnt受体信号通路、负向调控凋亡、内皮细胞增殖、组织重构、VEGF受体信号通路等有关。上述GO分析主要富集的功能,符合既往I/R损伤方向特别是肠I/R损伤研究的经典理论,该结果在本lncRNA芯片中得到了很好的体现,同时也提示了芯片结果的可靠性。
特别值得注意的是,在位居前15位的重要GO功能中,“凋亡”这一过程,在上调和下调基因参与的生物学进程中都占有重要位置。尤其是上调的GO分子功能条目的注释结果显示,涉及“apoptosis”这一术语相关的子条目在GO分子功能条目的注释结果中反复多次出现,并且富集指数排在前列,同时涵盖了线粒体凋亡、内质网应激、内源性/外源性凋亡、凋亡诱导/执行等绝大部分重要的凋亡经典过程;这一现象提示肠I/R过程中“凋亡”功能发生了显著改变,不仅符合既往对肠I/R损伤肠上皮细胞死亡方式的解读[24-26],也再一次提示了凋亡可能是其主要的死亡方式。
3.3 差异表达的lncRNA和凋亡基因间有着极其密切的共表达网络关系
由于lncRNA不编码蛋白,其生物学功能的注释复杂而困难。然而,基因芯片筛选lncRNA时,也筛选了同时差异表达的mRNA,我们可以从已知功能的mRNA角度出发,通过CNC共表达分析计算出与该mRNA具有相同表达模式的lncRNA,剔选出表达显著相关的IncRNA-mRNA关系对;通过这些熟知mRNA的功能,来推导lncRNA的功能,将lncRNA与特定生物学进程连系起来,从而利于揭示其作用和相关机制[27]。
因此在本部分研究中,我们挑选了芯片中代表性的已知凋亡相关mRNA与所有差异表达的lncRNA进行了共表达分析。这些mRNA较全面涉及了caspase依赖(线粒体、死亡受体、内质网)/非caspase依赖、内源性/外源性凋亡的经典通路,同时在本研究芯片mRNA筛选结果中均为显著差异表达(P<0.05)。结果显示,大量的差异lncRNA和凋亡mRNA存在着高度相关性(pcc≥0.995,FDR≤0.01),为一对多的关系,构成了复杂的共表达网络,提示有大量的lncRNA可能通过这些凋亡相关基因,参与了肠I/R损伤“凋亡”机制的调控。
并且,本研究中4个已验证的lncRNA和部分高度相关的凋亡mRNA间极有可能存在调控关系:AK089510正调控 Casp6和 Gadd45a,NR_002865正调控 Fasl,ENSMUST00000129245 负调控Bad,提示这些高度相关的共表达mRNA与上述4个lncRNA具有极其相同的表达模式,极有可能是后者调控凋亡的靶基因,下一步我们将在后继的功能和机制研究中进行验证。
总之,在本研究中我们首次采用了lncRNA V3.0芯片技术对小鼠肠I/R肠黏膜样本进行了研究,揭示了肠上皮细胞lncRNA和mRNA的表达情况,成功建立了肠黏膜上皮细胞在肠I/R后早期的差异变化lncRNA基因表达谱,为后续相关领域提供了重要的数据基础。同时,通过生物信息学深入分析lncRNA的功能角色,GO富集出调控“凋亡”是其参与肠I/R损伤的重要功能,CNC分析出差异表达的lncRNA和凋亡基因间有着极其密切的共表达网络关系,构建出高度相关的IncRNA-凋亡相关mRNA关系对,将为进一步深入研究差异表达lncRNA的功能和机制提供方向。

