沙门菌实时荧光定量PCR快速检测方法的建立
田赛,郭卫光,包仁龙,向莹,张浩然,杨超杰,谢靖,刘鸿博,宋宏彬,邱少富,杜昕颖
中国人民解放军疾病预防控制中心,北京100071
沙门菌是一种革兰阴性菌,属肠杆菌科,是常见的食源性肠道致病菌[1]。食用受污染的生肉、家禽、蛋类、乳制品等可使人发生食物中毒,由致病性沙门菌引起的人类疾病通常被称为沙门菌病[2]。沙门菌病对全球特别是发展中国家的公共卫生构成严重威胁,在中国沙门菌病占食源性疾病的40%~60%[3]。因此,快速、准确地检测沙门菌对沙门菌病的有效防治是十分必要的。沙门菌鉴定的传统方法主要根据形态学特征、培养特征、生理生化特征、抗原特征、噬菌体特征等。细菌培养是鉴定肠道致病菌的金标准,但这一过程耗时较长,需3~5 d[4-5]。基于抗原和噬菌体检测法只能针对活细菌,敏感性较低,容易出现假阴性情况,特异性差[6]。与传统方法相比,基于核酸特异性序列分子方法的实时荧光定量PCR 具有快速、敏感、特异且稳定的优点。我们根据沙门菌特异的外膜孔蛋白F基因(ompF)[7]的特异性序列设计合成引物及TaqMan 探针,建立了可快速检测沙门菌的实时荧光定量PCR 法。
1 材料与方法
1.1 材料
甲型副伤寒沙门菌,乙型副伤寒沙门菌,丙型副伤寒沙门菌,猪霍乱沙门菌,鼠伤寒沙门菌,肠炎沙门菌,旺兹沃思沙门菌,亚利桑纳沙门菌,汤卜逊沙门菌,痢疾志贺菌,弗氏志贺菌,宋内志贺菌,鲍氏志贺菌,副溶血弧菌,霍乱弧菌,大肠埃希菌EAEC、EPEC、ETEC、STEC,均为解放军疾病预防控制中心实验室保存。
基因组DNA 提取试剂盒和质粒提取试剂盒购自天根生化科技有限公司;2×GoldStar Best MasterMix和ddH2O 购自康为世纪生物科技有限公司;沙门菌检测试剂盒(探针法)购自卓诚惠生生物科技股份有限公司(XABT);Eppendorf 5424 离心机;BAIYANG 400C 离心机;DeNovix DS-11 FX超微量紫外荧光分光光度计;Molecular Devices SpectraMax i3x酶标仪;BIO-RAD CFX96荧光定量PCR仪。
1.2 引物与TaqMan 探针的设计与合成
根据GenBank 中沙门菌ompF基因的保守序列,用Primer Express 3.0 软件设计引物和探针。上游引物为5'-CCTGGCAGCGGTGATCC-3',下游引物为5'-AAATTTCTGCTGCGTTTGCG-3',探针为FAM-TGCCCTGCTGGCTGCTGCA-BHQ1,由上海生工生物工程股份有限公司合成。
1.3 模板的制备
采用DNA 提取试剂盒提取和热变性法2种方法制备DNA 模板。用天根生物公司的DNA 提取试剂盒提取细菌的基因组DNA,提取方法参照说明书,用DeNovix 超微量紫外荧光分光光度计测定DNA的浓度和纯度。热变性制备DNA 模板的方法参照文献[8]。
1.4 质粒标准品的制备
以沙门菌基因组DNA 为模板,用ompF基因的上下游引物Blast 相应基因序列,采用生工生物公司基因合成技术连接到pUC57 载体上,合成对应甘油菌。菌液用含氨苄青霉素的培养基于37℃过夜培养,用天根生物公司的质粒提取试剂盒提取重组质粒。用DeNovix 超微量紫外荧光分光光度计测定质粒浓度后用ddH2O 对质粒进行1/10 梯度稀释,浓度为1.0×100~1.0×10-8ng/μL。
1.5 荧光定量PCR 反应体系的建立
荧光定量PCR 反应体系为25 μL,包括2×GoldStar Best MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,探针(10 μmol/L)1 μL,模板2 μL,ddH2O 7.5 μL。用BIO-RAD CFX96 荧光定量PCR 仪按如下程序进行扩增:95℃预变性10 min;95℃15 s,60℃40 s,扩增40个循环,每个循环延伸结束时(60℃)进行荧光信号检测。荧光通道选择FAM。
1.6 荧光定量PCR检测方法的特异性
以前述9种不同血清型沙门菌和10种其他肠道致病菌的基因组DNA 为模板,用上述荧光定量PCR 反应体系进行扩增,验证方法的特异性。
1.7 荧光定量PCR检测方法的敏感性
以2 μL 梯度稀释的质粒为模板进行荧光定量PCR 扩增,用Excel 软件分析模板浓度与Ct值之间的关系,以质粒浓度的对数值为横坐标、Ct值为纵坐标绘制标准曲线,通过趋势线和相关系数对实时荧光TaqMan PCR检测体系的检测敏感性进行评价。
以甲型副伤寒沙门菌为阳性对照,制备菌悬液,用SpectraMax i3x 酶标仪测定D600nm值,取培养好的沙门菌菌液100 μL 用PBS 对菌液进行1/10梯度稀释,将稀释液涂布在培养基上,37℃培养24 h后进行菌落计数,计算菌液浓度,选择浓度100~106CFU/mL的菌液,用天根生物公司的DNA提取试剂盒提取细菌基因组DNA,以2 μL 梯度提取的基因组DNA 为模板进行荧光定量PCR 扩增,根据检出Ct值和基因组DNA 对应菌量浓度的对数值用Excel 软件绘制标准曲线,得到趋势线和相关系数,判断实时荧光TaqMan PCR检测体系的检测敏感性。
1.8 荧光定量PCR检测方法的重复性
以浓度分别为1.0×10-1、1.0×10-2、1.0×10-3、1.0×10-4、1.0×10-5ng/μL的质粒为模板,进行上述荧光定量PCR 扩增,重复5 次。通过统计学方法分析各组Ct值之间的变异系数(CV),评价实时荧光TaqMan PCR检测体系的检测重复性。
提取浓度分别为105、104、103、102CFU/mL的菌液基因组DNA,以此为模板进行荧光定量PCR扩增,重复5 次。记录各组Ct值并进行统计学分析得到CV,评价实时荧光TaqMan PCR检测体系的检测重复性。
1.9 荧光定量PCR检测方法的临床应用

图1 特异性实验结果
采用天根生物公司的DNA 提取试剂盒提取实验室采集的海鲜样本消化腺基因组DNA,分别利用建立的沙门菌TaqMan 实时荧光定量PCR 法及卓诚惠生沙门菌检测试剂盒(探针法)对基因组DNA 进行检测,统计比较二者最终沙门菌阳性检出率。
2 结果
2.1 反应特异性
采用荧光定量PCR 方法扩增阳性对照质粒、沙门菌及10种相关肠道病原菌的基因组DNA,结果见图1。阳性质粒和沙门菌基因组DNA 扩增后呈S 型扩增曲线,其他病原基因组DNA 及阴性对照均没有扩增,说明建立的荧光定量PCR检测方法具有非常高的特异性。
2.2 反应敏感性
将阳性质粒1/10 梯度稀释至浓度依次为1.0×100~1.0×10-8ng/μL,用稀释后的质粒作为模板进行荧光定量PCR 扩增,结果见图2。当质粒浓度为1.0×100~1.0×10-7ng/μL 时,Ct值随浓度降低而增大,表明在该范围内能准确定量,最低检出限为0.1 ng/L。根据反应体系中的质粒浓度和扩增的Ct值,计算得到标准曲线y=-3.43x+14.135,相关系数为0.9978(图3),表明沙门菌基因组DNA的浓度与Ct值相关。
以100~106CFU/mL菌液所提基因组DNA为模板进行荧光定量PCR 扩增,结果见图4,除100CFU/mL 无扩增曲线外,其他浓度均有扩增曲线,表明反应敏感性为10 CFU/mL。根据反应体系中基因组DNA 对应的菌量浓度和扩增的Ct值,计算得到标准曲线y=-3.2923x+41.425,相关系数为0.987(图5),表明沙门菌基因组DNA的浓度与Ct值相关。

图2 阳性质粒敏感性实验结果
2.3 反应重复性
选取1.0×10-1、1.0×10-2、1.0×10-3、1.0×10-4、1.0×10-5ng/μL 共5个浓度的标准品,对建立的反应体系分别进行5 次重复检测,记录各组检测Ct值并计算变异系数,结果见表1。可以看出,这5个浓度荧光定量PCR检测Ct值的变异系数均小于0.6%,说明建立的检测方法重复性极高。
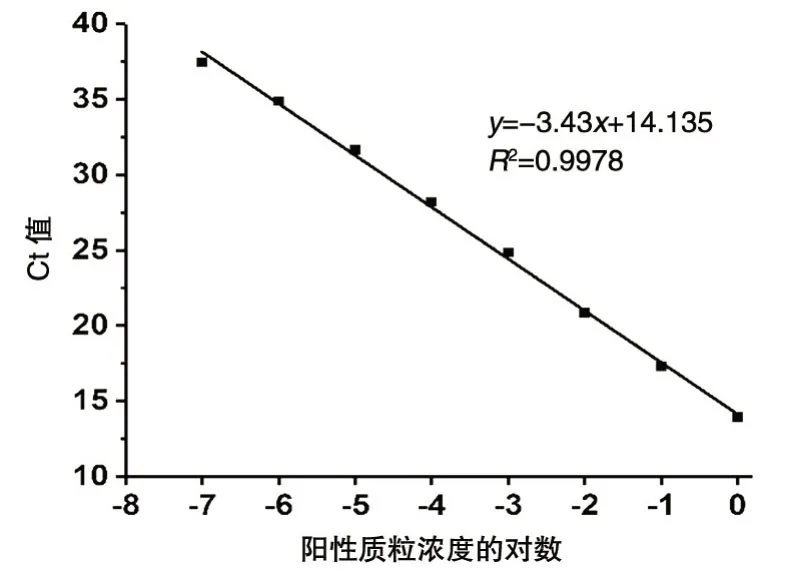
图3 阳性质粒实时荧光定量PCR检测标准曲线

图4 菌株样本敏感性实验结果

图5 菌株样本实时荧光定量PCR检测标准曲线
选取菌液浓度为105、104、103、102CFU/mL 共4个浓度提取的基因组DNA,对建立的反应体系分别进行5 次重复检测,并计算Ct值的变异系数,结果见表2。4个浓度荧光定量PCR检测Ct值的变异系数均小于0.8%,可以看出建立的检测方法重复性极高。
2.4 实际样本的检测
2019年7月本实验室共接收海鲜样本50 份,对海鲜样本消化腺及人粪便样本进行前处理后,采用天根生物公司的DNA 提取试剂盒提取基因组DNA,利用建立的沙门菌TaqMan 实时荧光定量PCR 法对基因组DNA 进行快速检测,最终检出沙门菌阳性19 份(38.0%)。用卓诚惠生沙门菌检测试剂盒(探针法)对基因组DNA 进行检测,最终检出沙门菌阳性19 份(38.0%)。对比发现建立的沙门菌TaqMan 实时荧光定量PCR 法与卓诚惠生沙门菌检测试剂盒对沙门菌检出阳性率相同,说明建立的检测方法可以用于临床应用。
3 讨论
沙门菌为革兰阴性肠道杆菌,是一种侵袭性细菌,能够进入多种宿主细胞,包括回肠黏膜上皮细胞、巨噬细胞以及网状内皮系统的其他细胞和组织[9],作为一种人类致病菌每年都会导致大量死亡和严重疾病病例,在全世界被广泛关注。沙门菌通常通过粪口途径感染个体,动物或动物制品是最常见的感染源,新鲜农产品等间接受沙门菌污染的食品也会导致大量病例。由致病性沙门菌引起的疾病症状包括水样腹泻、恶心、腹痛、发烧和头痛,在某些情况下能侵入人体成为系统性疾病[2]。老年人、极年幼者和免疫功能低下者发生并发症和死亡的风险更高。因此,快速、准确地检测沙门菌,对临床疾病的有效治疗、防止疾病的传播以及食品安全的保障具有重要意义。

表1 阳性质粒重复性检测结果
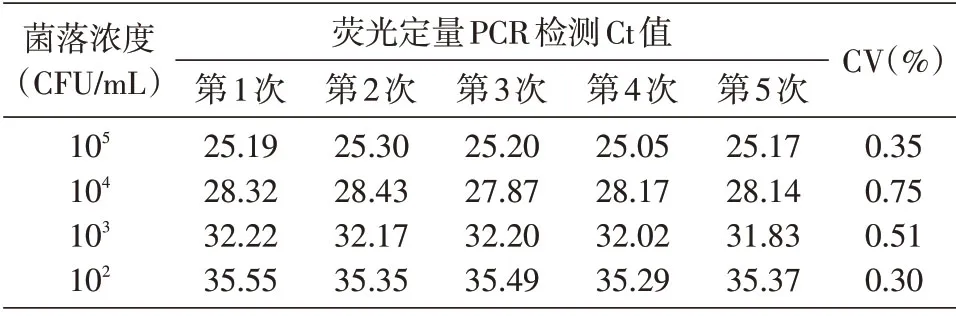
表2 菌株样本重复性检测结果
实时荧光定量PCR 是一种以PCR 为基础建立的新技术,该技术扩增与检测分析同时进行,具有快速、敏感、特异等优点[10-11]。之前Gallegos-Robles 等[12]将invA基因用于沙门菌的实时荧光定量PCR检测。但由于invA基因是通过水平基因转移获得的SPI1 上的毒力基因,在沙门菌某些血清型中可能存在该基因不稳定或缺失的情况[13]。因此,利用实时荧光定量PCR 技术对沙门菌进行快速分子检测,除了利用invA基因外,还应考虑其他靶点。研究表明靶点ompF为所有血清型沙门菌都具有的外膜孔蛋白基因[7],经在GenBank 中Blast 搜索发现,与ompF基因高度同源的序列只有沙门菌,表明ompF基因针对沙门菌具有覆盖度高、特异性强的优点。我们选用该基因的特异性序列设计了引物和TaqMan 探针,利用pUC57 载体构建了重组阳性质粒。确定PCR 反应体系及反应条件后,同时对沙门菌阳性质粒、9种不同型别的沙门菌,以及10种其他不含沙门菌的肠道病原菌基因组DNA 进行了扩增检测,最终所有沙门菌及其阳性质粒呈S 型扩增曲线,其他细菌没有扩增,充分证明建立的沙门菌实时荧光定量Taq⁃Man PCR检测方法具有高度特异性和覆盖性。利用该方法分别对1/10 梯度稀释的1.0×100~1.0×10-8ng/μL 范围内的阳性质粒和100~106CFU/mL范围内的沙门菌基因组DNA 进行了敏感性检测及重复实验,最终检测灵敏度分别为1.0×10-7ng/μL和101CFU/mL,而且2种扩增曲线与对应模板浓度都呈很好的线性关系,重复实验的Ct值变异系数也都低于0.8%。2013年杜雄伟等[14]建立的肉制品中沙门菌invA基因实时荧光定量PCR检测方法的灵敏度为101CFU/mL,重复实验的Ct值变异系数为0.96%。与其对比,2种方法的检测灵敏度一致,但我们建立的方法Ct值变异系数更低,充分证明了此次建立的方法具有灵敏度高、稳定性好的特点。利用建立的方法与卓诚惠生沙门菌检测试剂盒分别对实验室50 份实际海鲜样本中沙门菌进行检测,最终2种检测方法的阳性检出率都为38.0%,说明建立的方法可有效应用于临床检测、食品安全监测等领域。
综上所述,本工作建立了沙门菌TaqMan 实时荧光定量PCR检测方法,该方法具有特异性强、灵敏度高、稳定性好、方便快捷等优点,同时我们也已经将该方法应用于实验室日常保障检测任务中,对沙门菌疫情防治具有重要意义。

