炎症条件下毛状样蛋白1促进淋巴细胞与血管内皮细胞的黏附及迁移
骈亚亚,陶凤蓉,冯敏,聂晶晶,高振祥,胡继红
1.北京医院 国家老年医学中心 国家卫生健康委临床检验中心,中国医学科学院 老年医学研究院;2.北京医院 检验科 国家老年医学中心,中国医学科学院 老年医学研究院;3.北京医院 风湿免疫科 国家老年医学中心,中国医学科学院 老年医学研究院;北京100730
淋巴细胞是机体参与正常免疫应答及炎症反应的重要细胞,其发育成熟后向二级淋巴组织进行迁移。高内皮细胞小静脉(high endothelial venule,HEV)是存在于淋巴结等二级淋巴器官(除脾脏)的后毛细静脉,是淋巴细胞迁移的重要通道[1-2]。当初始淋巴细胞遇到特异性抗原或有炎症刺激时,会穿过血管内皮迅速迁移至感染部位行驶其免疫功能[3]。研究表明,淋巴细胞的大量浸润在某些疾病的发生发展过程中起重要作用,明确其机理对于疾病的防治有重要意义。
淋巴细胞迁移是一个非常复杂的过程,涉及到淋巴细胞与内皮细胞的相互作用。淋巴细胞通过自身受体L-selectin、PSDL-1、MadCAM-1与血管内皮细胞表面配体PNAd、P-selectin、E-selec⁃tin、MadCAM-1 结合后被内皮细胞捕获[4-5],随后,淋巴细胞通过整合素受体或白细胞功能相关抗原与血管内皮细胞表面的黏附分子ICAM-1、VCAM-1、MAdCAM-1 结合,从而启动钙离子信号通路,肌动蛋白微丝收缩,血管内皮细胞间的紧密连接破坏,淋巴细胞随之迁移[5-6]。在趋化因子CCL19、CCL21的趋化作用下,淋巴细胞跨越血管内皮细胞到达各个组织,行使其免疫监视和免疫保护功能。
我们前期筛选出一些在小鼠胰岛血管内皮细胞MS1 上高表达的基因,比如毛状样蛋白1(co⁃actosin-like protein-1,Cotl1)基因,这些基因可能影响淋巴细胞的迁移。据报道,Cotl1 对小鼠新皮层神经元的迁移产生一定的影响[7],Cotl1在小鼠皮质发生过程中抑制神经元迁移[8],而Cotl1在淋巴细胞迁移中的机制没有报道。因此,我们在此拟探讨炎症条件下Cotl1 调节淋巴细胞的迁移,该研究对于深入理解淋巴细胞跨内皮细胞向外周淋巴结迁移具有重要的指导意义。
1 材料和方法
1.1 材料
小鼠胰岛血管内皮细胞MS1、大肠杆菌DH5α、敲除质粒puro_Cas9_empty 由本室保存;引物合成及测序由Invitrogen 公司完成[sgRNA 引物为Cotl1-F(5'-CACCGTCTCTCCGAGGACCTTAGC T-3')和Cotl1-R(5'-AAACGGTGCCCACCCTCTTT CAAAA-3'),ICAM1、VCAM1、P-selectin RT-PCR引物为本室保存]。DMEM细胞培养基、胎牛血清、青链霉素购自Hyclone 公司;LipofectAMINE 2000 转染试剂、嘌呤霉素购自Invitrogen 公司;BsmBⅠ内切酶、DTT 购自Thermo Scientific 公司;LPS、CCL19 购自Peprotech 公 司;流 式 抗 体购 自eBioscience 公司;RNA 提取试剂盒购自全式金生物技术有限公司;TaqDNA 聚合酶、实时定量PCR SYBR Premix ExTaq、T4DNA 连接酶购自大连宝生物工程有限公司;氨苄青霉素购自Sig⁃ma 公司;质粒小量提取试剂盒、DNA 凝胶回收试剂盒购自广州东盛生物科技有限公司;基因组提取试剂盒购自北京天为时代生物科技有限公司;Transwell 小室(5 μm)、细胞培养皿及培养板购自Corning 公司;实时荧光定量PCR 仪ABI 7500 购自美国应用生物系统公司;流式细胞仪BD LSRFort⁃essa 购 自 美国BD 公 司。
1.2 敲除载体的构建
利用在线网站http://crispr.mit.edu 设计sgRNA引物并构建敲除载体,通过核酸电泳及测序进行验证。
1.3 敲除细胞系的筛选及鉴定
铺5×104MS1细胞于6 孔板,过夜培养直至细胞密度达到60%左右即可用于转染。将1~2 μg 敲除质粒用LipofectAMINE 2000 转染,其中不转染质粒的孔为空白对照;用终浓度为2.5 μg/mL的嘌呤霉素筛选72 h,直至空白对照细胞全部被杀死;胰酶消化剩余细胞,计数并将30~50个细胞接种至96 孔板,以确保能筛选到单个细胞;单个细胞经1周培养后,剔除有2个细胞以上的孔,转移至48 孔板扩大培养,然后接着6 孔板培养直至长满单层细胞;提取基因组并PCR 测序,将正确的敲除细胞系于液氮中保存。
1.4 淋巴细胞与血管内皮细胞黏附实验
5×104细胞铺于48 孔板直至长成单细胞层;DMEM 洗2 次,并加终浓度 为10 ng/mL的LPS 刺激过夜;DMEM 洗2 次,取野生小鼠腹股沟和腋窝淋巴结,研磨、计数,按内皮细胞∶淋巴细胞为1∶8的比例进行黏附实验,时间为24 h;DMEM 洗5次,胰酶消化后流式细胞术分析,根据细胞大小区分内皮细胞和淋巴细胞,并统计淋巴细胞占总细胞的百分比。
1.5 血管内皮细胞表面黏附分子检测实验
RT-PCR和流式抗体检测MS1细胞和敲除细胞Cotl1-/-表面黏附分子ICAM1、VCAM1、P-selectin的表达情况,其中LPS的用量为0、2.5、5和10 ng/mL。LPS 作用24 h后,处理细胞并进行RT-PCR,HPRT 为内参;或染色ICAM1、VCAM1、P-selectin抗体进行流式实验。
1.6 Transwell 实验
5 μm Transwell 小室用于淋巴细胞与内皮细胞迁移模型。MS1细胞和敲除细胞Cotl1-/-重悬至4.5×105/mL,取100 μL细胞加到Transwell 小室上层,600 μL DMEM 加到小室下层,培养至单分子细胞层;DMEM 洗2 次,然后在小室上方加入终浓度10 ng/mL的LPS 刺激过夜,小室下方换成新鲜DMEM 培养基;DMEM 洗2 次,取野生小鼠腹股沟和腋窝淋巴结,研磨、计数,按内皮细胞∶淋巴细胞为1∶8的比例进行迁移实验,即在小室上方加100 μL 5×106/mL 淋巴细胞,下方加600 μL 终浓度为10 ng/mL的趋化因子CCL19,作用24 h,收集淋巴细胞,流式染色并上机分析。
2 结果
2.1 敲除细胞Cotl1-/-的构建及鉴定结果
利用CRISPR/Cas9 敲除小鼠胰岛血管内皮细胞MS1的Cotl1基因。图1 为PCR 电泳图,挑取23个克隆均为阳性,最后一个为空白质粒。测序结果证明敲除细胞株Cotl1-/-构建成功。
2.2 淋巴细胞与血管内皮细胞黏附结果
淋巴细胞与血管内皮细胞的黏附结果见图2,在LPS 刺激下,淋巴细胞黏附MS1细胞的比例显著高于敲除细胞Cotl1-/-。在LPS 刺激下,淋巴细胞与MS1细胞的黏附显著高于敲除细胞Cotl1-/-,且随着LPS 浓度升高黏附值越高。该结果证明在炎症条件下Cotl1基因可以促进淋巴细胞与血管内皮细胞的黏附。
2.3 血管内皮细胞表面黏附分子的表达情况
分别采用RT-PCR和流式方法检测了MS1细胞和敲除细胞Cotl1-/-在LPS 刺激下黏附分子ICAM1、VCAM1、P-selectin的表达情况,结果如图3。在LPS 刺激下,ICAM1、VCAM1、P-selectin的表达量均显著升高,且MS1细胞表达的ICAM1、VCAM1、P-selectin 要显著高于敲除细胞Cotl1-/-,证明在炎症条件下血管内皮细胞MS1表面的黏附分子ICAM1、VCAM1、P-selectin 上调表达。

图1 敲除细胞系Cotl1-/-的菌落PCR 鉴定
2.4 淋巴细胞跨血管内皮细胞的迁移结果
用Transwell 方法比较了在LPS 刺激下淋巴细胞及亚群穿过MS1细胞和敲除细胞Cotl1-/-的差异,结果如图4。统计结果发现总淋巴细胞穿过MS1细胞的比例显著高于敲除细胞Cotl1-/-,说明Cotl1基因缺失严重影响了淋巴细胞的跨血管内皮细胞迁移。我们同时分析了淋巴细胞不同亚群穿过MS1细胞和敲除细胞Cotl1-/-的迁移情况,发现CD4和CD8 T细胞穿过MS1细胞的比例显著高于敲除细胞Cotl1-/-,而B细胞无显著差异,说明CD4和CD8 T细胞的跨血管内皮细胞迁移受到Cotl1基因的影响。
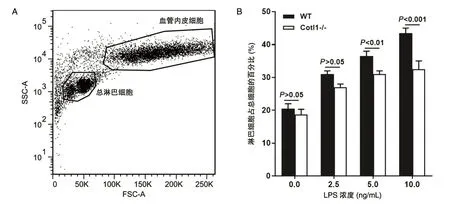
图2 淋巴细胞与血管内皮细胞黏附结果比较

图3 内皮细胞表面黏附分子的检测

图4 淋巴细胞及其亚群穿过MS1细胞和敲除细胞Cotl1-/-的百分比比较
3 讨论
淋巴细胞是机体参与正常免疫应答及炎症反应的重要功能细胞,而血管内皮细胞是调控淋巴细胞迁入和迁出的重要基质细胞,是通过表达一系列选择素配体、黏附分子和趋化因子来进行调节的。研究表明,向淋巴结迁入的T细胞高表达L-selectin,而外周淋巴结的高内皮细胞则高表达L-selectin的配体PNAd(peripheral node ad⁃dressin)。PNAd 是一系列能和L-selectin 结合的硫化、糖基化和唾液酸化的唾液黏蛋白,包括Gly⁃CAM、CD34、sgp200 等。在肠系膜淋巴结及派尔结内的高内皮细胞上,则高表达L-selectin 另一配体MadCAM-1[9]。P-selectin和E-selectin 也参与T细胞的黏附和迁移,其中E-selectin 可介导记忆性CD4+T细胞与活化的血管内皮细胞的黏附。此外,T细胞表面的CCR7与HEV 介导的趋化因子CCL19 或CCL21 接触,使LFA-1 发生外翻,随即与黏附分子ICAM-1、ICAM-2 或VCAM-1 紧密结合,T细胞 被紧 紧 吸附在HEV 上[1]。
淋巴细胞跨血管内皮细胞迁移主要取决于与高内皮细胞微静脉的相互作用。我们前期通过RNA-seq 方法筛选到一些在小鼠胰岛血管内皮细胞MS1 上高表达的基因,如Cotl1基因,但关于Cotl1 是否影响淋巴细胞的迁移目前尚无文献报道。因此,本研究探讨了炎症条件下Cotl1 调节淋巴细胞的迁移。主要研究方法是通过CRISPR/Cas9 技术在体外构建敲除细胞株Cotl1,然后通过细胞黏附和Transwell 实验来探究Cotl1基因如何调节淋巴细胞跨血管内皮细胞的分子机制。PCR及测序结果证明敲除细胞株Cotl1-/-构建成功。黏附实验证明,在LPS 刺激下淋巴细胞对MS1细胞的黏附能力显著高于敲除细胞Cotl1-/-,说明Cotl1基因能促进淋巴细胞与血管内皮细胞的黏附。那么这种黏附的分子作用机制又是如何?细胞之间的黏附主要是通过表达各种黏附分子起作用的,主要的黏附分子包括ICAM1、VCAM1、P-se⁃lectin 等,于是我们检测了MS1细胞和敲除细胞Cotl1-/-表面黏附分子的表达,结果证实,无论在RNA 还是蛋白水平,在LPS 刺激下MS1细胞表面黏附分子ICAM1、VCAM1、P-selectin表达量显著高于敲除细胞Cotl1-/-,证明黏附分子ICAM1、VCAM1、P-selectin 参与了血管内皮细胞和淋巴细胞的黏附过程。黏附是迁移的第一步,亦是关键一步,但黏附不一定发生迁移,因此,我们用Tran⁃swell 模型比较了淋巴细胞及其亚群穿过MS1细胞和敲除细胞Cotl1-/-的迁移能力,发现在LPS 刺激下淋巴细胞及其亚群(除B细胞外)穿过MS1细胞的能力略高于敲除细胞Cotl1-/-,证明Cotl1基因可能影响到淋巴细胞的跨血管内皮细胞迁移。
目前我们对于淋巴细胞跨内皮细胞迁移的认识还太少,因此,本研究不仅可以进一步加深对淋巴细胞迁移和免疫应答机制的理解,同时对淋巴细胞应答的免疫调控和临床应用也具有一定的指导意义。

