钙传感器基质交感分子1与心血管疾病的研究进展*
刘方圆, 唐 楠, 杨 政, 樊 迪, 唐其柱
(武汉大学人民医院心血管内科, 武汉大学心血管病研究所, 心血管病湖北省重点实验室, 湖北 武汉 430060)
冠心病和心力衰竭等心血管疾病的发病机制多样、病理生理过程复杂多变,虽目前从多个方面研究,但仍未能完全明确。钙离子主要位于细胞外或储存在内质网等细胞器中,是常见的第二信使,在细胞生存进程中有着十分重要的作用。近些年研究发现细胞内钙稳态失调是诱发心血管疾病的重要因素[1-2]。钙离子耗竭引起的翻译后蛋白修饰异常会导致蛋白运输错误、内质网应激、生长抑制和细胞凋亡。有关钙离子通道的研究对心血管疾病的发病机制进行了补充,为从根本上减少疾病发生、控制疾病发展提供了新的思路。人类基质交感分子(stromal interaction molecule, STIM)家族包括STIM1及STIM2 2种组成成分,广泛存在于多类人体细胞中,但在多数组织中无论在表达还是功能上STIM1均较STIM2强。STIM1参与机体多种生理和病理生理过程。近些年大量研究发现,STIM1与高血压[3]、冠心病[4]等多种心血管疾病均关系密切。本文主要针对近年来国内外对STIM1的研究结果,论述STIM1的结构和功能及其在心血管疾病发生发展中的作用及应用前景。
1 STIM1简介
STIM1是一种主要分布在内质网上的I型跨膜蛋白,在细胞膜上也有分布[5],其分子结构及其功能如图1所示,STIM1 N端向C端依次为EF手型结构(EF-hand)区、山姆结构域(sterile alpha motif,SAM)、一段跨膜区、卷曲螺旋的结构域、脯氨酸/丝氨酸富集区(proline/serine-rich,P/S)和赖氨酸富集区(lysine-rich, K)。其N端位于内质网/肌浆网(endoplasmic reticulum/sarcoplasmic reticulum,ER/SR),其中EF-hand结构域就是内质网钙浓度的感受器,包括钙离子结合EF手型结构(Ca2+binding EF-hand, cEF)和隐藏的EF手型结构(hidden EF-hand, hEF);SAM结构域用于启动STIM1的寡聚化。STIM1的C端位于细胞质,包括3个卷曲螺旋结构域1(coiled-coil domain 1, CC1)和STIM1-Orai活化区(STIM1-Orai-activating region, SOAR),用于稳定STIM1寡聚化、与Orai1相互作用和激活,以及与瞬时受体电位通道(transient receptor potential channel,TRPC)相互作用[6];赖氨酸富集区用于STIM1寡聚物移位、Orai1失活以及TRPC激活。
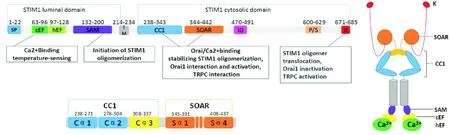
Figure 1.Schematic diagram of STIM1. TM: transmembrane region; ID: inhibitory domain, inactivation of SOC; Ca2+binding: calcium ion binding site.
图1STIM1结构示意图
Putney等[7]提出耗竭细胞内钙后会激活细胞膜上钙离子释放激活通道(Ca2+release-activated channel,CRAC),从而内流补充细胞内钙离子,即钙库操纵性钙离子内流(store-operated Ca2+entry,SOCE),其通道称为钙库操纵的钙通道(store-operated calcium channels,SOCs)。SOCs是机体内负责细胞转运钙离子的通道之一,主要由STIM、Orai及TRPC 3大家族组成。细胞内Ca2+的耗尽会刺激细胞外环境Ca2+的进入[8]。STIM1在肌质网/内质网中充当Ca2+的“传感器”,而Orai1则作为Ca2+渗透的通道,它是参与SOCs形成的主要分子[9]。
静息条件下,Ca2+结合STIM1的cEF-hand,STIM1通过卷曲螺旋结构域之间的相互作用形成二聚体。当ER/SR中的Ca2+耗尽或胞外钙离子浓度降低至阈值时,Ca2+从STIM1解离,导致SAM结构域引发构象变化,随后延伸CC1胞质结构域,导致STIM1寡聚化,接着易位到近细胞膜区域聚集形成“斑块”样结构,STIM1多聚体随后与Orail的C端相互作用,导致Orail的聚合并打开CRAC,细胞外钙离子内流增加[10],该过程的核心是STIM1多聚体形成。研究发现STIM1寡聚化之后,无论钙库耗竭与否,后续一系列步骤将继续发生[11]。激活的示意图见图2。
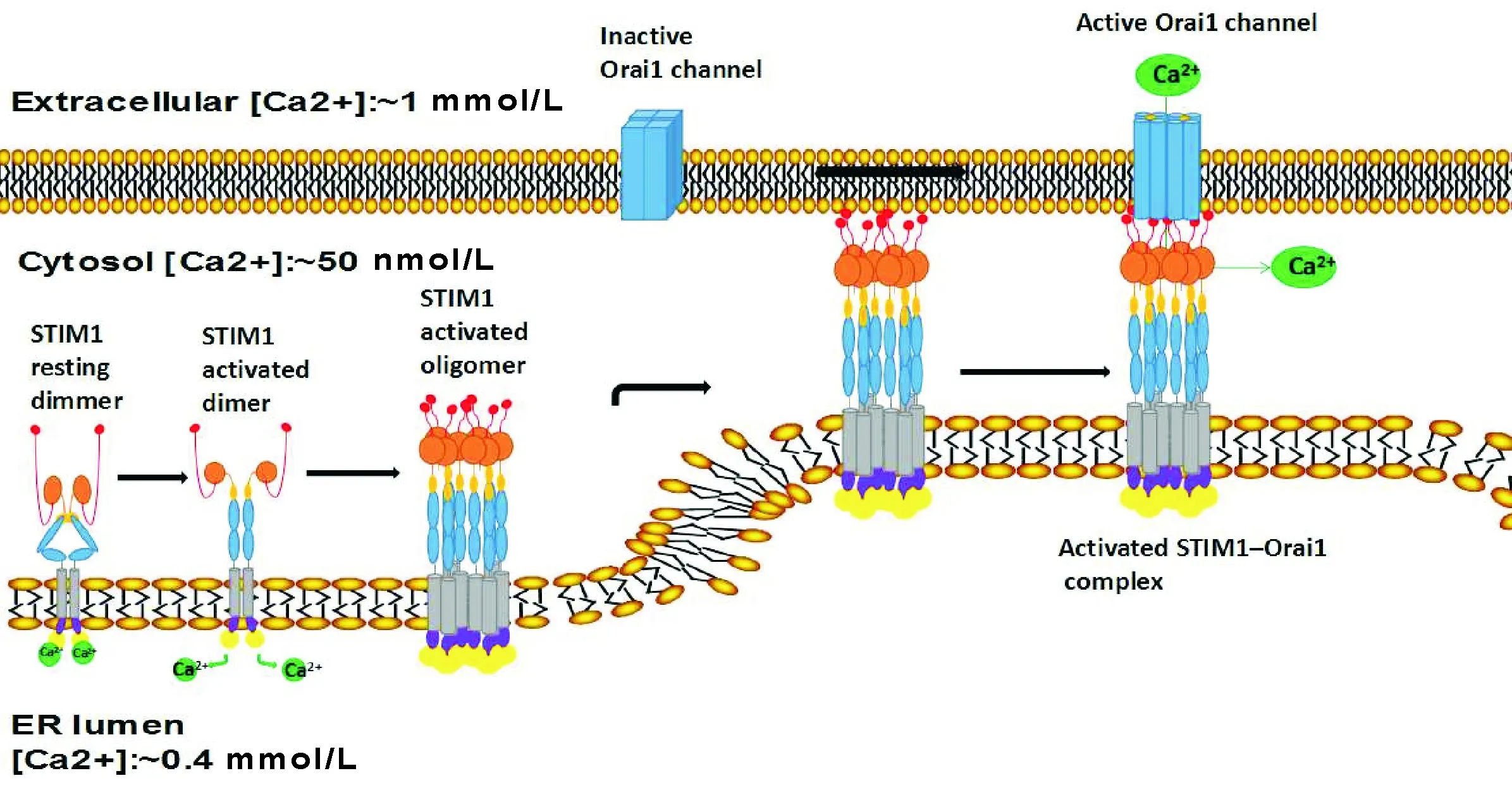
Figure 2.The diagram of STIM1 and Orai1 activation mode.
图2STIM1和Orai1激活模式图
2 STIM1在心血管系统疾病中的作用
2.1高血压 高血压是多种心血管疾病的重要病因和危险因素。钙离子在血管功能障碍中所扮演的重要角色与高血压有密切关系。病例对照研究中发现STIM1基因可能是妊娠期高血压的易感基因[12]。STIM1敲除小鼠表现出显著的血压升高,尤其是夜间血压升高[13]。Kassan等[14]研究表明,在小鼠的平滑肌细胞中特异性敲除STIM1,降低了对交感神经刺激的血管收缩反应,但对内皮依赖性松弛没有影响[15]。Kassan等[14]使用特异性靶向基因敲除平滑肌STIM1的小鼠,并用血管紧张素II(angiotensin II,Ang II)进行小鼠高血压造模,结果显示平滑肌细胞中的STIM1缺失会减少Ang II高血压介导的心脏肥大和纤维化,收缩压降低,内质网应激标志物C/EBP同源蛋白(C/EBP homologous protein,CHOP)也减少;Ang II诱导高血压CHOP基因敲除小鼠的心脏中STIM1表达增加,表明STIM1是内质网应激标志物的上游。这些研究提示,平滑肌中缺乏STIM1可能通过消除内质网应激来预防高血压以及高血压诱导的心肌肥厚和血管功能障碍。STIM1上调可能导致内质网应激,并直接或间接地决定高血压条件下心肌重构的发展。一氧化氮(nitric oxide,NO)是一种由内皮细胞产生并释放的血管内皮舒张因子。沉默STIM1基因的表达后,内皮细胞释放的NO明显减少[13, 16]。STIM1可通过调节血压参与心血管疾病的发病机制。
2.2血栓形成 内皮细胞功能紊乱与各种心血管疾病的发生与发展密切相关。有研究表明,STIM1高表达于不同血管来源的内皮细胞中,并且STIM1对于人脐静脉内皮细胞的增殖具有调控作用[17]。Shi等[18]发现敲除STIM1基因可明显抑制肝细胞生长因子(hepatocyte growth factor,HGF)诱导的骨髓来源的内皮祖细胞(endothelial progenitor cells,EPCs)增殖,提示Orai1和(或)STIM1是血管新生过程中的靶蛋白。血小板的激活和聚集是动脉血栓形成的关键一环。多项研究表明,血小板活化和连续血栓的形成依赖于Orai1/STIM1的表达和活化,STIM1和Orai1所构成的SOCs可调节血小板的钙离子内流来影响血小板的聚集[19-21]。STIM1也可能通过其胞质多元域与质膜上的磷酸肌醇相互作用[22],从而抑制血栓形成。
2.3血管平滑肌细胞(vascular smooth muscle cell,VSMC)功能障碍 血管平滑肌细胞的活化、迁移、增殖与凋亡是动脉粥样硬化斑块形成的重要机制之一,而动脉粥样硬化是冠心病的始动因素。血管平滑肌细胞STIM1缺乏促进动脉粥样硬化血管钙化[23]。在增生的VSMC中,STIM1表达上调,Stim1或Orai1基因沉默可以抑制CRAC电流,同时抑制血管平滑肌细胞的增殖和迁移[18]。Aubart等[24]沉默STIM1基因的表达后,VSMC的增殖和迁移被抑制,该过程在人源性STIM1再表达后被逆转。在大鼠颈动脉球囊损伤模型中的实验也得出了相同的结论[25]。Abdullaev等[17]发现STIM1表达介导SOCE参与人脐静脉内皮细胞增殖,敲除STIM1基因可使内皮细胞的增殖停滞在S期或G2/M期,从而抑制内皮细胞增殖。Ang II诱导的早期生长反应蛋白1表达由VSMC中的STIM1和Ca2+释放介导[26]。由此推测STIM1在VSMC的增殖和迁移中起着重要作用。
2.4炎症反应 炎症反应是贯穿心血管疾病各个环节的重要病理变化, 粥样斑块的形成、斑块稳定性的降低及破裂、血栓的形成均与炎症反应的过度激活有关。EPCs归巢在血管炎性损伤修复过程中起着重要作用。冠心病、高血压和糖尿病患者均存在EPCs的数量降低和功能减退。EPCs能归巢至损伤血管局部,加快损伤血管再内皮化,抑制病理性新生内膜的形成。在心血管疾病的进展过程中,STIM1参与内皮祖细胞生物学功能的调控。最新研究显示氧化低密度脂蛋白通过促进SOCE激活EPCs的自噬[27],推测STIM1可能通过EPCs在血管损伤修复过程中发挥重要的作用。上述STIM1在一定程度上可以反映血管内皮损伤的程度,推测STIM1水平与冠心病血管病变程度具有相关性,且与病变血管呈正相关。研究发现CC趋化因子配体2、干扰素γ、白细胞介素6与肿瘤坏死因子α等炎症因子在平滑肌STIM1基因敲除小鼠的缺血再灌注损伤中降低,这显示平滑肌细胞的STIM1基因敲除通过减少炎症反应来保护心脏不受心肌梗死的影响[28]。多个研究小组研究表明高水平的STIM1导致血小板活性增强[29-31],这可能也是STIM1参与急性冠脉综合征发病的机制之一。
2.5内皮功能和血管生成 血管内皮细胞担任着维持血管张力、分泌、内皮细胞的增殖、迁移、修复损伤血管、调节血压、凝血与抗凝平衡及血管新生等多种作用。内皮细胞障碍涉及各种心血管疾病的发生与发展。来源于不同血管床的内皮细胞上均有STIM1的表达[17]。敲减内皮细胞上STIM1的表达后,SOCE明显受到抑制,镜下观察细胞停滞在S期和G2/M期,内皮细胞的增殖和迁移被抑制[17]。VEGF是促血管新生作用最强的细胞因子,对内皮细胞的增殖以及血管结构的形成具有促进作用[32]。在肿瘤中的研究发现STIM1可调控宫颈癌细胞中VEGF的产生;在动物模型中干扰STIM1表达可抑制肿瘤血管生成[33]。微小RNA-185(microRNA-185,miR-185)参与人微血管内皮细胞的血管生成,STIM1基因沉默可以模拟miR-185介导的血管生成抑制。STIM1过表达消除了miR-185的抗血管生成作用[34]。临床研究发现血清低STIM1的支架再狭窄患者血清中VEGF水平明显高于正常STIM1组再狭窄患者[35]。以上研究表明STIM1对血管生成的负性调节参与心血管疾病的发生发展。
2.6心肌肥厚 心肌肥厚与自主神经失衡有关,由多种细胞因子和/或信号通路的失调引起的,包括G蛋白偶联受体和胞质Ca2+信号等。Ohba等[36]在对人工培养的大鼠心肌细胞的研究过程中发现STIM1与心肌肥厚相关,他们发现在人工培养的大鼠心肌细胞中,STIM1持续表达。研究显示使用硝苯地平抑制电压依赖性钙通道(voltage-dependent calcium channel,VDCC)通道后,心肌肥大并没有得到改善,而采用SOCs阻断剂SKF-96365或敲除SOCs基因后,心肌肥厚能得到明显改善[37],提示SOCs引起的Ca2+内流在心肌肥厚过程中扮演了重要的角色。STIM1是SOCs的感受器,通过促使胞膜钙离子内流,胞内钙离子浓度降低,进而导致心力衰竭时的心肌收缩力减弱。Dai等[38]研究证明抑制STIM1-Orai1可减轻小鼠压力负荷诱导的心肌肥厚。Voel-kers等[39]研究发现SOCE中的Orai1和STIM1对体外培养的新生大鼠心肌细胞具有调节正常生长和肥大生长的关键作用。另一项研究证明沉默STIM1可阻止mTORC-2磷酸化Akt激酶,从而阻止GSK-3β活性的抑制,最终导致抑制肥厚反应[40]。
2.7心肌纤维化 过度的心肌纤维化是心力衰竭(heart failure,HF)机械和电学功能障碍的主要诱因。STIM1在Ang II诱导的心肌纤维发生中起关键作用[41]。在大鼠心脏成纤维细胞中,Ang II导致STIM1与Orai1和Ca2+从细胞内钙储存中释放相互作用。由Ang II诱导的纤连蛋白(fibronectin,FN)、结缔组织生长因子(connective tissue growth factor,CTGF)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的上调被SOCE抑制剂SKF-96365减弱,通过敲除STIM1观察到类似的结果,这一发现表明敲除STIM1可减轻心肌纤维化。在Ross等[42]的实验中,荧光双标共聚焦图像显示,与正常对照组相比,心力衰竭组Orai1和STIM1共定位的Pearson相关系数显著升高。他们的研究证实来自衰竭心室的成纤维细胞与来自非衰竭心脏的成纤维细胞相比,胶原分泌能力增加,这与CRAC的成孔亚基Orai1表达增强相关的SOCE上调有关。Correll等[43]在转基因小鼠的研究中,发现STIM1的过度表达增加了细胞内储存消耗后的钙内流以及舒张期钙离子水平,并且增加了对猝死和心力衰竭与肥大的敏感性。STIM1在心肌纤维化中的作用可能影响心血管疾病的预后。
3 以STIM1为靶点的治疗策略
STIM1通过激活SOCE以调控胞内Ca2+水平的降低,从而在细胞生存和凋亡中起重要作用。STIM1在高血压、冠心病等心血管疾病的发生发展过程中均有其特殊的作用。上述研究者沉默STIM1表达后,VSMC增殖和新生内膜形成减少,这为STIM1作为治疗动脉粥样硬化的重要靶点提供依据。
目前,Zheng等[44]研究证实天麻素通过对Orai1和STIM1表达的作用缓解心肌肥厚。Lu等[45]的研究证实吡斯的明通过抑制CaN/NFAT3/GATA4通路和抑制Orai1/STIM1,改善胆碱能传递效率(乙酰胆碱酯酶降低和乙酰胆碱降低),减轻了心脏肥大和改善心脏功能。STIM1表达和分泌增多时,内皮祖细胞的归巢功能以及增殖、迁移过程均受到抑制,进而影响支架植入术后再内皮化过程对局部血管损伤的修复[46]。STIM1可为抗心肌肥厚治疗提供了有效的作用靶点。
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗冠心病的有效方法,能够扩张狭窄的冠脉并恢复缺血心肌的血流灌注[47]。PCI术后支架内再狭窄的发生会影响治疗效果,早期预测支架内再狭窄的发生风险并进行干预,能够有效改善PCI术后的病情转归。Li等[48]的研究表明血浆STIM1水平升高是接受PCI患者支架再狭窄的独立危险因素,可为PCI后再狭窄的控制提供有用的信息。PCI术后血清STIM1含量升高与支架内再狭窄的发生密切相关,对再狭窄的发生具有预测价值。
STIM1含量的升高与血管新生及再内皮化障碍密切相关。在小鼠中敲除STIM1或Orai1可预防血栓的形成,并且在若干血栓模型中限制了血栓栓塞的程度,保持血管内通畅,可预防动脉粥样硬化、病理性血栓及栓塞[30]。有研究发现,STIM1敲除可显著抑制颈动脉血管的内膜增生[29],证明在大鼠的颈动脉平滑肌细胞中Ca2+内流可能对血管内膜新生及血管狭窄发挥了重要作用。而在1型糖尿病小鼠模型中发现,STIM1表达降低,而过表达STIM1可修复糖尿病小鼠冠脉内皮功能[49]。STIM1会成为将来抗血小板药物治疗血栓形成以及血管损伤再狭窄的一个新的治疗靶点。
4 小结及展望
STIM1作为内质网上的Ca2+传感器,调节心血管系统中Ca2+的稳态,通过Ca2+信号传导机制在心脏和血管相关疾病的发生、发展、恶化及并发症的发生过程中发挥重要作用。使用SOCE抑制剂及干扰STIM1表达的新型药物,可下调钙离子信号蛋白的表达,从而抑制血管平滑肌细胞增殖和迁移,并通过发挥调脂、抗炎、改善内皮功能等多种效应,对心血管疾病发生发展过程中的多因素多环节起到调节作用,进而起到延缓甚或逆转病理改变的作用。相信未来STIM1将作为多种心血管疾病研究甚至治疗的新靶点。对STIM1调控钙通道的进一步研究,将进一步揭示介导钙离子活动通路的各种机制,从而为预防和治疗心血管疾病提供新思路。

