Twist通过ERK通路对体外鼻咽癌细胞血管生成的影响*
孙旭鸯, 陈 湧
(1浙江省丽水市中心医院耳鼻喉科, 浙江 丽水 323000; 2岳阳市二人民医院胃肠外科, 湖南 岳阳 414000)
鼻咽癌作为一种好发于鼻咽部咽隐窝和顶前壁黏膜上皮的恶性肿瘤,其病因和遗传易感性、EB病毒及环境污染等因素密切相关。早期鼻咽癌缺乏典型临床症状,同时鼻咽癌的血供极为丰富,早期就可能发生颈部淋巴结转移或远处转移,从而导致鼻咽癌患者的预后较差。目前尚未鉴定出与鼻咽癌特异性较高的癌基因和抑癌基因,导致鼻咽癌发病机制仍不明确[1-2]。因此,寻找鼻咽癌特异性分子标志并从基因水平上抑制促癌基因的表达或者上调抑癌基因的表达,可能对鼻咽癌的发生发展起抑制作用。
Twist转录因子作为主要由胎盘和中胚层组织分泌的细胞因子,在胎儿时期呈高表达,出生后在正常组织中表达含量极低,其不仅在胚胎发育成熟过程中扮演着重要角色,同时在诱导细胞迁移和组织塑性过程中发挥重要作用[3-4]。在研究Twist与恶性肿瘤的关系中发现,Twist在鼻咽癌、食管癌、骨肉瘤、前列腺癌和结肠癌等恶性肿瘤组织中的表达较正常组织均明显升高[5-7];进一步分析Twist与恶性肿瘤生物学行为的关系中发现,Twist可通过调控细胞黏附因子、促血管生成因子和金属基质蛋白酶等肿瘤相关因子的表达从而促进肿瘤细胞迁移、侵袭和脉管生成等过程,利于肿瘤发展和转移。通过聚类分析和芯片杂交等技术研究胚胎干细胞发育与血管分化的关系中发现,Twist可能参与了血管内皮生长因子(vascular endothelial growth factor,VEGF)、ANG1、PDGF等基因的调控,从而在血管生成(angiogenesis)过程中发挥了重要调控作用[8]。既往研究已经表明Twist参与多种恶性肿瘤的恶性生物学行为,目前尚未有Twist与鼻咽癌细胞血管生成的研究见诸报道,为此,本研究通过RNA干扰技术特异性沉默Twist在鼻咽癌细胞中的表达,探讨Twist对体外鼻咽癌细胞血管生成的影响及其可能作用机制,为鼻咽癌血管靶向治疗提供新的临床参考。
材 料 和 方 法
1 试剂和材料
DMEM高糖培养基、无血清Opti-MEMI培养基、胎牛血清和胰蛋白酶-EDTA消化液均购自Gibco;空载体pEGFP和Twist沉默载体pEGFP-siTwist购自北京合生基因科技有限公司;Lipofectamine 2000和TRIzol试剂购自Thermo;BCA蛋白浓度测定试剂盒购于中杉金桥生物技术有限公司;cDNA第一链合成试剂盒和RT Master Mix荧光定量PCR试剂盒购自TaKaRa;Twist和GAPDH的上、下游引物由上海英潍捷基公司合成;CCK-8试剂盒购自上海碧云天生物技术有限公司;Transwell小室购自Corning;Matrigel基质胶购自BD;抗Twist和β-actin抗体购自Abcam;抗p-JNK、JNK、ERK、p-ERK、p38、p-p38和VEGF抗体购自Epitomics;JNK通路抑制剂SP600125、ERK通路抑制剂PD98059和p38通路抑制剂SB203580购自Sigma。
2 细胞培养
人鼻咽癌细胞株CNE2和人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)均购自中国科学院上海生命科学研究院细胞资源中心,细胞均使用含20%灭活胎牛血清的DMEM高糖培养基进行培养和传代。细胞置于细胞培养箱中进行孵育,细胞培养箱调整温度为37 ℃,二氧化碳浓度为5%,将细胞悬液接种于60 mL斜颈细胞培养瓶中,内盛10 mL完全培养基,内皮细胞生长方式为单层贴壁生长,细胞在细胞培养箱内生长3 d后即可生长至80%~90%瓶底面积,然后使用含EDTA胰酶进行消化,取对数生长期细胞用于实验操作。
3 实验方法
3.1细胞转染 收集对数生长期的CNE2细胞,用完全培养基制成单细胞悬液,调整浓度为5×109/L,将细胞悬液接种至6孔板中,每孔100 μL,每组设3个复孔,将细胞分为TwistsiRNA+Lipofectamine 2000组(siTwist组)、阴性对照(negative control, NC)+Lipofectamine 2000组(NC组)和空白对照(blank control, BC)组,按照转染试剂Lipofectamine 2000说明书进行操作。
3.2Western blot法检测蛋白表达 CNE2细胞提取蛋白后经按BCA蛋白浓度测定试剂盒说明书提取总蛋白,每份样品使用20 μg蛋白质,使用10% SDS-PAGE后转移至硝酸纤维素膜上,在4 ℃下使用5%脱脂奶粉封闭过夜,硝酸纤维素膜经I抗和II抗反应后滴加新鲜配置的ECL化学发光液显色、曝光和显影。
3.3Real-time PCR检测Twist mRNA的表达 CNE2细胞经TRIzol作用后提取细胞总 RNA,利用紫外分光光度仪检测稀释好的RNA标本的吸光度(A)值,设定波长为260 nm和280 nm,计算A260/A280比值为1.8~2.1之间。按照逆转录反应试剂盒说明书实施逆转录合成cDNA,按real-time PCR说明书配制反应体系,反应条件为: 50 ℃ 2 min; 95 ℃ 2 min; 95 ℃ 20 s、58 ℃ 30 s、72 ℃ 20 s、80 ℃ 15 s,读板后重复44个循环。以GAPDH为内参照。Twist上游引物为5’-GGAGTCCGCAGTCTTACGAG-3’,下游引物为 5’-TCTGGAGGACCTGGTAGAGG-3’;GAPDH上游引物为5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物为5’-GAAGATGGTGATGGGATTTC-3’。依照标准曲线中绘制的各个样本的拷贝数,以测定的Twist表达量与GAPDH表达量的比值作为基准来校准表达量,实验重复3次,取平均值。
3.4收集鼻咽癌细胞条件培养基(conditioned medium, CM) 将CNE2细胞接种于75 cm2培养瓶中,加入适量完全培养基,待细胞生长至80%底面积时用移液器吸去原培养基,用PBS缓冲液反复冲洗4次,再加入不含血清的DMEM培养基20 mL,放置细胞培养箱孵育12 h后收集上清液,以2 500 rpm速度下常温离心5 min,将上清液用0.22 μm过滤器过滤后,保存于4 ℃冰箱中。
3.5HUVECs与CM共培养 将HUVECs接种于6孔培养瓶中,加入含20% FBS的DMEM培养基,待细胞生长至80%底面积时用移液器吸去原培养基,用PBS缓冲液反复冲洗2次,加入CM培养24 h。
3.6CCK-8法检测细胞活力 将HUVECs接种于25 cm2培养瓶中,加入适量完全培养基,待细胞生长至80%底面积时用胰酶消化并收集对数生长期细胞,用含20% FBS的DMEM培养基制成单细胞悬液,并调整浓度为5×107/L,将细胞悬液接种至96孔板中,每孔100 μL,每组设5个复孔,将96孔板置于细胞培养箱中培养72 h,在结束前1 h将10 μL的CCK-8溶液加入96孔板中,放入细胞培养箱继续培养1 h后立即用酶标仪检测各孔A值,设定波长为490 nm,同时设空白调零组(不加细胞仅加等量培养基)。
3.7Transwell小室侵袭实验 将Matrigel均匀铺被到Transwell上室底部,待Matrigel完全凝固后,小心取出上室中残余液体,再加入50 μL无血清DMEM培养基。调整HUVECs浓度1×108/L,将200 μL细胞悬液加入Transwell上室中,同时在Transwell下室中添加500 μL含20%胎牛血清的细胞培养基,然后将Transwell小室放置于细胞培养箱中继续孵育24 h,实验重复3次,每组设5个复孔。将放置培养箱中孵育24 h的Transwell小室取出,去除上室及下室中的培养基,用棉棒小心擦去小室底膜上的细胞,将Transwell上室放置在10%甲醇溶液中固定20 min,用PBS液清洗3遍后再用结晶紫溶液染色15 min。将Transwell上室自结晶紫溶液中取出后,使用PBS溶液清洗3遍,将Transwell上室置于载物片上,放置于倒置显微镜下观察并拍照,在高倍镜下随机选择10个视野拍照并采集图像。
3.8小管形成实验 将不含胎牛血清的培养基和Matrigel放置4℃冰箱过夜预冷,待其变成胶冻状,以1∶2的比例混合培养基和Matrigel,将250 μL稀释后的Matrigel加入24孔板中,再放入细胞培养箱中孵育1 h,至Matrigel凝固。调整HUVECs浓度为2×105/L,将0.1 mL细胞悬液接种于预先铺好基质胶的24孔板中,再放置细胞培养箱中孵育过夜,最后在倒置显微镜下观察小管形成状况,利用ImageJ 1.51f软件对管腔样结构的数量进行定量分析[9]。
3.9JNK、ERK和p38信号通路抑制剂对HUVECs小管形成的影响 实验设置NC组、siTwist组、siTwist+SP600125组、siTwist+PD98059组和siTwist+SB203580组,NC组和siTwist组CNE2细胞添加PBS作用2 h,后3组分别用10 μmol/L的JNK通路抑制剂SP600125、ERK通路抑制剂PD98059和p38通路抑制剂SB203580作用CNE2细胞2 h,提取各组细胞CM,按照3.8方法检测HUVECs小管形成,实验重复3次,取平均值。
4 统计学处理
采用SPSS 16.0统计分析软件进行统计学分析,所有本次实验所得的计量数据均以均数±标准差(mean±SD)表示,率的比较用卡方检验,采用SNK-q法分析总体及总体中两样本均数之间差异,以P<0.05为差异有统计学意义。
结 果
1 Real-time PCR和Western blot检测Twist siRNA的干扰效率
将空载体和Twist沉默载体转染鼻咽癌CNE2细胞48 h后,提取各组CNE2细胞总RNA进行real-time PCR以检测Twist mRNA的相对表达量,NC组和BC组CNE2细胞中Twist mRNA相对表达量为0.84±0.07和0.87±0.08,与siTwist组(0.17±0.02)相比较显著升高(P<0.01),而NC组和BC组之间相比较无统计学差异。Western blot检测Twist蛋白在siTwist组CNE2细胞中的相对表达量为2.32±0.16,与仅转染空载体的CNE2细胞(6.51±0.52)和BC组细胞(6.94±0.65)相比较显著降低(P<0.01),NC组和BC组之间相比较无统计学差异,见图1。
2 沉默Twist基因对HUVECs体外活力的影响
为评估干扰Twist在鼻咽癌细胞中的表达后对体外HUVECs活力的影响,分别提取NC组、BC组和siTwist组CNE2细胞CM,通过CCK-8法对HUVECs活力进行检测,结果表明,HUVECs经siTwist组CNE2细胞所提取的CM作用24 h后,A值为0.53±0.13,而HUVECs经NC组和BC组CNE2细胞所提取的CM作用24 h后A值分别为1.49±0.35和1.37±0.24,siTwist组与NC组和BC组相比较显著降低(P<0.01),表明沉默Twist在鼻咽癌细胞中的表达可显著抑制HUVECs活力。
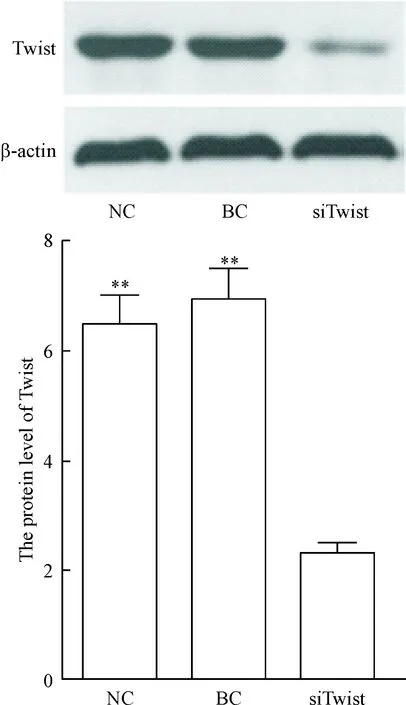
Figure 1.Knockdown ofTwistwas analyzed by Western blot assay. Mean±SD.n=3.**P<0.01vssiTwist group.
图1Westernblot检测Twist蛋白在CNE2细胞中的表达水平
3 干扰Twist基因的鼻咽癌细胞CM对体外HUVECs侵袭能力的影响
在体外CNE2细胞中分别转染siTwist和空载体后,提取各组细胞CM,HUVECs经CM作用24 h后进行Transwell小室侵袭实验。细胞侵袭实验结果表明,HUVECs经siTwist组CNE2细胞所提取的CM作用24 h后侵袭出Matrigel的细胞数较NC组和BC组显著降低(P<0.01),见图2。
4 干扰Twist基因的鼻咽癌细胞CM对体外HUVECs小管形成的影响
利用小管形成实验检验干扰Twist基因的鼻咽癌细胞CM对体外HUVECs的体外血管生成能力,结果显示,HUVECs在体外Matrigel基质环境中生长12 h后,细胞逐渐向两端延长呈梭形,同时细胞延长端开始在Matrigel胶中伸展,相邻细胞开始出现联接并出现管腔样结构。HUVECs经siTwist组CNE2细胞所提取的CM作用24 h后体外小管形成数较NC组和BC组显著降低(P<0.01),见图3。
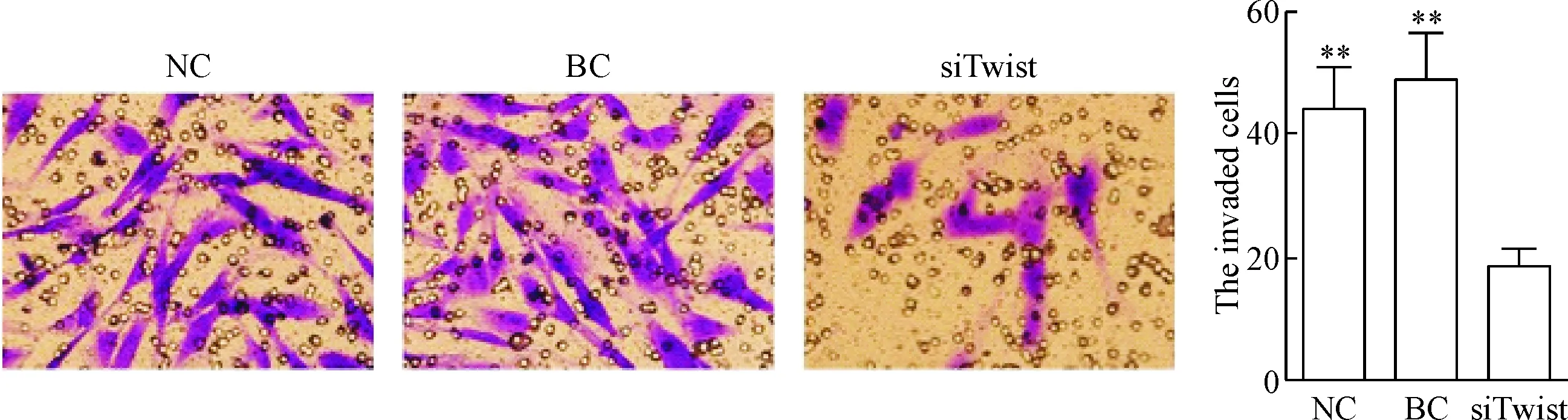
Figure 2.The effect ofTwistsilencing on the invasive ability of HUVECsinvitro(×200). Mean±SD.n=3.**P<0.01vssiTwist group.
图2Transwell小室实验检测沉默Twist对HUVECs侵袭能力的影响

Figure 3.The effect ofTwistsilencing on the tube formation of HUVECsinvitro(×200). Mean±SD.n=3.**P<0.01vssiTwist group.
图3小管形成实验观察沉默Twist对HUVECs小管形成的影响
5 Twist对CNE2细胞中p-ERK、p-p38、p-JNK和VEGF表达的影响
分别转染空载体和siTwist至CNE2细胞后,通过Western blot检测p-ERK、p-p38、p-JNK和VEGF在鼻咽癌CNE2细胞中的表达,结果显示,siTwist组CNE2细胞的ERK磷酸化水平明显高于NC组和BC组,而VEGF蛋白水平明显低于NC组和BC组(P<0.01);下调Twist在CNE2细胞中的表达对p-p38和p-JNK的表达无明显影响,见图4。
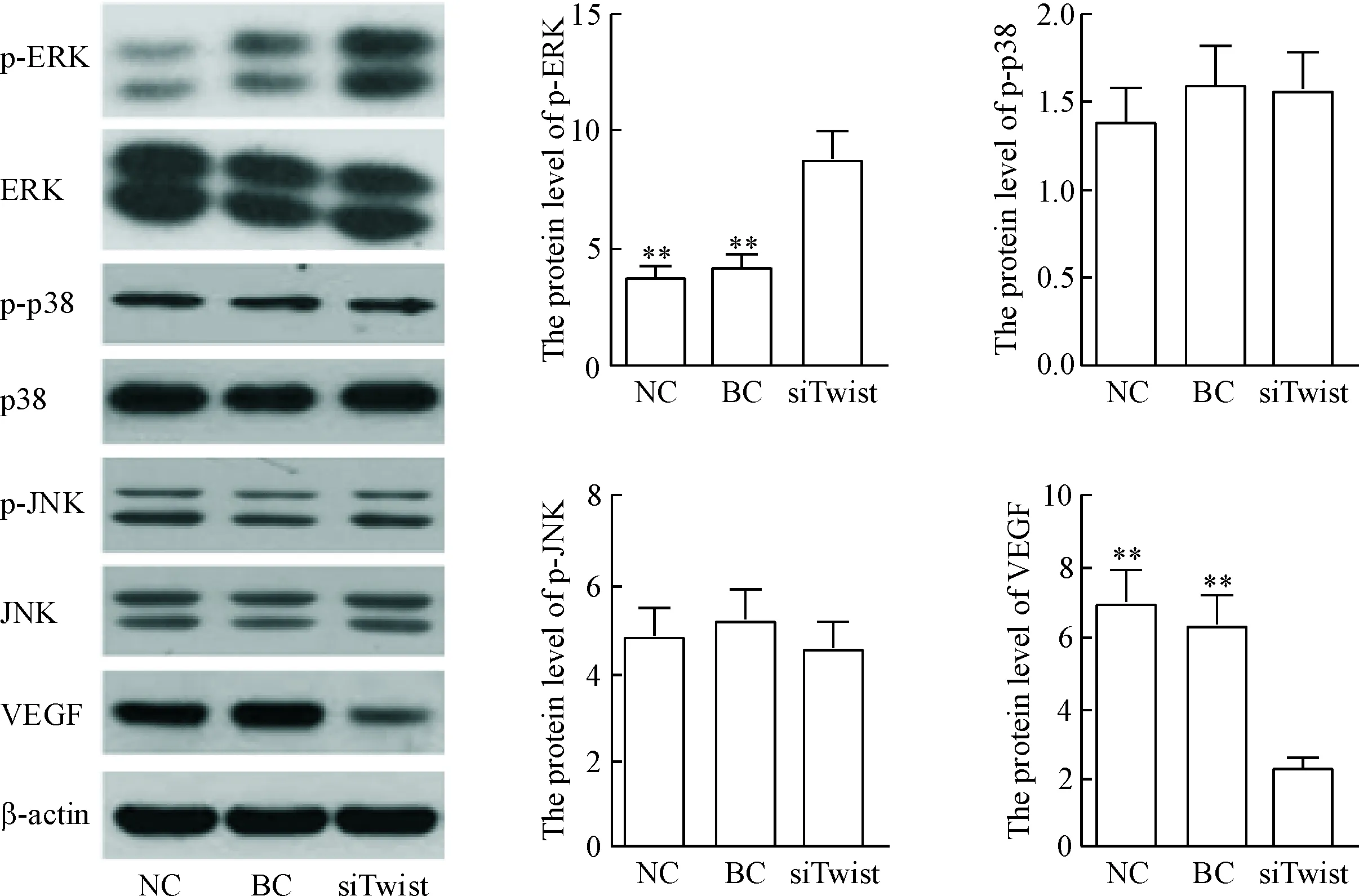
Figure 4.The protein levels of p-ERK, p-p38, p-JNK and VEGF were assessed by Western blot analysis in the CNE2 cells after transfected with negative control (NC), blank control (BC) and siTwist. Mean±SD.n=3.**P<0.01vssiTwist group.
图4Westernblot检测转染siTwist对CNE2细胞中p-ERK、p-p38、p-JNK和VEGF表达的影响
6 ERK、JNK和p38信号通路抑制剂对HUVECs体外小管形成的影响
NC组、siTwist组、siTwist+PD98059组、siTwist+SP600125组和siTwist+SB203580组CNE2细胞所提取CM作用HUVECs后,HUVECs体外小管形成数分别为48.3±4.2、22.7±3.6、39.1±4.7、25.6±3.3和27.5±2.8。与NC组相比,siTwist组HUVECs体外小管形成数显著减少(P<0.01);与siTwist组相比,siTwist+PD98059组显著升高(P<0.05);而siTwist组与siTwist+SP600125组或siTwist+SB203580组相比较,差异无统计学意义,见图5。
讨 论
Twist作为定位于人类7号染色体的基因,编码由202个氨基酸组成的Twist蛋白。Twist蛋白属于碱性螺旋-环-螺旋结构家族成员,首先在果蝇中被发现,这种蛋白在果蝇中胚层的发育和诱导细胞迁移运动中发挥了重要作用。进一步研究发现Twist在多种实体瘤中表达上调,Twist可通过诱导上皮细胞向间质细胞发生转换,从而在细胞凋亡、转移和血管新生中起到重要调控作用。目前关于Twist在实体瘤中的表达以及与肿瘤转移的相关研究已有较多见诸报道,但Twist与肿瘤血管新生的相关性研究较少,尤其是在鼻咽癌中[6-8]。
血管内皮细胞作为血管内侧的一层扁平上皮细胞,在机体各脏器中分布广泛,血管内皮细胞作为组织和血液间的第一道屏障,在细胞炎症信号、切应力和激素水平等信号的作用下,可分泌多种血管活性物质,从而调节血液稳态、新生血管形成和组织再生等作用。血管内皮细胞已成为在机体多种病理生理过程中起关键调控作用的重要器官。肿瘤组织中的血管内皮细胞在组织形态、增生方式和免疫学特征等方面和正常组织血管内皮细胞存在较大差异,肿瘤组织内血管内皮细胞增生为顺应肿瘤生长的需要,在肿瘤细胞分泌的多种促血管生长因子的作用下,肿瘤血管内皮细胞的活力、侵袭能力以及新生血管能力均得到不同程度增强,以适应肿瘤发展和转移的需要。为此,根据肿瘤内皮细胞的特点,靶向肿瘤血管内皮细胞治疗应运而生,有效抑制包括鼻咽癌在内的肿瘤新生血管形成,可有效抑制恶性肿瘤的发展和转移,从而改善恶性肿瘤患者预后[10-11]。在本研究中,将Twist沉默载体转染至体外CNE2细胞,并通过RT-PCR和Western blot检测证实Twist沉默载体可显著下调Twist mRNA和蛋白在鼻咽癌细胞中的表达,并获取干扰Twist基因后鼻咽癌细胞特定培养基,并用该特定培养基作用体外HUVECs,对血管内皮细胞活力、侵袭能力和血管新生能力进行了进一步研究。首先,我们利用CCK-8实验分析干扰Twist在鼻咽癌细胞中的表达后对体外HUVECs活力的影响,结果表明,沉默CNE2细胞中Twist的表达后可有效抑制体外HUVECs活力,从而表明Twist在HUVECs体外生长中发挥了一定作用。Transwell小室实验结果表明,沉默Twist的表达后可有效抑制体外HUVECs侵袭行为。另外通过小管形成实验模拟HUVECs体外血管形成,在体外Matrigel基质环境中生长12 h后,细胞逐渐向两端延长呈梭形,同时细胞延长端开始在Matrigel中伸展,相邻细胞开始出现联接并出现管腔样结构,低表达Twist基因的CNE2细胞上清液可明显抑制体外HUVECs体外小管形成,从而表明Twist在鼻咽癌细胞中的表达水平在体外鼻咽癌细胞促进血管新生行为中也发挥了一定作用,提示Twist可能在鼻咽癌体外血管新生的发展过程中发挥促进功能,应该被视为鼻咽癌潜在的一个新的靶向作用位点。
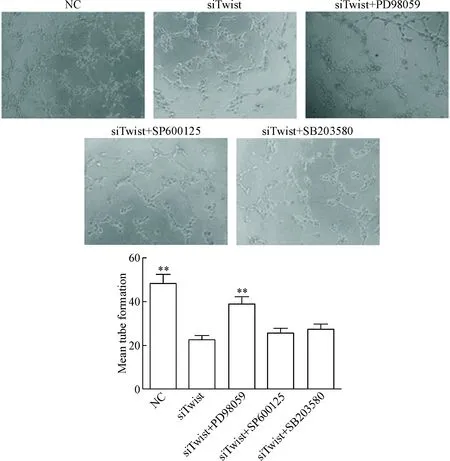
Figure 5.Analysis of the tube formation of HUVECs treated with CM from CNE2 cells in siTwist, siTwist+PD98059, siTwist+SP600125 and siTwist+SB203580 groups (×200). Mean±SD.n=3.**P<0.01vssiTwist group.
图5小管形成实验观察ERK、p38和JNK信号通路抑制剂对HUVECs体外小管形成的影响
ERK作为一种脯氨酸导向的丝氨酸/苏氨酸激酶,主要位于细胞浆中,在诸如生长因子、激素、细胞因子、高糖和缺氧等刺激后作用下被激活,激活后ERK可进入细胞核中,进一步激活NF-κB及P70核蛋白体S6激酶,使得相邻脯氨酸的丝氨酸/苏氨酸发生磷酸化。磷酸化ERK在介导信号从细胞膜表面受体传导至细胞核过程中发挥关键调控作用,p-ERK可激活STATs、c-Myc、Jun、ELK-1、ATF2和Max等转录因子,进而对这些转录因子各自靶基因的转录和翻译过程产生影响,最终对内皮细胞的迁移、分化和増殖等多种生理学功能发挥调控作用[12-14]。SP600125作为ERK信号转导的特异性抑制剂,可通过阻断Raf 对ERK的磷酸化从而进一步阻断下游信号通路。血管内皮细胞生长因子作为一种在可由正常细胞和肿瘤细胞合成分泌的细胞因子,VEGF在正常组织细胞中呈低水平表达,且表达水平较为恒定,但其在许多肿瘤细胞中表达上调,是促进肿瘤细胞新生的最重要调节因子。有研究表明,VEGF在恶性肿瘤细胞中的异常表达与肿瘤肝转移存在正相关性,同时与恶性肿瘤患者的预后呈明显负相关。VEGF在肿瘤细胞中的表达与ERK磷酸化水平关系密切,重组人肝细胞生长因子可通过ERK信号通路上调肿瘤细胞中VEGF的表达,从而促进肿瘤组织中血管生长[15]。在本研究中,下调Twist在鼻咽癌细胞中的表达可促进CNE2细胞中ERK的磷酸化水平,同时下调VEGF的表达,但对JNK和p38的表达无明显影响,而进一步使用ERK信号通路特异性抑制剂作用后发现,SP600125可部分阻断沉默Twsit对体外HUVECs小管形成的抑制作用,使用JNK和p38通路抑制剂却没有观察到这种抑制作用,从而表明Twist可能调控鼻咽癌细胞中ERK信号通路,影响VEGF的表达从而在体外血管新生过程中发挥了一定作用。
综上所述,Twist可通过抑制ERK信号通路的激活而调控鼻咽癌细胞对体外内皮细胞活力、侵袭和小管形成的作用,表明Twist可能在鼻咽癌血管新生中扮演了重要角色。Twist有望成为治疗鼻咽癌新的作用靶点,后续会在体内进行进一步的验证及探讨。

