CUDC-907诱导胶质瘤细胞DNA损伤与自噬的实验研究*
焦 鹏, 黄振州, 张晓静, 龙妍君, 李召君, 3, 王凤泽△
(泰山医学院 1生命科学研究中心,2生命科学学院, 3药学院, 山东 泰安 271016)
脑瘤是一种严重威胁人类生存与健康的疾病。近几年,我国每年新增脑部肿瘤病例约10万,其中死亡人数约6.1万[1]。在原发性脑肿瘤中,神经胶质瘤约占50%,是最常见的原发性恶性肿瘤之一。目前,手术治疗及术后辅以放疗或化疗仍然是胶质瘤主要的临床治疗手段[2-3]。脑肿瘤侵袭性很高,大多呈浸润性,肿瘤组织边界模糊,手术很难做到完全切除,复发率依然居高不下[4]。另外,放疗的副作用较大,患者生活质量差。因此,寻求毒副反应小且经济安全的新型药物成为现阶段胶质瘤治疗的新趋势。
CUDC-907是一种新型组蛋白去乙酰化酶(histone deacetylase,HDAC)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)双靶点抑制剂,能够有效地杀伤肿瘤细胞,在淋巴瘤等实体瘤中呈现良好的生物活性,同时能够逆转铂类抗肿瘤药物的耐药性[5-7]。本研究以人神经胶质细胞瘤U251细胞为实验对象,检测CUDC-907对U251细胞DNA损伤和细胞周期的影响,同时探讨CUDC-907诱导的细胞自噬与DNA损伤的相关性,为治疗神经系统肿瘤疾病提供新思路。
材 料 和 方 法
1 实验材料
CUDC-907购自Selleck Chemicals;碘化丙啶(propidium iodide,PI)、氯喹(chloroquine,CQ)和抗β-actin抗体购自Sigma;抗p70核糖体蛋白S6激酶(p70 ribosomol protein S6 kinase, p70s6K)、p53、细胞分裂周期蛋白2(cell division cycle protein 2, Cdc2)和p21抗体购自Santa Cruz;抗Akt、p-p70s6K和p-Cdc2抗体购自Cell Signaling Technology;抗p-Akt和γ-H2AX 抗体购自Abcam;HRP 标记的II抗购自北京中杉金桥生物技术有限公司;Alexa Fluor 488标记的山羊抗小鼠荧光II 抗购自Thermo Fisher。
2 实验方法
2.1细胞培养 人胶质瘤细胞株U251购于上海中科院细胞库,用含10%胎牛血清的DMEM高糖培养基置于37 ℃、5% CO2的培养箱中培养。
2.2MTT法检测细胞活力 接种U251细胞于96孔板中,用不同剂量(0、0.05、0.1、0.25、0.5、1、2.5和5 μmol/L)的CUDC-907处理24 h。终止培养前4 h每孔加入20 μL的MTT(5 g/L)。吸去培养液,每孔加入150 μL DMSO并振荡5 min,在490 nm波长下测定吸光度(A)值,并对结果进行统计分析。
2.3流式细胞术检测细胞周期 不同浓度的CUDC-907作用细胞24 h后,胰酶消化并收集细胞,然后加入预冷的75%无水乙醇,于-20 ℃固定过夜。800 r/min 离心5 min,弃上清后用PBS洗细胞2次;加入RNase A 于37 ℃ 孵育30 min;然后加入PI避光染色10 min,上机检测分析各组细胞的周期分布。
2.4Western blot实验 U251细胞经CUDC-907作用24 h 后,PBS洗涤2次,用预冷的RIPA蛋白裂解液(含有蛋白酶抑制剂)冰上裂解20 min,13 000 r/min离心 20 min,收集上清并用BCA法定量。取约30 μg的蛋白进行SDS-PAGE,然后将蛋白质电转至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h, 加入I抗4 ℃孵育过夜,然后加入II抗室温孵育1 h,用ECL 显色后使用凝胶成像系统进行成像。
2.5免疫荧光染色 接种细胞至放有盖玻片的6 孔板进行爬片培养,然后用不同浓度的CUDC-907处理细胞24 h。PBS洗涤玻片2 次, 4%多聚甲醛室温固定20 min,Triton X-100 破膜后用山羊血清室温封闭30 min,加入小鼠抗人γ-H2AX 单克隆抗体于室温孵育2 h,再加入荧光II 抗37 ℃避光孵育1 h,DAPI染色5 min并封片。激光共聚焦显微镜下观察并采集图像,细胞核内出现的绿色灶点即为γ-H2AX焦点,蓝色荧光为细胞核。
2.6GFP-LC3质粒转染及荧光检测 接种U251细胞于6孔板中,当细胞生长至80%左右时,用Lipfectamine 2000转染GFP-LC3质粒,转染方法参照说明书。转染6 h 后换新鲜完全培养基继续培养。转染24 h后,用不同浓度的CUDC-907处理细胞24 h,对照组加入DMSO。倒置荧光显微镜下进行观察实验结果,并拍照分析。
3 统计学处理
采用SPSS 18.0统计软件进行数据分析,实验所得数据以均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 CUDC-907抑制 U251细胞活力
MTT实验结果显示,不同浓度CUDC-907处理U251细胞24 h后,细胞活力均显著下降,半抑制浓度(half maximal inhibitory concentration, IC50)=1.84 μmol/L,且其对细胞活力的抑制作用呈剂量依赖性(P<0.05),见图1。
2 CUDC-907抑制PI3K/Akt信号通路
本研究首先检测CUDC-907对PI3K/Akt信号通路的影响。Western blot实验结果表明,在CUDC-907处理的细胞中,Akt和p70s6K的磷酸化水平较对照组明显降低(P<0.05),见图2,表明CUDC-907能够显著抑制PI3K/Akt信号通路。
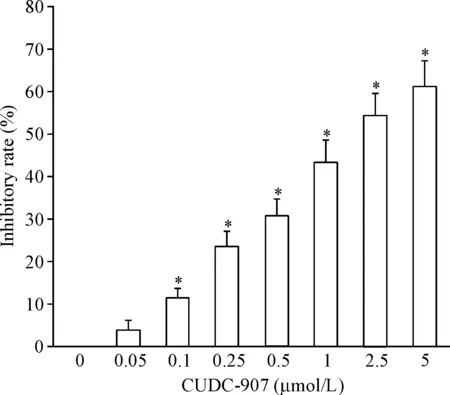
Figure 1.The inhibitory effect of CUDC-907 on the viability of U251 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图1CUDC-907抑制U251细胞活力
3 CUDC-907增加细胞内γ-H2AX焦点的生成
为了确定CUDC-907是否诱导DNA发生损伤,本研究检测了CUDC-907对U251细胞内DNA损伤标志分子γ-H2AX焦点数目的影响。从结果中可以看出,U251细胞经CUDC-907作用后,γ-H2AX的焦点数目明显增多(P<0.05),表明CUDC-907可诱导U251细胞发生DNA双链断裂,见图3。用Western blot实验检测了CUDC-907对γ-H2AX蛋白表达的影响,发现在CUDC-907处理的细胞中,γ-H2AX呈高表达趋势(P<0.05),进一步说明CUDC-907对U251细胞DNA损伤的诱导作用,见图4。
4 CUDC-907诱导U251细胞发生G2/M期阻滞
采用流式细胞术观察了CUDC-907对U251细胞周期的影响,结果显示,CUDC-907处理U251细胞24 h后,处于G2/M期的细胞数量明显增多,而S期的细胞数量则相应减少(P<0.05),见图5。

Figure 2.CUDC-907 inhibited the phosphorylation of Akt and p70s6K in the U251 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2CUDC-907抑制Akt和p70s6K的磷酸化

Figure 3.Assessment of CUDC-907-induced DNA damage in U251 cells through an immunofluorescence γ-H2AX focus assay. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图3CUDC-907诱导U251细胞内γ-H2AX焦点的生成
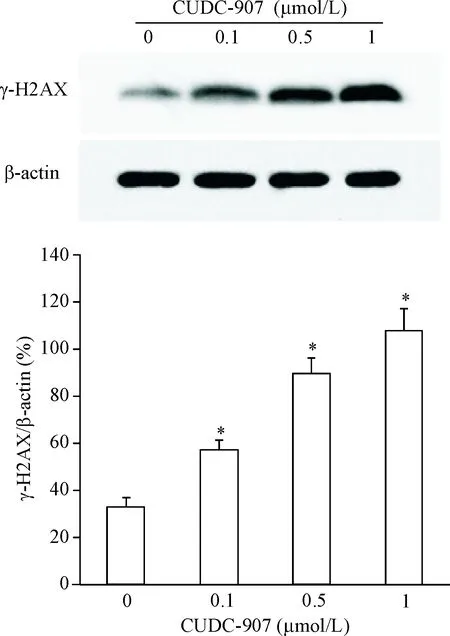
Figure 4.The effect of CUDC-907 on the protein expression of γ-H2AX in the U251 cells was determined by Western blot analysis. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图4Westernblot检测γ-H2AX的蛋白表达
Western blot实验检测了CUDC-907对细胞周期相关蛋白表达及活性的影响,结果可见,U251细胞经CUDC-907处理24 h后,p21的蛋白表达水平明显升高,细胞周期素B1(cyclin B1)的表达则受到抑制,但p53表达水平未见明显变化,同时Cdc2的磷酸化水平明显降低(P<0.05),见图6。
5 抑制自噬促进CUDC-907诱导的DNA损伤
当细胞发生自噬时,GFP-LC3 融合蛋白转移至细胞自噬体膜,形成明亮的绿色斑点。转染GFP-LC3 质粒的U251细胞经CUDC-907处理24 h后,细胞内呈点状分布的GFP-LC3融合蛋白表达增加,表明CUDC-907 能够促进U251胶质瘤细胞发生自噬,见图7。Western blot实验结果表明,与对照组相比,CUDC-907处理组LC3-II/LC3-I比例明显增加(P<0.05),进一步说明CUDC-907能够诱导U251细胞发生自噬,见图8。
自噬影响细胞内DNA损伤修复过程[8]。当采用自噬抑制剂氯喹(10 μmol/L)与CUDC-907(0.1 μmol/L)联合处理细胞后,Western blot实验发现γ-H2AX的表达水平明显升高(P<0.05),说明抑制自噬促进了CUDC-907诱导的DNA 损伤应答,见图9。

Figure 5.The effect of CUDC-907 on the cell cycle distribution in U251 cells was detected by flow cytometry. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图5CUDC-907对U251细胞周期的影响
讨 论
在脑胶质瘤的发生发展过程中,PI3K/Akt信号通路发挥着极为重要的作用,能够促进胶质瘤的生长与侵袭转移等过程[9];同时,该信号途径还参与调控细胞自噬及肿瘤放化疗敏感性等[10]。组蛋白乙酰化和去乙酰化修饰是一种动态平衡过程,在染色体结构修饰及调节转录因子的转录活性中发挥着重要作用。组蛋白的乙酰化程度是由组蛋白转移酶和组蛋白去乙酰化酶协调控制[11]。肿瘤细胞中的HDAC 常过量表达,致使组蛋白过度乙酰化,导致核小体结构变得紧密,使得转录受到抑制,从而引发肿瘤[12]。

Figure 6.The effect of CUDC-907 on the expression of cell cycle regulatory proteins in the U251 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图6CUDC-907对细胞周期相关蛋白表达的影响
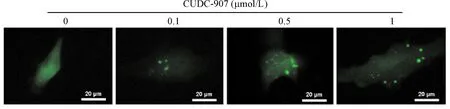
Figure 7.The expression of GFP-LC3 in the U251 cells transfected with GFP-LC3 plasmid. After transfection for 24 h, the cells were treated with CUDC-907 at different concentrations for another 24 h.
图7CUDC-907对U251细胞中GFP-LC3融合蛋白表达的影响
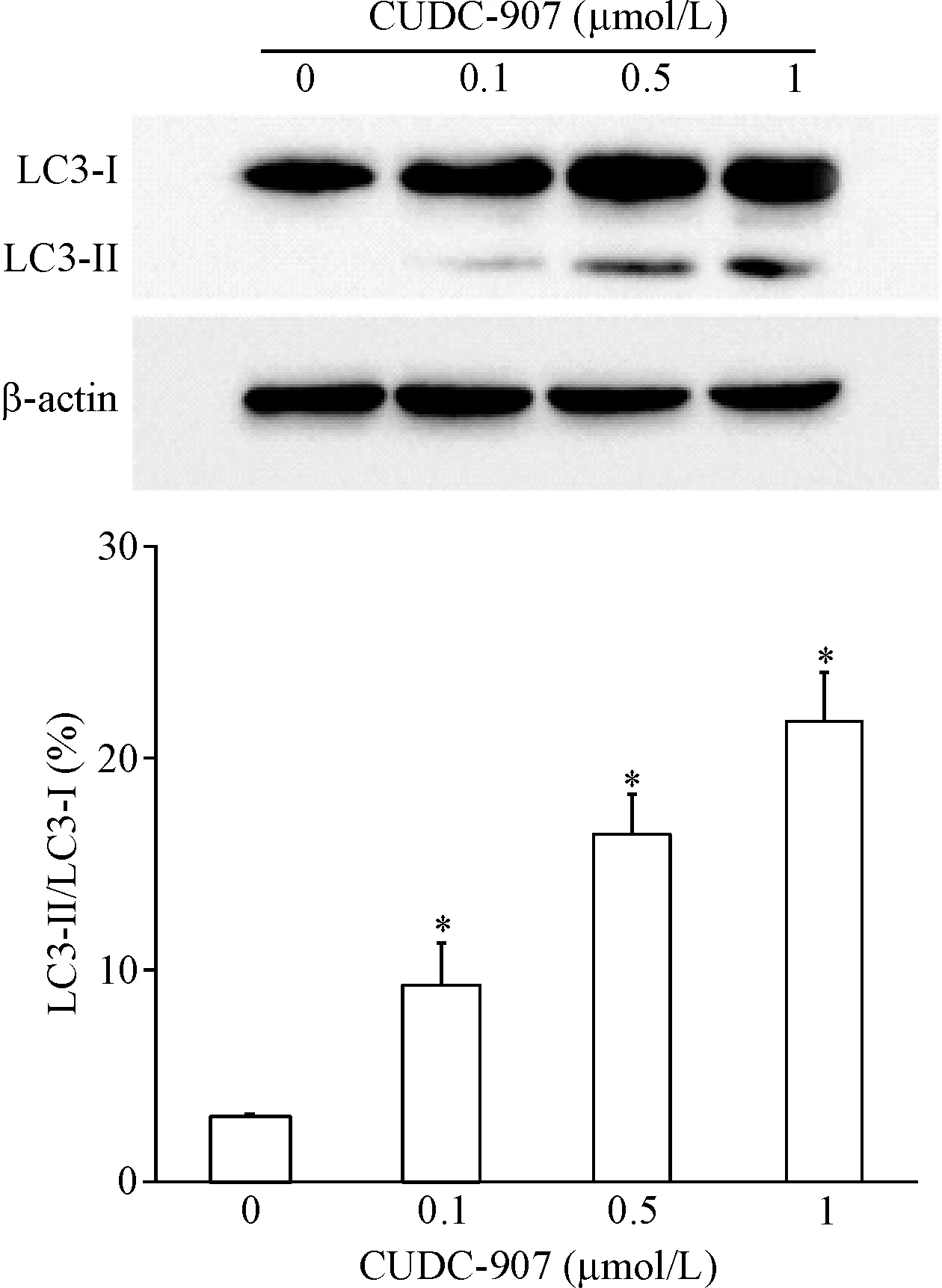
Figure 8.Treatment of CUDC-907 increased the expression of LC3-II in the U251 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图8CUDC-907促进自噬标志分子LC3-II的表达
本研究发现HDAC和PI3K双重抑制剂CUDC-907能够有效抑制U251细胞中PI3K/Akt信号通路,同时诱导DNA损伤应答。DNA损伤应答是细胞应对外界不利影响的一种防御性反应,当DNA 损伤应答发生时,常伴随着细胞凋亡和细胞周期阻滞等[13]。我们的研究结果表明,不同浓度的CUDC-907处理U251细胞后,DNA损伤应答标志分子γ-H2AX 的焦点数量增多,同时γ-H2AX的表达水平升高,表明CUDC-907能够诱导U251 细胞发生DNA 损伤应答。
DNA 损伤发生后,细胞往往通过阻滞细胞周期进程而修复损伤的DNA,如果DNA受损严重则细胞走向凋亡或坏死。在本研究中我们发现,CUDC-907作用U251细胞后,处于G2/M期的细胞数量明显增多,表明CUDC-907能够诱导U251细胞发生G2/M期阻滞,且在CUDC-907处理的U251细胞中,p21蛋白的表达水平上调,而cyclin B1的蛋白表达则下调,同时Cdc2的磷酸化受到抑制,表明CUDC-907诱导的G2/M期阻滞可能与其调控上述细胞周期相关蛋白的表达与磷酸化修饰相关。

Figure 9.Suppression of autophagy accelerated CUDC-907-induced γ-H2AX expression. The cells were treated with CUDC-907 at 0.1 μmol/L and/or CQ at 10 μmol/L for 24 h, the protein level of γ-H2AX was determined by Western blot analysis. Mean±SD.n=3.*P<0.05vscontrol group (untreated cells);#P<0.05vsCUDC-907-treated group.
图9抑制自噬促进CUDC-907诱导的γ-H2AX表达
细胞自噬是细胞的一种自我保护机制,是真核细胞将细胞内受损、变性和衰老的蛋白质以及细胞器运输到溶酶体进行消化降解,进而维持细胞内稳态的一种蛋白质降解途径[14]。细胞自噬与DNA 损伤应答关系密切:一方面,DNA 损伤能诱导细胞自噬的发生;另一方面,自噬调节多种损伤修复关键酶的表达而促进细胞修复受损的DNA[15]。本研究发现,CUDC-907能够诱导U251 细胞发生自噬。当自噬抑制剂氯喹联合CUDC-907处理U251细胞后,γ-H2AX 的表达水平明显升高,说明CUDC-907诱导的自噬可能是保护性自噬。CUDC-907和自噬抑制剂的联合应用可能为胶质瘤的临床治疗提供新策略。

