红景天苷上调HIF-1α减轻高糖诱导的大鼠肾小球内皮细胞损伤*
谢瑞燕, 方雪玲, Hamze I.RAGE, 崔彤霞, 朱伟平
(中山大学附属第五医院肾内科, 广东 珠海 519000)
糖尿病肾病(diabetic nephropathy/diabetic kidney disease,DKD)是导致终末期肾病(end-stage renal disease,ESRD)的主要原因之一,也是导致糖尿病患者死亡的主要原因,在我国DKD的发生率逐年增加[1]。长期高血糖引起肾小球内皮细胞的损伤,肾小球内皮细胞损伤破坏了肾小球滤过屏障的功能及结构,从而导致机体产生蛋白尿[2]。肾脏慢性缺氧是DKD发生发展的重要因素,其中低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)在DKD缺氧环境中扮演着关键的角色[3]。缺氧状态下,HIF-1α进入细胞核,在缺氧反应元件(hypoxia response element,HRE)处与 HIF-1β亚基结合形成二聚体复合物 HIF-1,HIF-1表达增加,使机体提高耐缺氧能力,以适应缺氧环境[4]。高糖能引起缺氧[4]。然而体外模拟高糖环境,能否造成缺氧环境,激活HIF途径,存在争议[5]。体外高糖能否引起肾小球内皮细胞表达HIF-1α尚无相关的研究报道。
红景天苷(salidroside,Sal)是蔷薇目景天科红景天的主要活性成分,具有广泛的药理学效应[6],较多报道称,红景天苷具有保护心血管和抗缺氧等多种活性[7-9]。近年来,有研究[10]发现红景天苷对改善早期糖尿病肾病患者的临床疗效具有较明显作用,但对其作用机理缺乏深入研究,尤其是从细胞凋亡及细胞内HIF-1α变化方面等相关因素观察其保护作用的研究较少。因此,本研究采用体外高糖诱导肾小球内皮细胞损伤,在此基础上观察高糖状态下,红景天苷对肾小球内皮细胞的作用及相关机制,从而为早期糖尿病肾病防治提供新思路和新靶点。
材 料 和 方 法
1 材料和试剂
大鼠肾小球内皮细胞(rat renal glomerular endothelial cells,rRGECs)由中山大学附属第三医院彭晖教授惠赠。红景天苷(上海同田,批号10338-51-9);抗HIF-1α鼠单克隆抗体(Santa Cruz);辣根过氧化物酶标记的山羊抗鼠IgG II 抗(Jackson);RNA提取试剂盒(Trizol,Invitrogen);TaKaRa RT-qPCR试剂盒(大连宝生生物);MTT试剂和D-葡萄糖(D-glucose,D)购自Sigma;胎牛血清(Gibco);甘露醇(mannitol,M; Amersco)。
2 方法
2.1细胞培养与分组 将rRGECs等量接种于25T培养瓶(Corning),使用低糖DMEM完全培养基(含10%胎牛血清和1%双抗)进行传代培养,每48 h更换一次培养基,待细胞的融合度达70%~80%开始进行实验。用无血清培养基对细胞进行饥饿处理24 h,再分为正常糖(normal glucose,NG;5.6 mmol/L葡萄糖)组、高糖(high glucose, HG; 20、30和50 mmol/L葡萄糖)组、高渗(D-glucose+mannitol, DM; 5.6 mmol/L葡萄糖+44.4 mmol/L甘露醇)组及红景天苷+高糖(Sal+HG;1、5、10、50、100、150和200 μmol/L红景天苷+20 mmol/L葡萄糖)组。
2.2MTT法检测细胞活力 (1)观察不同浓度葡萄糖在不同时点对rRGECs活力的影响,确定高糖诱导缺氧的最佳条件:取对数生长期的rRGECs,按照每孔5 000个细胞的密度接种于96孔板中并分成正常糖(5.6 mmol/L)组和高糖(20、30和50 mmol/L)组,每组6个平行孔。分别于24 h、72 h和120 h后,每孔加入20 μL MTT,继续避光37 ℃孵育4 h,小心吸出上清液,加入150 μL DMSO溶解,振荡10 min。使用酶标仪检测490 nm的吸光度(A)值。(2)观察不同浓度红景天苷在不同时点对rRGECs活力的影响,确定红景天苷保护rRGECs的最佳条件:细胞分为高糖(20 mmol/L)组及红景天苷(1、5、10、50、100、150和200 μmol/L)+高糖组。其余步骤同上。
2.3RT-qPCR检测细胞内HIF-1α、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)和血管内皮钙黏素(vascular endothelial cadherin,VE-cadherin)的mRNA水平 采用氯仿-异丙醇法提取细胞总RNA。将细胞按照每孔1×105接种于6孔板,分为4组:正常糖组、高糖组、高渗组及红景天苷+高糖组。细胞经过相应处理后,吸走培养液,加入预冷的PBS洗涤3次,用TRIzol提取细胞内的总RNA,根据TaKaRa试剂说明书,反转录合成cDNA,再用实时定量PCR仪进行扩增。PCR扩增实验条件:95 ℃预变性30 s; 95 ℃变性5 s、60 ℃退火30 s,共40个循环。引物由Invitrogen合成。β-actin的上游引物序列为5’-CCACCATGTACCCAGGCATT -3’, 下游引物序列为5’-GAGCCACCAATCCACACAGA-3’,产物为136 bp; HIF-1α上游引物序列为5’-GGATGAGTTCCGAACGTCGA -3’, 下游引物序列为5’-AGATGGGAGCTCACGTTGTG-3’,产物为145 bp; VEGFA的上游引物序列为5’-GGGAGCAGAAAGCCCATGAA-3’, 下游引物序列为5’-CACACAGGACGGCTTGAAGA-3’,产物为115 bp; VE-cadherin的上游引物序列为5’-ACCAGCATGGACCACCTAAG-3’, 下游引物序列为5’-CAGTACAGCCAGGCAGATCA-3’,产物为120 bp。每组设3个重复,以β-actin为内参照,根据2-ΔΔCt法计算样本的各个基因mRNA相对表达量。
2.4Western blot法检测细胞内HIF-1α的蛋白水平 采用细胞全蛋白抽提试剂盒提取细胞总蛋白。各组细胞经过相应处理后去培养液,加入4 ℃预冷的细胞裂解液,冰上裂解30 min后,用BCA法测定每组细胞总蛋白浓度。制备12%分离胶、5%浓缩胶,每孔上样60 μg,进行SDS-PAGE,分别加入 I 抗(HIF-1α以1∶500稀释,内参照β-actin以1 ∶1 000稀释)后,4 ℃孵育过夜。用1×PBST充分洗膜3次后,加入辣根过氧化氢酶标记的山羊抗小鼠IgG II 抗(1 ∶40 000)室温孵育1 h,用1×PBST洗膜3次后,用电化学发光(ECL)显色剂显色,最后用凝胶图像分析系统ImageJ进行半定量分析,目标蛋白相对表达量=目标蛋白的灰度值/内参照灰度值。
3 统计学分析
采用SPSS 20.0统计软件处理数据。符合正态分布的计量资料用均数±标准差(mean±SD)表示,方差齐时,两组间比较用t检验,多组间比较采用单因素方差分析,各组均数间的两两比较采用LSD-t检验;方差不齐时采用非参数统计。以上实验均重复3次,以P<0.05为差异有统计学意义。
结 果
1 长期高糖能抑制rRGECs的活力及其功能
MTT结果表明,培养24 h后,与正常糖组相比,高糖(20和30 mmol/L)组rRGECs的活力增加(P<0.05);培养120 h后,与正常糖组相比,高糖(20、30和50 mmol/L)组rRGECs的活力下降(P<0.05),其中高糖(30 mmol/L)组的活力最低(P<0.01),见表1。RT-qPCR结果表明,培养24 h和120 h后,与正常糖组相比,高糖(20和30 mmol/L)组rRGECs内VE-cadherin的mRNA表达下调(P<0.05),见图1A。上述结果说明高糖培养rRGECs 24 h已出现细胞损伤。
2 高糖影响rRGECs内HIF-1α的表达
RT-qPCR结果表明,培养24 h后,与正常糖组相比,高糖(20 mmol/L)组rRGECs内表达HIF-1α的mRNA上调(P<0.05);培养120 h后,与正常糖组相比,高糖(20、30和50 mmol/L)组rRGECs内HIF-1α的mRNA表达下调(P<0.05);高渗组与正常糖组相比较,差异无统计学显著性,提示高糖对rRGECs细胞表达HIF-1α mRNA的影响与渗透压变化无关,见图1B。Western blot实验结果显示,培养24 h后,与正常糖组相比,高糖(20 mmol/L)组rRGECs内HIF-1α的蛋白表达增加(P<0.05),见图1D。
表1MTT法检测不同浓度的葡萄糖对rRGECs细胞活力的影响
Table 1.The effect of different concentrations of glucose on the viability of rRGECs (%. Mean±SD.n=3)
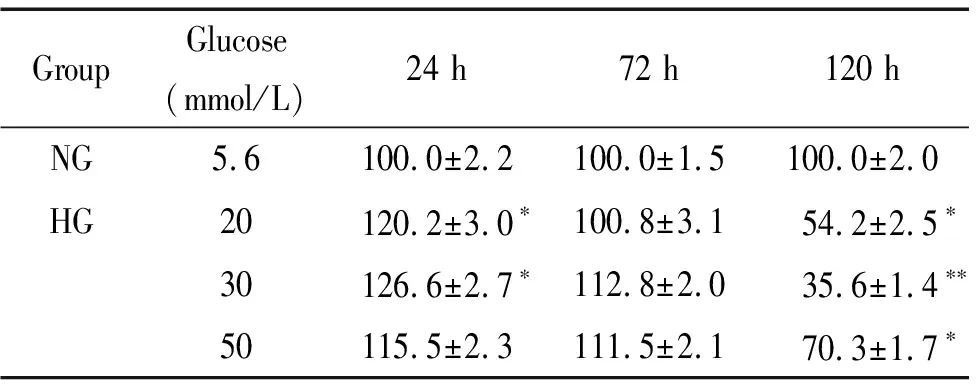
GroupGlucose(mmol/L)24 h72 h120 hNG5.6100.0±2.2100.0±1.5100.0±2.0HG20120.2±3.0∗100.8±3.154.2±2.5∗30126.6±2.7∗112.8±2.035.6±1.4∗∗50115.5±2.3111.5±2.170.3±1.7∗
*P<0.05,**P<0.01vsNG group.
3 高糖影响rRGECs内VEGFA的mRNA表达
RT-qPCR结果表明,培养24 h后,与正常糖组相比,高糖(20和30 mmol/L)组rRGECs内VEGFA的mRNA表达上调(P<0.05);培养120 h后,与正常糖组相比,高糖(20、30和50 mmol/L)组 rRGECs内VEGFA的mRNA表达下调(P<0.05),见图1C。
4 红景天苷能改善高糖对rRGECs的影响
MTT结果表明,培养24 h后,与高糖(20 mmol/L)组相比,红景天苷(50 μmol/L)组中rRGECs的细胞活力明显增加 (P<0.01);培养120 h后,红景天苷组细胞活力无显著变化,见图2。RT-qPCR结果表明,培养24 h后,与高糖组(20 mmol/L)相比,红景天苷(50 μmol/L)+高糖组rRGECs内VE-cadherin的mRNA表达上调(P<0.05),见图3A。因此,后续实验中采用50 μmol/L的Sal干预高糖培养的rRGECs。
5 红景天苷可上调高糖培养rRGECs中HIF-1α的表达
RT-qPCR结果表明,培养24 h后,与高糖(20 mmol/L)组相比,红景天苷(50 μmol/L)+高糖组rRGECs内HIF-1α的mRNA表达上调(P<0.05);Western blot结果显示,与高糖(20 mmol/L)组相比,红景天苷(50 μmol/L)+高糖组rRGECs的HIF-1α蛋白表达上调(P<0.05),见图3B、C。
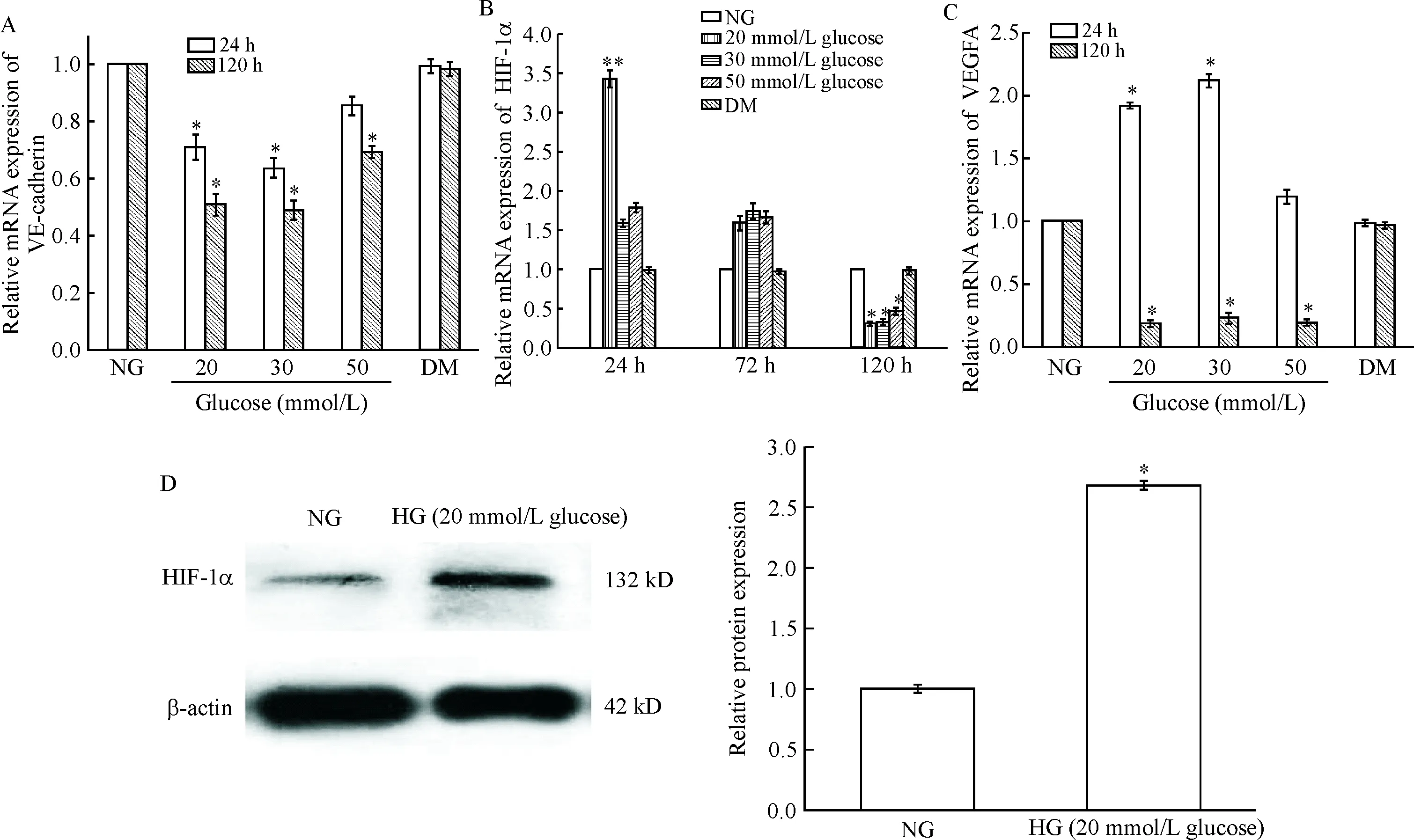
Figure 1.The effects of high glucose (HG) on the expression of VE-cadherin, HIF-1α and VEGFA in rRGECs. A: the relative mRNA expression of VE-cadherin; B: the relative mRNA expression of HIF-1α; C: the relative mRNA expression of VEGFA; D: Western blot for determining the protein level of HIF-1α. Mean±SD.n=3.*P<0.05,**P<0.01vsNG group.
图1不同浓度葡萄糖对大鼠肾小球内皮细胞VE-cadherin、HIF-1α和VEGF表达的影响
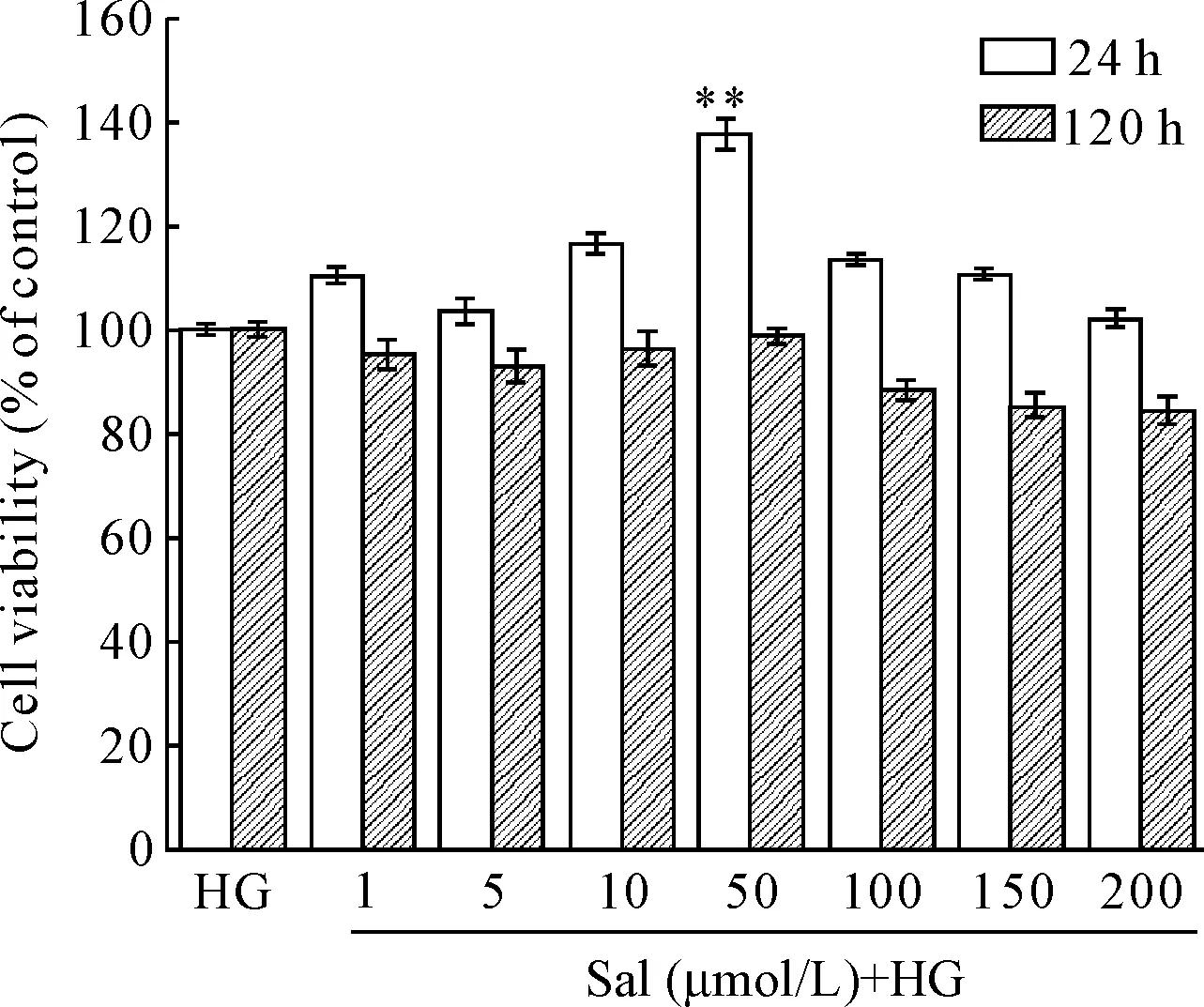
Figure 2.The effect of different doses of salidroside on the viability of high glucose (HG)-induced rRGECs using MTT assays. Mean±SD.n=3.**P<0.01vsHG group.
图2MTT法检测不同浓度的红景天苷对rRGECs细胞活力的影响
讨 论
肾小球内皮细胞损伤是导致糖尿病肾病蛋白尿发生的重要机制[11]。VE-cadherin是内皮细胞功能的重要标志[12]。Singh等[13]认为高糖通过损伤肾小球内皮细胞表面的糖萼,使内皮细胞凋亡增加,进而导致蛋白尿的发生。已有研究证明, DKD早期就存在肾小球血管内皮细胞损伤,随着病情的进展,血管内皮细胞功能损伤的程度较早期更严重[14]。本研究发现高糖培养24 h和120 h后, rRGECs内VE-cadherin的mRNA表达均下调。
慢性缺氧在糖尿病肾病发生发展中起重要的作用。细胞处于缺氧状态时,能引起细胞表达HIF-1α增多,进而激活HIF调节的下游因子如VEGF和红细胞生成素等的转录,改善组织和细胞的缺氧状态[15]。已有研究报道,糖尿病动物模型中,HIF-1α表达增加在分离的大鼠心脏和肾脏都能检测出来[16]。然而,体外高糖培养细胞能否引起细胞HIF-1α表达增加存在争议。既往的大部分研究认为体外高糖培养细胞不能引起细胞内HIF-1α的表达。Vordermark等[4]研究认为,仅仅给予高糖培养细胞不足以激活HIF途径。Malhotra等[17]认为高糖促使葡萄糖转运蛋白-1表达增多,损害HIF-1α的稳定性,进而促进HIF通过泛素-蛋白酶体途径降解。本研究发现高糖培养24 h后,rRGECs的活力增加,HIF-1α的mRNA和蛋白及VEGFA的mRNA表达均增加。高糖能引起活性氧簇(reactive oxygen species,ROS)的产生[18]。Klimova等[19]认为ROS能通过促进脯氨酸羟化酶的降解,进而稳定HIF-1α的表达。同时,有报道认为高糖能提高细胞胞浆NADH/NAD+的比例,增加一氧化氮的生成,增加细胞内HIF-1α的表达[20-21]。同时,本研究还发现高糖培养120 h后,rRGECs的细胞活力下降, HIF-1α和VEGFA mRNA表达下调。这可能与长期高糖刺激rRGECs,导致细胞功能严重受损有关。因此,推测rRGECs内HIF-1α的表达情况可能与细胞活力、葡萄糖浓度、培养时间及HIF/VEGF通路有关。

Figure 3.The effects of salidroside (Sal) on the expression of VE-cadherin and HIF-1α in high glucose (HG; 20 mmol/L glucose)-induced rRGECs. A: the relative mRNA expression of VE-cadherin; B: the relative mRNA expression of HIF-1α; C: Western blot for determining the protein level of HIF-1α. Mean±SD.n=3.*P<0.05vsHG group.
图3不同浓度红景天苷对高糖培养大鼠肾小球内皮细胞VE-cadherin和HIF-1α表达的影响
Zheng等[22]认为红景天苷能够抑制HIF-1α蛋白的降解,使人肾成纤维细胞内HIF-1α表达增多,进而激活红细胞生成素的表达,增强造血功能。Guo等[23]研究发现红景天苷能通过增加成骨细胞HIF-1α蛋白的表达,改善骨质疏松的缺氧情况。有报道[24]认为红景天苷能通过降低HIF-1α蛋白的表达,改善缺氧状态下的SH-SY5Y细胞凋亡情况。本研究采用多个浓度梯度的红景天苷干预高糖组的rRGECs,发现红景天苷的浓度在一定范围内时,能使rRGECs内表达VE-cadherin的mRNA增加,并非红景天苷的作用于rRGECs的浓度越高,保护效果就越强,这与以往的报道[25]不同。因此,我们认为红景天苷浓度过低,则达不到最小有效保护浓度,浓度过高,则有可能对细胞造成损伤。当红景天苷浓度为50 μmol/L时,rRGECs出现活力增加,细胞功能标志物VE-cadherin的mRNA表达上调;同时,细胞内的HIF-1α的mRNA及蛋白表达增加,可能与红景天苷诱导rRGECs内HIF-1α转位,进而激活rRGECs表达HIF-1α有关[3],所以认为红景天苷能减轻高糖诱导rRGECs损伤,其机制可能与rRGECs内HIF-1α表达增加有关。
——题《圣山系-金巅》

