猪带绦虫Ts14-3-3.3蛋白的原核表达及多克隆抗体制备
罗 波,李 想,周必英
猪囊尾蚴病又称猪囊虫病(Cysticercosis),是由猪带绦虫(Taeniasolium,Ts)的中绦期幼虫——囊尾蚴(Cysticercuscellulosae)感染人或猪引起的一种严重危害畜牧业生产和人类健康的人兽共患寄生虫病。猪带绦虫成虫寄生于人体小肠,当孕节或虫卵随宿主粪便排出体外,被中间宿主人或猪吞食后,在其小肠内孵出六钩蚴,钻入肠壁,经血循环及淋巴系统到达脑、眼、皮下、肌肉等部位,逐渐发育为囊尾蚴引起囊虫病,寄生于人脑引起的脑囊虫病约占人体囊虫病的80%以上,具有极高的致残率与致死率[1-2]。该病呈全球性分布,国外主要流行于亚洲、非洲和拉丁美洲等一些国家和地区,在我国主要以东北、华北、西北和西南等地人群发病率较高,其中贵州黔东南的凯里、从江,黔南的都匀、罗甸和黔西南的册亨等县(市)为少数民族聚居区,是猪带绦虫/囊虫病的潜在流行区,主要与不良饮食卫生习惯和生猪饲养方式不当有关[3-5]。
国内外学者对猪带绦虫生活史不同发育阶段的抗原分子进行了大量研究[6-11]。其中14-3-3蛋白是一类在真核细胞内高度保守的酸性蛋白家族,广泛参与寄生虫细胞信号转导、新陈代谢、生长发育、周期调控、细胞凋亡等多种重要的生命活动[12-15]。课题组前期研究证实,猪带绦虫14-3-3蛋白家族共有6个编码基因,其编码的蛋白分别归属于ζ、α、ε和γ亚型[16],我们将其依次命名为Ts14-3-3.1、Ts14-3-3.2、Ts14-3-3.3、Ts14-3-3.4、Ts14-3-3.5和Ts14-3-3.6。在其它寄生虫也发现有相似的蛋白亚型,如华支睾吸虫14-3-3ε和阴道毛滴虫14-3-3α[17-18],都具有较好的抗原性。本研究拟利用大肠杆菌Arctic Express原核表达重组蛋白Ts14-3-3.3,将纯化后的重组蛋白免疫新西兰兔,制备多克隆抗体,观察Ts14-3-3.3蛋白在猪带绦虫成虫和囊尾蚴的分布情况,为进一步探究该蛋白的生物学功能及其作为囊虫病免疫诊断抗原及疫苗候选抗原的潜力奠定基础。
1 材料与方法
1.1 材 料
1.1.1虫体、质粒与菌株 猪带绦虫成虫和猪囊尾蚴由遵义医科大学寄生虫学教研室保存,质粒pCznⅠ、大肠杆菌Top 10和Arctic Express由南京钟鼎生物技术有限公司提供。
1.1.2主要试剂EasyPfuDNA Polymerase购自北京全式金生物技术有限公司;限制性内切酶NdeⅠ、XbaⅠ、T4 DNA连接酶、RNA提取试剂盒及反转录试剂盒均购自Takara公司;质粒提取试剂盒、DNA凝胶回收试剂盒购自天根生化科技有限公司;琼脂糖凝胶电泳材料、氨苄青霉素(Amp)、异丙基硫代半乳糖苷(IPTG)、显色剂购自北京索莱宝科技有限公司;蛋白纯化试剂盒HisLinkTMSpin Protein Purification System购自美国Promega公司;Protein A琼脂糖纯化树脂购自生工生物工程(上海)股份有限公司;鼠源抗His单克隆抗体、羊抗兔IgG-HRP购自南京钟鼎生物技术有限公司;羊抗鼠IgG-HRP购自美国CST公司;PVDF膜购自美国Millipore公司;弗氏佐剂购自美国Sigma公司。
1.2 方 法
1.2.1引物设计与合成 根据猪带绦虫Ts14-3-3.3基因序列(登录号:KF752476.1)设计特异性引物,F:5′-GGAATTCCATATGATGGCAGCTATTA-CTTCCT-3′(含NdeⅠ酶切位点),R:5′-GCTCTAGATTAGGAGTCAGTTTCACATTC-3′(含XbaⅠ酶切位点)。引物由滁州通用生物公司合成。
1.2.2目的基因PCR扩增 按试剂盒说明书提取猪囊尾蚴总RNA,反转录合成cDNA。以猪囊尾蚴cDNA为模板,F和R为引物进行PCR扩增,反应体系50 μL:10×EasyPfuBuffer 5 μL;EasyPfuDNA Polymerase 1 μL;F、R各1 μL;cDNA模板2 μL;2.5 mmol/L dNTPs 5 μL;加ddH2O至50 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,35个循环,72 ℃延伸10 min。取5 μL PCR产物进行琼脂糖凝胶电泳鉴定,其余产物按照凝胶回收试剂盒说明书进行回收纯化。
1.2.3重组质粒pCznⅠ-Ts14-3-3.3构建与鉴定 利用NdeⅠ和XbaⅠ双酶切纯化的PCR产物及pCznⅠ载体,连接并转化至大肠杆菌Top 10感受态细胞,涂布于含Amp抗性的LB培养基平板上,37 ℃培养过夜,挑取单个菌落进行PCR及酶切鉴定,最后测序验证。
1.2.4Ts14-3-3.3重组蛋白的诱导表达、纯化与鉴定 提取测序正确的阳性克隆质粒,转化Arctic Express感受态细胞。挑取单个菌落,接种于含50 μg/mL Amp的LB液体培养基,37 ℃ 200 r/min培养过夜,摸索不同终浓度的IPTG(0.1 mmol/L、0.5 mmol/L、1.0 mmol/L)、不同诱导时间(3 h、6 h、12 h)以及不同温度(11 ℃、24 ℃、37 ℃)下对蛋白表达的影响,优化出最佳诱导表达条件。离心收集菌体,超声破碎后分别收集上清和沉淀进行SDS-PAGE分析。Ts14-3-3.3重组蛋白的纯化按照HisLinkTMSpin Protein Purification System试剂盒说明书操作,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)及免疫印迹(Western blot)进行分析和鉴定。
1.2.5动物免疫与抗血清制备 将纯化的Ts14-3-3.3重组蛋白与等体积的弗氏佐剂混匀后免疫新西兰大白兔(皮下,400 μg/次),共免疫3次(1次/ 2周),末次免疫1周后颈动脉放血,收集血清,以Ts14-3-3.3重组蛋白包被酶联板,间接酶联免疫吸附试验(ELISA)法检测免疫后兔血清抗体效价。利用Protein A亲和层析胶制备亲和层析柱,将Ts14-3-3.3兔抗血清按1∶1稀释后进行柱层析纯化,待抗体结合后洗脱抗体,SDS-PAGE电泳检测其纯度。
1.2.6Ts14-3-3.3天然蛋白的Western blot分析 分别提取猪带绦虫成虫和猪囊尾蚴的虫体总蛋白,采用12% SDS-PAGE进行电泳,用湿转方法将目的蛋白转移至PVDF膜,5%脱脂牛奶37 ℃封闭后进行Western blot检测。一抗为纯化后的Ts14-3-3.3多克隆抗体(1∶1 000稀释),二抗为HRP标记羊抗兔IgG(1∶5 000稀释),DAB显色后拍照,记录结果。
1.2.7免疫组化 将猪带绦虫成虫成节和囊尾蚴制成石蜡切片,常规脱蜡至水,置于柠檬酸缓冲液(pH 6.0)中加热至沸腾,重复蒸煮1~2次;滴加3% H2O2于切片上,室温孵育10 min;以纯化后的Ts14-3-3.3多克隆抗体为一抗(1∶400稀释),4 ℃过夜孵育;与二抗HRP标记羊抗兔IgG(1∶1 000稀释)室温下孵育1 h,DAB显色,苏木素-伊红复染,每次反应结束后需洗涤切片。梯度酒精脱水,中性树胶封片,镜检。以免疫前兔阴性血清为对照,阳性反应呈棕黄色颗粒。
2 结 果
2.1Ts14-3-3.3基因PCR扩增 以猪囊尾蚴cDNA为模板,F和R为引物,PCR扩增得到747 bp的Ts14-3-3.3目的基因片段(见图1),与预期大小一致。

M: DNA分子质量标准; 1: Ts14-3-3.3基因PCR扩增产物图1 Ts14-3-3.3基因PCR扩增Fig.1 PCR amplification of Ts14-3-3.3 gene
2.2重组质粒pCznI-Ts14-3-3.3的鉴定 重组质粒pCznI-Ts14-3-3.3经NdeⅠ和XbaⅠ双酶切鉴定后,得到4 400 bp的pCznI载体片段和747 bp的Ts14-3-3.3目的基因片段(见图2)。测序结果表明重组质粒pCznI-Ts14-3-3.3构建成功。

M1, M2: DNA分子质量标准; 1: 酶切前质粒pCznⅠ-Ts14-3-3.3; 2: 酶切后质粒pCznⅠ-Ts14-3-3.3图2 重组质粒pCznⅠ-Ts14-3-3.3的双酶切鉴定Fig.2 Restriction enzyme analysis of the recombinant plasmid pCznⅠ-Ts14-3-3.3
2.3Ts14-3-3.3重组蛋白的表达、纯化和鉴定 重组质粒pCznⅠ-Ts14-3-3.3经11 ℃、0.5 mmol/L IPTG诱导12 h后,SDS-PAGE分析,在分子质量约29.31 kD处出现明显条带(见图3),其分子质量大小与预测分子量加上His标签分子量的大小相符,说明该条带为带His标签的Ts14-3-3.3目的蛋白。Ts14-3-3.3重组蛋白主要以可溶形式存在于菌体处理后的上清液中。将Ts14-3-3.3重组蛋白通过HisLinkTM亲和层析柱纯化,获得了大小约29.31 kD的单一目的蛋白条带(见图4)。用Anti-His标签抗体作为Western blot一抗,能够识别表达的Ts14-3-3.3重组蛋白条带(见图5),说明该蛋白携带有His标签,进一步确认该条带为Ts14-3-3.3目的蛋白条带。

M: 蛋白分子质量标准; 1: 诱导前; 2: 诱导后; 3: 诱导后破碎上清;4: 诱导后破碎沉淀图3 Ts14-3-3.3重组蛋白的表达Fig.3 Expression of Ts14-3-3.3 recombinant protein
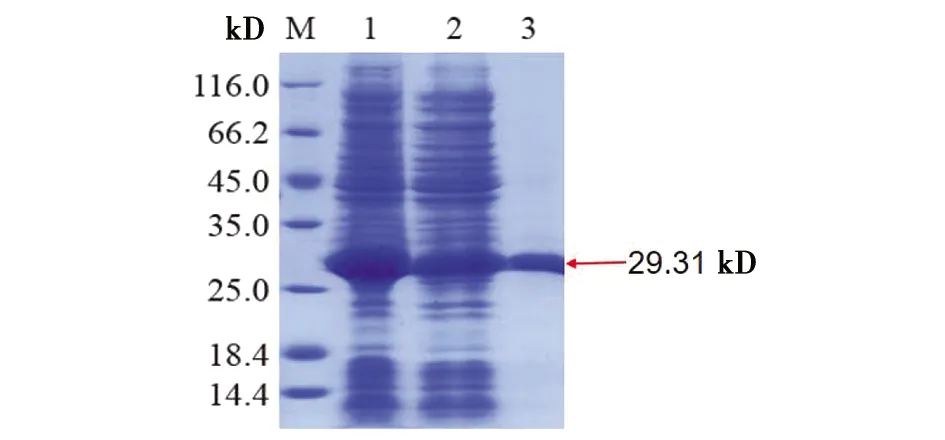
M: 蛋白分子质量标准; 1: 超声破碎后菌液; 2: 流出液; 3: 洗脱液图4 Ts14-3-3.3重组蛋白的纯化Fig.4 Purification of Ts14-3-3.3 recombinant protein
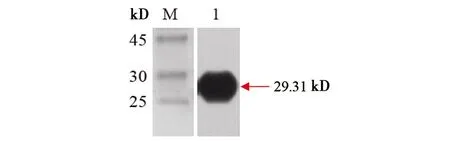
M: 蛋白分子质量标准; 1: Ts14-3-3.3重组蛋白图5 Ts14-3-3.3重组蛋白的Western blot鉴定Fig.5 Western blot identification of Ts14-3-3.3 recombinant protein
2.4免疫血清抗体效价及纯度 间接ELISA法检测结果显示,经纯化的Ts14-3-3.3重组蛋白免疫后兔血清抗体效价为1∶512 000(见图6)。纯化后的Ts14-3-3.3多克隆抗体通过SDS-PAGE电泳观察,结果显示,55 kD和25 kD处出现抗体重链与轻链条带,未发现杂蛋白(见图7),提示获得了纯度较高的Ts14-3-3.3多克隆抗体。

图6 免疫血清的抗体效价Fig.6 Antibody titer of immunized serum

M: 蛋白分子质量标准; 1: 纯化后抗体图7 纯化抗体SDS-PAGE分析Fig.7 SDS-PAGE analysis of purified antibody
2.5Ts14-3-3.3天然蛋白的Western blot分析 用制备的多克隆抗体对Ts14-3-3.3天然蛋白在猪带绦虫成虫和囊尾蚴阶段的表达进行Western blot分析,该多克隆抗体能与猪带绦虫成虫和囊尾蚴Ts14-3-3.3天然蛋白在分子质量约27.75 kD处发生反应(见图8),证明在猪带绦虫成虫和囊尾蚴阶段均有Ts14-3-3.3蛋白表达,提示制备的Ts14-3-3.3多克隆抗体具有良好的特异性。
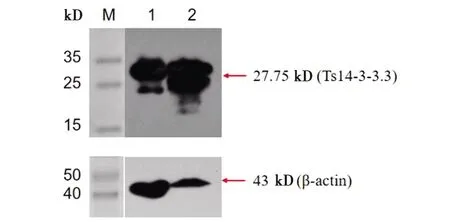
M: 蛋白分子质量标准; 1: 猪囊尾蚴; 2: 猪带绦虫成虫图8 Ts14-3-3.3天然蛋白的Western blot分析Fig.8 Western blot analysis of Ts14-3-3.3 nature protein
2.6免疫组化 以Ts14-3-3.3多克隆抗体作为一抗,免疫组化分析结果显示,该抗体能够与猪带绦虫成虫成节(见图9 B1)和囊尾蚴(见图9 A1)组织中的天然Ts14-3-3.3发生特异性结合,可见明显增多的棕黄色颗粒,提示Ts14-3-3.3天然蛋白在猪带绦虫成虫和囊尾蚴中均有表达。

A: 囊尾蚴; B: 成虫; 1: 阳性血清; 2: 阴性血清图9 Ts14-3-3.3天然蛋白的免疫组化分析(×200)Fig.9 Immunohistochemistry analysis of Ts14-3-3.3 nature protein(×200)
3 讨 论
14-3-3蛋白是一类发现于牛脑神经元蛋白的酸性蛋白家族,其命名来源于蛋白在DEAE-纤维素层析和凝胶电泳中的迁移位置[19]。该蛋白在物种间高度保守,广泛参与生物体生命活动的调节,在细胞增殖、分化、衰老和凋亡过程中扮演重要角色[20-22]。研究表明,14-3-3β通过调控抑癌基因p53及其下游调控因子,能够增强胶质瘤细胞的增殖和侵袭能力,抑制其凋亡[23]。相反,14-3-3σ则保护细胞免受致瘤性转化,在调节癌症代谢重编程方面发挥重要作用[24]。在寄生虫领域,14-3-3蛋白可以通过与乙酰胆碱受体(AChR)α4亚基之间的相互作用,动态调节细胞的稳态水平,增强寄生虫入侵宿主的能力[25],调控寄生虫的生长发育及形态学变化[15,26]。李宗吉等[27]利用细粒棘球绦虫Eg14-3-3重组蛋白免疫小鼠,可诱导小鼠产生84.47%的保护率,能有效抵抗原头节的攻击感染,有望成为预防棘球蚴病的候选疫苗。
多克隆抗体具有制备简单、特异性强、耗时短、免疫学研究用途广等优点,利用特异性抗体对重组蛋白进行免疫定位,是检测蛋白在寄生虫体内表达与功能预测的常用方法[28]。研究表明,14-3-3蛋白在寄生蠕虫体内的定位与其参与虫体生理调节、生长发育以及入侵宿主密切相关[29]。Zhang等[30]利用14-3-3小鼠抗血清成功识别出日本血吸虫虫卵、尾蚴以及童虫阶段的14-3-3天然抗原,表明该蛋白存在于日本血吸虫生活史的各个阶段。冯琳等[31]实验结果显示,在15 ℃和37 ℃条件下诱导出的重组蛋白均以包涵体形式存在,本试验通过降低诱导温度,采用相同体系对Ts14-3-3.3蛋白进行诱导表达,成功获得了猪带绦虫可溶性重组蛋白Ts14-3-3.3,证实了低温条件下获得可溶性蛋白的概率较大。将重组蛋白纯化后免疫新西兰兔,能诱导1∶512 000的高效价特异性血清抗体,且该抗体可以识别猪带绦虫成虫和囊尾蚴中的天然14-3-3.3蛋白,与吴冬丽等[32]结果一致,表明制备的多克隆抗体具有良好的特异性。本研究结果显示Ts14-3-3.3蛋白在猪带绦虫成虫和囊尾蚴组织中均有表达,进一步推测14-3-3蛋白可能参与猪带绦虫的生长发育过程,具有重要意义。就该蛋白如何参与调控猪带绦虫的生长发育以及致病机理,值得进一步研究。
本研究在前期获得猪带绦虫14-3-3家族成员[16]的基础上,利用基因工程技术成功制备了可溶性Ts14-3-3.3重组蛋白并获得了多克隆抗体,为进一步研究该蛋白的生物学功能及其在囊虫病诊断与疫苗研究中的价值奠定了基础。
利益冲突:无
——一道江苏高考题的奥秘解读和拓展

