2016-2018年江西省钩端螺旋体病鼠类动物流行病学调查与分离菌株鉴定
张翠彩,张汀兰,徐建民,蒋秀高,邱海燕
钩端螺旋体病(简称钩体病)是由致病性钩端螺旋体(简称钩体)引起的人兽共患病,人类主要通过直接或间接接触感染动物的尿液而感染,宿主动物包括啮齿类动物(黑线姬鼠、黄毛鼠等)、家畜(猪、犬和牛等),其中鼠类为钩体病的主要宿主动物。
21世纪以来,全国钩体病发病率、死亡率呈逐步下降态势,近10年已处于较低水平,但局部地区仍然有报道存在小范围的散发或者暴发疫情[1]。江西省作为钩体病的老疫区,每年的发病率均位居全国前列,是江西省危害较大的急性传染病之一。2016至2018年,全国(不含港澳台地区)共报告钩端螺旋体病病例分别为354例、201例和157例,报告发病率分别为0.0258/10万、0.0146/10万和0.0113/10万;而2016至2018年江西省共报告病例分别是19例、21例和9例,报告发病率分别为0.0416/10万、0.0261/10万和0.0195/10万,3年的报告发病率均高于全国,因此,对钩体病的宿主动物开展流行病学监测,了解宿主动物种类构成、感染状况及分离菌株病原学特征分析有助于钩体病的流行病学溯源及疾病的预防控制。近年来多位点序列分析(Multilocus sequence typing,MLST)的分子分型方法,逐渐应用于病原菌分子分型、分子流行病学研究等。本研究于2016-2018年选择4个江西省国家级钩体病监测点上饶县、上高县、上犹县及浮梁县作为监测现场,对主要宿主动物鼠类构成及带菌状况开展流行病学监测,并对分离菌株利用暗视野显微镜凝集试验进行血清群鉴定,利用MLST 方法对其进行基因分型研究,初步了解江西省鼠密度、带菌率及分离菌株的血清学、分子流行病学特征,为江西省钩体病预防控制提供科学依据。
1 材料与方法
1.1捕鼠方法 选取江西省钩体病高发的四个国家级监测点上饶、上高、上犹及浮梁县钩体疫区稻田环境作为现场监测地点,于2016-2018年每年4-6月、9-11月采取夹夜法开展鼠类种类构成、钩体病病原学监测调查。每个监测点每次放置有效鼠夹数≥300夹,行距30 m,夹距5 m,鼠夹大约为40×12×12 cm。每次天黑前放夹,次日凌晨收夹。参考《医学动物分类鉴定》对捕获鼠类进行鼠种鉴定,计算鼠密度。
1.2钩体病原分离培养 无菌解剖操作,取米粒大小鼠肾组织接种到10 mL EMJH培养基中,28 ℃培养5~7 d,采用暗视野显微镜观察有无钩体疑似菌株生长。
1.3主要试剂 15群15型钩体参考菌株诊断血清购自中国食品药品检定研究院;基因组提取选用北京赛百盛基因技术有限公司硅胶膜型TM基因组DNA提纯试剂盒;PCR Premix购自大连宝生物工程(大连)有限公司;100 bp DNA Marker购自北京天根生化科技有限公司。
1.4分离菌株血清群鉴定 利用中国15群15型钩体参考菌株免疫兔血清,采用暗视野显微镜凝集试验(MAT),对分离钩体菌株进行血清学鉴定,在暗视野显微镜下观察凝集结果,以出现50%菌体凝集的血清群为最终鉴定血清群。
1.5分离菌株基因组提取 分离菌株在EMJH钩体液态培养基中28 ℃培养7~10 d,达到对数生长期后提取基因组DNA,操作方法按照试剂盒说明书进行。
1.6MLST基因分型 参考文献中的MLST方案[2],利用7个位点pntA、sucA、pfkB、tpiA、mreA、gluM、caiB进行PCR扩增,各位点详细信息见表1,引物由北京奥科鼎盛生物科技有限公司合成。利用20 μL反应体系,cDNA模板1 μL,上下游引物(10 μmol/L)各1 μL,Premix Ex Taq10.0 μL,纯水补充至20 μL反应体积。PCR 扩增程序如下:95 ℃ 预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,扩增30个循环,最后72 ℃延伸 10 min。PCR扩增产物进行纯化、双向测序,由北京奥科鼎盛生物科技有限公司完成。将每株分离株7个位点序列与MLST网站http://pubmlst.org/上相应等位基因进行比较,获得每株分离菌株的等位基因谱(gluM-pntA-sucA-tpiA-pfkB-mreA-caiB)以及ST型别。利用BioNumerics软件进行聚类分析,观察分离菌株间的基因多态性及种群结构。
表1 MLST分析中7个位点引物信息
Tab.1 Primers of seven loci in MLST analysis

位点引物序列 (5′ to 3′)PCR产物大小/bppntAF-TAGGAAARATGAAACCRGGAACR-AAGAAGCAAGATCCACAAYTAC621sucAF-TCATTCCACTTYTAGATACGATR-TCTTTTTTGAATTTTTGACG640pfkBF-CGGAGAGTTTTATAARAAGGACATR-AGAACACCCGCCGCAAAACAAT588tpiAF-TTGCAGGAAACTGGAAAATGAATR-GTTTTACRGAACCHCCGTAGAGAAT639mreAF-GGCTCGCTCTYGACGGAAAR-TCCRTAACTCATAAAMGACAAAGG719gluMF- AGGATAAGGTCGCTGTGGTAR- AGTTTTTTTCCGGAGTTTCT650caiBF-CAACTTGCGGAYATAGGAGGAGR-ATTATGTTCCCCGTGAYTCG650
2 结 果
2.1 鼠类种类构成及带菌监测
2.1.1鼠种分布及分离钩体菌株情况 2016-2018年在江西省上饶县、上高县、浮梁县及上犹县共布置鼠夹14 387只,共计捕鼠1 404只,平均鼠密度为9.76%,分离菌株64株,鼠类钩体分离率为4.56%; 鼠种构成包括黑线姬鼠、褐家鼠、黄毛鼠、黄胸鼠及社鼠5个种类。4个监测点优势鼠种均以黑线姬鼠和黄毛鼠为主。从钩体菌株分离结果显示,浮梁县的分离菌株来自黑线姬鼠;上饶县和上犹县菌株均来自黑线姬鼠和黄毛鼠,而上高县未分离到钩体菌株,浮梁县的钩体分离率高于其他2个县,为10.56%,具体见表2。
2.1.2血清群鉴定 经MAT试验结果显示:64株江西省致病性钩体分离株隶属于3个血清群,分别是黄疸出血群、爪哇群和致热群。其中黄疸出血群为江西省主要优势血清群,占81.25%(52/64),其次依次为爪哇群占17.19%(11/64)和致热群占1.56%(1/64)。不同地区的优势血清群分布存在一定程度地域差异,浮梁和上饶地区全部为黄疸出血群,上犹地区以爪哇群为主,占84.62%(11/13),其次为致热群和黄疸出血群,详见图1。
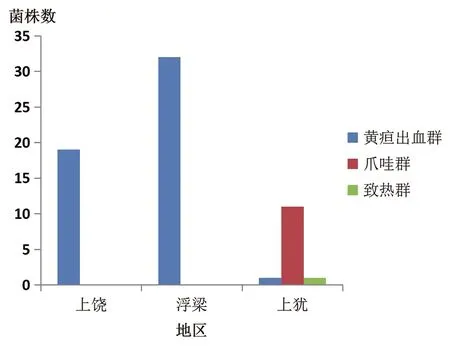
图1 2016-2018年64株江西省钩端螺旋体菌株血清群构成Fig.1 Numbers of Serogroup for 64 Leptospira strains isolated from Jiangxi during 2016-2018
表2 2016-2018年江西省国家级钩体病监测点鼠种分布及分离菌株情况
Tab.2 Rodent distribution and strains isolated from rodent during 2016-2018 in four national monitoring sites of leptospirosis in Jiangxi
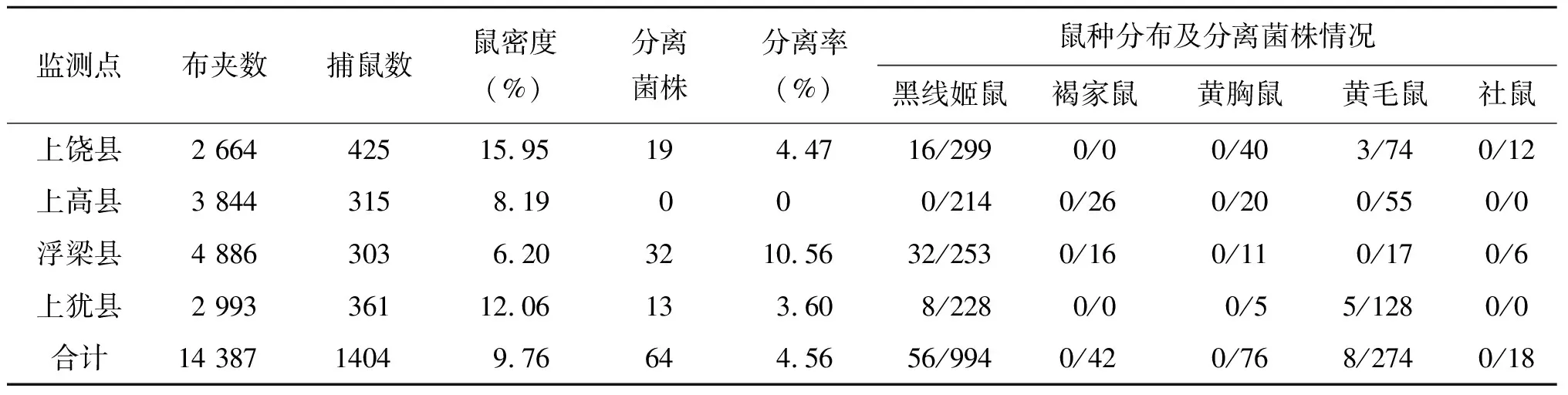
监测点布夹数 捕鼠数鼠密度(%)分离菌株分离率(%)鼠种分布及分离菌株情况黑线姬鼠褐家鼠黄胸鼠黄毛鼠社鼠上饶县2 66442515.95194.4716/2990/00/403/740/12上高县3 8443158.19000/2140/260/200/550/0浮梁县4 8863036.203210.5632/2530/160/110/170/6上犹县2 99336112.06133.608/2280/00/55/1280/0合计14 38714049.76644.5656/9940/420/768/2740/18
2.2 MLST分型结果
2.2.1基因多态性分析 MLST分析结果显示,64株致病性钩体呈现6个ST型别,主要优势ST型别是ST1,占76.56%(49/64),其次依次是ST143占15.62%(10/64)、ST17占3.13%(2/64)、ST92占1.56%(1/64)、ST224占1.56%(1/64)和ST216占1.56%(1/64)。不同地区的优势ST型分布也存在一定程度的地域差异,上犹地区以ST143为主,浮梁和上饶地区以ST1为主,详见图2。
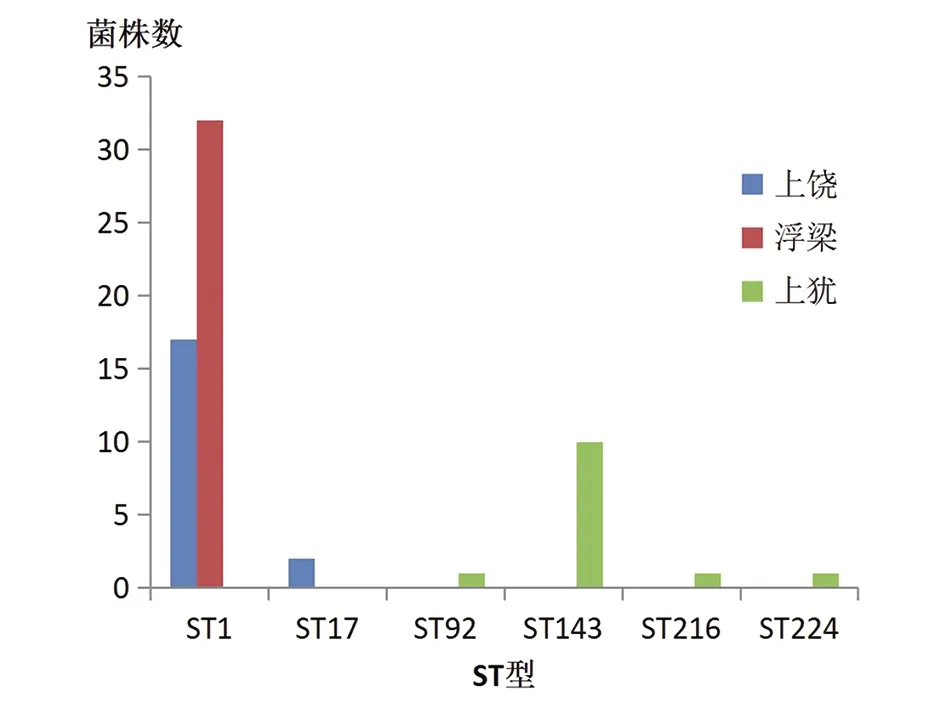
图2 2016-2018年64株江西省钩端螺旋体菌株ST型别情况Fig.2 Numbers of sequence types (STs) for 64 Leptospira strains isolated from Jiangxi Province during 2016-2018
2.2.2BioNumerics软件分析结果 采用UPGMA聚类分析显示:64株菌株共分为6个Cluster群,分别对应6种ST型,见图3。Cluster1对应ST216,仅包括1株2016年上犹菌株;Cluster2对应ST92,仅包括1株2018年上犹菌株;Cluster3对应ST17,来自2017年上饶菌株;Cluster4对应ST224,仅包括1株2016年上犹菌株;Cluster5对应ST1,为江西省的优势克隆群,包括2016-2018年17株上饶和2016、2018年32株浮梁菌株;Cluster6对应ST143,包括10株2016年上犹菌株。由聚类图显示:ST型别分布地域差异明显,上饶地区包括ST1和ST17两种型别,浮梁仅包括ST1一种型别,上犹地区基因型别相对丰富,13株菌株呈现ST92、ST143、ST224和ST216四种型别,以ST143为主,占76.92%(10/13)。ST型别宿主分布存在一定程度差异。黑线姬鼠作为江西省的主要宿主,所分离菌株ST型别丰富,包括ST1、ST17、ST92、ST216和ST143五个ST型。黄毛鼠来源的分离菌株仅包括ST1、ST224和ST143三种ST型别。

图3 2016-2018年64株江西省钩端螺旋体UPGMA聚类分析Fig.3 UPGMA dendrogram of 64 Leptospira strains isolated from Jiangxi Province during 2016-2018
3 讨 论
啮齿类动物作为钩体病的重要宿主动物,在钩体病的传播、流行中起着重要作用。江西省是钩体病的老疫区,地理环境复杂、气候湿润,啮齿类动物丰富。本研究选取2016-2018年4个江西省国家级监测点开展现场调查、病原分离、鉴定研究,共捕获5种鼠种,4个监测点均以黑线姬鼠和黄毛鼠为优势鼠种,鼠密度为9.76%。2011年李世军报道贵州省锦屏、黎平和榕江县鼠密度介于5.0%~12.7%之间,不同地区优势鼠种不同,锦屏县以黑线姬鼠为主,黎平和榕江县以高山姬鼠为主[2]。2018年徐国英报道福建省鼠密度为6.29%,优势鼠种以黄毛鼠、黄胸鼠、褐家鼠和针毛鼠为主[3]。由此可见,不同省份的鼠密度稍有差异,并且优势鼠种也略有不同。本次江西省现场调查的鼠肾分离率偏低,为4.56%。巴西、新喀里多尼亚及马来西亚有文献报道鼠类钩体分离率介于11.0%~80.3%之间[4-6]。本团队对2002-2014年江西省钩体病开展流行病学现场监测,结果显示钩体分离率为9.35%[7]。有文献报道福建、安徽及浙江地区钩体分离率分别为0.76%、4.75%及1.61%[8-10]。由于钩体的分离培养技术要求较高,要求钩体液态培养基放置28 ℃孵箱内培育,每隔5~7 d检查有无钩端螺旋体生长。若有生长,即为分离阳性。若未见生长,需继续培养到60 d,仍不见钩端螺旋体方作阴性处理。因此,钩体的培养周期较长,采用的是液态培养基,而且频繁镜检容易受到污染,故其检出率较低。
本团队对2002-2014年间江西省分离菌株进行血清群和MLST分析,结果显示黄疸出血群、爪哇群和澳洲群为优势血清群,MLST分型结果显示ST1、ST143、ST105、ST37和ST17为5个优势ST型别[7]。徐建民等利用PFGE分型技术对2002-2008年江西监测菌株研究发现:黄疸出血群赖型、澳洲群澳洲型和爪哇群爪哇型是江西省人群及宿主动物中的优势型别[11]。本次研究显示黄疸出血群和ST1为2016-2018年江西鼠类的优势型别,血清群和ST型别分布在江西省地域差异明显,这可能与不同地区的地理位置、地形地貌、天气、海拔等因素有关。据报道根据地理位置和地形地貌等特征,江西省分为5个不同的动物钩体病地理流行病区域[7]。本次研究中分离到钩体菌株的3个监测点,隶属于其中的2个不同地理流行病区域,浮梁和上饶处于江西东北部丘陵地带,平均海拔在100~300 m左右;而上犹处于江西省西南部高原地区,森林植被丰富,适宜啮齿类动物生存,平均海拔在1 000~1 600 m左右。本次研究中2016-2018年江西省钩体病优势流行型别,与本团队对2002-2014年江西调查及徐建民等对2002-2008年的江西调查结果一致,这提示近年来江西省钩体病主要流行血清群和ST型别变化不大。李世军等对2007-2009年贵州菌株研究发现:3株分离株鉴定为黄疸出血群和ST1型别[12-13]。王亚琳等报道2010年四川乐至人间钩体疫情主要致病血清群为是黄疸出血群[1]。综上所述,江西省钩体病主要流行型别与中国四川、贵州等其他地区型别一致。
啮齿类动物以及家畜是钩体病的主要宿主动物,江西省是钩体病老疫区,本次江西省鼠类钩体病现场调查工作为江西省钩体病的分子流行病学研究提供了科学依据。因此,在以后的工作中应继续加强对啮齿类动物的动态监测,及时了解钩体病疫区的鼠种构成、鼠密度、带菌率及人间、宿主动物的感染型别,为江西省钩体病的流行病学溯源以及疾病预防控制提供科学依据。
利益冲突:无

