表达LTB乳酸杆菌提高艰难梭菌类毒素疫苗黏膜免疫效应的研究
苏 露,张雅青,顾巧玲,傅思武
热敏性肠毒素(Heat labile enterotoxin, LT)是产毒素型大肠埃希菌(Entero toxigenicEscherichiacoli, ETEC)分泌的不耐热肠毒素,具有很强的免疫原性,能够辅助其他抗原通过黏膜免疫途径使机体产生特异性抗体,常被作为黏膜免疫佐剂[1]。艰难梭菌(Clostridiumdifficile,C.difficile)是一种革兰阳性厌氧芽胞杆菌,为机会致病菌。当肠道环境遭到破坏,艰难梭菌可引起人和家畜致病,导致腹泻,严重者发展为伪膜性肠炎[2]。艰难梭菌最主要致病毒素为A毒素(C.difficileA Toxin,TcdA)和B毒素(C.difficileB Toxin,TcdB),由于二者能诱导机体产生中和抗体,因此TcdA和TcdB被作为艰难梭菌疫苗研究重要的候选抗原。本研究通过构建LTB佐剂乳酸杆菌表达载体,并以TcdA和TcdBA的类毒素作为疫苗抗原,观察乳酸杆菌表达LT佐剂的免疫保护效应。
1 材料与方法
1.1实验菌株和实验动物 大肠埃希菌DH5α、产毒素型大肠埃希菌CICC10665株、艰难梭菌标准株VPI10463、乳酸杆菌CGMCC1.557株和质粒pSIP411(本实验室保存)。SPF级BALB/c雌性小鼠(购自兰州大学动物实验中心),168只,18~20 g。
1.2乳酸杆菌LT表达载体的制备 从产肠毒素型大肠埃希菌CICC10665株中克隆LTB亚单位(Heat labile enterotoxin B subunit,LTB)基因,并与大肠埃希菌-乳酸杆菌穿梭表达载体pSIP411 进行连接,转化感受态DH5α,提取质粒,酶切、PCR扩增和测序(华大生物科技有限公司)。制备乳酸杆菌感受态,将pSIP411-LTB电转化到乳酸杆菌中,通过质粒提取、双酶切鉴定和 PCR鉴定筛选出的阳性菌,进行Spp IP诱导表达;提取表达细菌总蛋白,SDS-PAGE电泳,切下目的基因蛋白条带,转模,通过Westernblot检测LTB在乳酸杆菌中的表达(一抗为兔抗LTB的血清,二抗为HRP标记的羊抗兔IgG),通过增强化学发光法进行显影和定量检测。将表达LTB的乳酸杆菌阳性克隆接种液体培养基中,37 ℃,24 h后,菌液稀释至1010CFU/mL,4 ℃保存备用。
1.3艰难梭菌TcdA和Tcd B类毒素的制备 艰难梭菌置于透析袋中产毒培养;产毒培养液经低温离心及除菌,硫酸铵盐析,浓缩透析后经第一次酸沉淀;通过阴离子交换层析后,进行第2次酸沉淀。获得纯化的艰难梭菌TcdA和Tcd B,加入甲醛溶液至终浓度为0.4%,37 ℃放置7~14 d脱毒,最终制品即为艰难梭菌TcdA和Tcd B的类毒素。
1.4动物分组及疫苗方案 疫苗A组、疫苗 B组、疫苗A +LT组、疫苗B+LT组、空白组和对照组,各组均为28只小鼠。疫苗A、B组分别在第0 d、第14 d和第28 d时小鼠皮下分别接种TcdA类毒素与TcdB类毒素(各5 μg);疫苗A+LT、疫苗B+LT组在第0 d、第14 d和第28 d分别接种类毒素A与类毒素B(各5 μg),并同时灌胃表达LTB乳酸杆菌培养液(每次连续3 d,0.2 mL/d);对照组和空白组在第0 d、第14 d和第28 d时皮下接种PBS并灌胃生理盐水,同时对照组灌胃乳酸杆菌培养液(每次连续3 d,0.2 mL/d)。
1.5动物攻毒 在小鼠第1次接种后34 d后,各疫苗组和对照组小鼠均灌胃艰难梭菌VPI10463培养液106CFU;空白组给予灌胃生理盐水。观察小鼠腹泻、及死亡情况,并计算5 d体重减轻量=攻毒前体重-攻毒后第5 d体重。
1.6检测血清IgG及粪便IgA 各疫苗组和空白组小鼠在初次接种0 d、10 d、24 d和38 d后,分别收集小鼠血清和粪便,采用ELISA方法检测小鼠艰难梭菌TcdA和TcdB抗体血清IgG和粪便IgA滴度(上海仁捷生物科技有限公司)。96孔板用纯化的艰难梭菌TcdA和TcdB包被,加小鼠血清,37 ℃孵育1 h,洗板后加HRP 标记的兔抗鼠IgG(血清)二抗,37 ℃孵育1 h,洗板后加ELISA 底物反应液,37 ℃孵育30 min。终止反应。在酶标仪上于 450 nm 处测各孔吸光度值。
1.7采用SPSS 19.0统计学软件进行数据分析,计量资料组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1重组载体pSIP411-LTB的鉴定 如图1所示,重组质粒pSIP411-LTB经EcoRI与BamHI双酶切后,在琼脂糖凝胶电泳图谱中,得到一条长约390 bp与目的基因LTB相同的片段。基因测序结果在Blast数据库进行序列比对,验证为LTB相同序列。
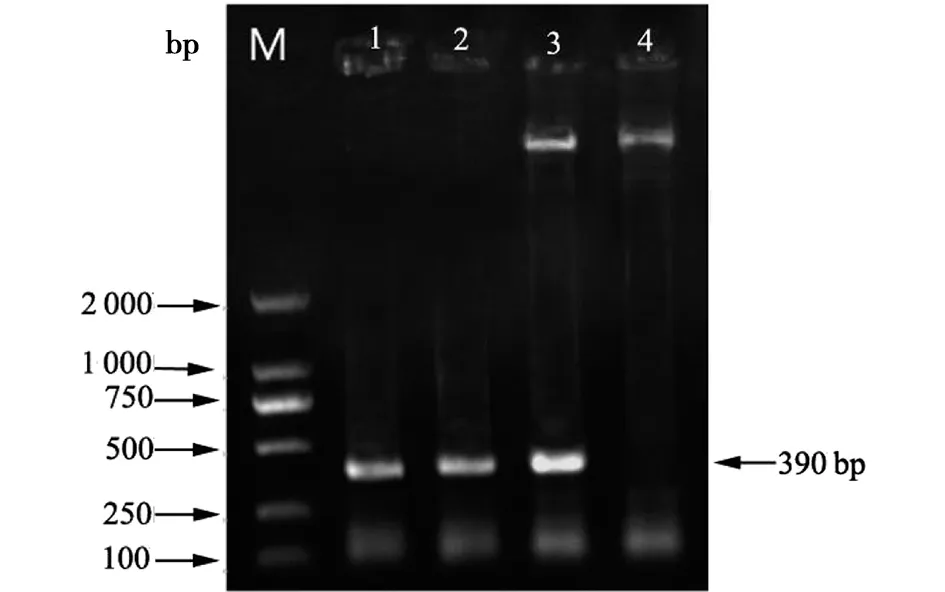
M:Mark;1:产肠毒素大肠杆菌PCP扩增产物;2:pSIP411-LTB 质粒PCP扩增产物;3:经EcoRI与BamHI双酶切的pSIP411-LTB片段;4:pSIP411-LTB 质粒图1 重组质粒pSIP411-LTB双酶切和PCP扩增产物Fig.1 Recombinant plasmid pSIP411-LTB bienzyme digestion and PCP amplification products
2.2LTB在乳酸杆菌中的表达 将乳酸杆菌,pSIP411-乳酸杆菌,pSIP411-LTB-乳酸杆菌、产肠毒素大肠埃希菌超声处理,进行SDS-PAGE蛋白电泳,将目的蛋白LTB经Westernblot检测,pSIP411-LTB-乳酸杆菌和ETEC均在约30 kDa处出现1条共同的条带,而乳酸杆菌和pSIP411-乳酸杆菌没有(图2)。

1:乳酸杆菌;2:pSIP411-乳酸杆菌;3:pSIP411-LTB-乳酸杆菌;4:ETEC图2 Westblot检测乳酸杆菌LTB的表达Fig.2 Westblot assay for expressing of Lactobacillus LTB
2.3艰难梭菌感染小鼠 密切观察感染艰难梭菌后的各组老鼠死亡率、腹泻和体重变化情况。在表1中,对照组小鼠腹泻发病率为100%,死亡率42.86%;而空白组、各疫苗组小鼠均无腹泻和死亡现象。与空白组和各疫苗组比较,对照组小鼠的5 d体重下降明显,有统计学意义(F=14.034,P<0.01)。
表1 各组小鼠感染艰难梭菌感染后的临床表现
Tab.1 Clinical manifestations ofC.difficileinfection in mice of each group

组别腹泻率/%5日体重下降量/g死亡率/%空白组0-0.76±0.13∗0对照组1000.83±0.1142.86疫苗A组0-0.64±0.07∗0疫苗A+LT组0-0.77±0.07∗0疫苗B组0-0.61±0.06∗0疫苗B+LT组0-0.65±0.08∗0
注:*P<0.001,与对照组比较。
2.4免疫保护效应 各组在初次接种后0 d抗TcdA和Tcd B血清IgG和粪便IgA没有统计学意义(F=0.688,1.3491;P均≥0.05)。初次接种10 d、24 d和38 d 后,与空白组和对照组比较,各疫苗组抗毒素血清IgG和粪便IgA显著升高,有统计学意义(F=284.928,1 037.052,696.822,74.004,184.065,166.952;P均<0.01);与疫苗A组比较,疫苗A+LTB组抗Tcd A血清IgG和粪便IgA显著升高,有统计学意义(F=21.878,27.222,8.310,56.490,63.759,101.780;P均<0.05);与疫苗B组比较,疫苗B+LTB组抗Tcd B血清IgG和粪便IgA也显著升高,有统计学意义(F=45.243,20.594,45.002,14.296,6.682,10.452;P均<0.05)。与空白组比较,对照组在第38 d时抗毒素血清IgG和粪便IgA升高,有统计学意义(F=647.730,205.148;P均<0.01)(图3)。
3 讨 论
艰难梭菌为人体常见的机会致病菌,当宿主免疫力下降或肠道发生菌群失调时,导致宿主出现腹泻、发热、恶心、腹痛和食欲不振等症状。艰难梭菌能够产生芽孢并随人或动物粪便进入环境中,存活时间长,很容易经口感染人类或动物[3]。艰难梭菌也是院内感染引起腹泻常见的病原体之一[4]。对于
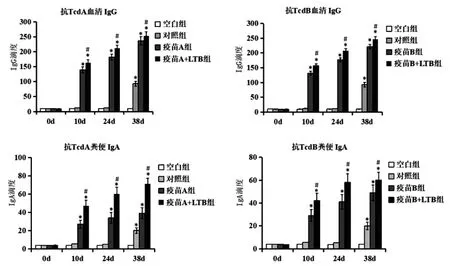
*P<0.01,与空白组比较,有统计学意义;#P<0.05,与疫苗A或B组比较,有统计学意义图3 各组抗TcdA和Tcd B血清IgG和粪便IgA的比较Fig.3 Comparison of anti-TcdA and Tcd B serum IgG and fecal IgA in each group
艰难梭菌感染的预防,饮食卫生和手部卫生尤为重要;疫苗预防艰难梭菌的感染是一个重要的途径[5]。本实验结果显示艰难梭菌攻毒组小鼠全部发生腹泻和体重减轻(5 d),死亡率为42.86%;说明艰难梭菌有毒株的致病力还是比较强的。
目前艰难梭菌疫苗主要是以TcdA和Tcd B作为靶抗原的疫苗[6],此外还有难梭菌疫苗的鞭毛帽蛋白、表面多糖和脂磷壁酸等作为疫苗的候选抗原[7-9]。艰难梭菌TcdA和TcdB是艰难梭菌重要的致病物质,由一个19.6 kb的染色体区域编码。虽然世界各地已分离的艰难梭菌毒素种类差异比较大,但绝大多数致病性的艰难梭菌都同时表达TcdA和TcdB,由于其能诱导机体产生中和抗体,被作为艰难梭菌主要的疫苗候选抗原[10]。本实验选用TcdA和TcdB类毒素作为候选疫苗,结果显示各疫苗组在感染艰难梭菌后,并没有出现明显的腹泻和体重减轻现象,也无小鼠死亡现象,说明疫苗对艰难梭菌感染的预防还是很有效果的;同时TcdA和TcdB类毒素能诱导小鼠产生强烈的IgG和IgA的应答,这与Broecker等人的研究结果相同[11]。
疫苗佐剂能够有效地改变和提高宿主对抗原的特异性应答。疫苗佐剂包括传统佐剂如铝佐剂、油乳佐剂,新型佐剂如微生物来源佐剂、微粒抗原递送体系、多糖佐剂、疱疹病毒VP22蛋白佐剂和天然来源佐剂等[12]。LT属于微生物来源佐剂,其是产毒素型大肠埃希菌的代谢产物,具有强烈的免疫原性,诱导机体产生强烈的黏膜免疫效应[1]。LT由A、B两个亚单位构成,由于LTA毒性强,常需要突变后作为候选佐剂,而LTB不具有毒性并具有良好的佐剂效应被直接选用候选佐剂,由于LTB能够与靶细胞GM1神经节苷脂结合的功能常作为抗原载体, 与抗原联合时, 其佐剂作用加强了所连接的细胞对抗原的摄取[13-14],因此本研究采用LTB作为佐剂来增强艰难梭菌类毒素的疫苗免疫效应。
对于艰难梭菌的感染,肠道黏膜免疫起着至关重要的作用。近年通过使用肠道正常菌群乳酸杆菌、双歧杆菌等作为肠道感染疫苗转基因载体的研究越来越多[15]。通过口服活的表达载体,在肠道持续的表达疫苗蛋白或佐剂,有利于黏膜免疫的产生,对于肠道感染的病原体疫苗更具有优势。本实验结果显示,联用佐剂LTB疫苗组的血清IgG和粪便IgA滴度在初次接种10 d后均明显高于单用疫苗组,说明乳酸杆菌载体在肠道表达LTB,能够增强宿主的黏膜免疫效应,增强艰难梭菌疫苗的免疫应答。对照组口服乳酸杆菌后,在初次接种0 d,10 d,24 d后,血清IgG和粪便IgA滴度与空白组比较,无统计学差异,说明乳酸杆菌并不能单独增强小鼠的免疫;在初次接种34 d时口服感染艰难梭菌,对照组小鼠出现体重减轻和死亡,且活下来的小鼠血清IgG和粪便IgA滴度较空白组明显升高,说明艰难梭菌诱导小鼠免疫应答,体液免疫反应增强。
本研究探索乳酸杆菌表达佐剂联合艰难梭菌类毒素疫苗对小鼠进行免疫效应的研究,发现乳酸杆菌LTB表达载体对艰难梭菌疫苗具有很好的佐剂效应,为进一步研制艰难梭菌LTB-TcdA-乳酸杆菌载体活疫苗打下基础。
利益冲突:无

