DMOG对间充质干细胞生物学特性影响的研究
姜丽霞葛婷婷周丽萍刘丽珍竺璐婕周斌杰余勤
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江大学附属第一医院骨髓移植中心
间充质干细胞(mesenchymal stem cells,MSCs)是一种来源广泛、具有强大增殖能力和多向分化潜能的成体干细胞,已成为再生医学领域的研究热点之一。目前临床上MSCs主要用于体外细胞移植治疗[1-2]。尽管该法可行,但步骤繁琐、扩增到所需细胞量需要的周期较长、细胞来源受限、容易发生污染及存在潜在的致瘤风险等缺点仍然限制了MSCs的广泛应用。近年来有报道指出,特定细胞因子和药物的刺激可促进细胞信号通路的一系列信号传导,使干/祖细胞在短时间内从骨髓进入外周循环池,进一步迁移、归巢到达损伤部位,参与组织修复[3-4]。因此,有效的MSCs体内动员可以避免上述体外移植的诸多缺点,具有无可比拟的高效性和低创性,为临床各类疾病的治疗带来了新希望[5-9]。
目前,国内外尚无公认有效的MSCs动员剂。本课题组前期研究发现,二甲基乙二酰基甘氨酸(dimethyloxaloylglycine,DMOG) 可 以 在 体 内 动 员MSCs[10]。因此本研究通过体外实验,探讨了不同浓度DMOG对MSCs的增殖能力、细胞周期、迁移能力、多向分化能力等生物学特性的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物 清洁级健康雄性SD大鼠,体质量80~100g,由浙江中医药大学动物实验中心提供[实验动物使用许可证号:SYXK(浙)2013-0184],来源于上海西普尔-必凯实验动物有限公司 [实验动物生产许可证号:SCXK(沪)2013-0016]。
1.1.2 主要试剂 DMOG购于Cayman公司(批号:71210);DMEM/F12培养基、青霉素-链霉素溶液均购于 Invitrogen公司(批号:1785916、10378016);胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶-EDTA均 购 于 Gibco 公 司 (批 号 :614318、2015041203);MSCs成骨诱导分化培养基、油红O储存液均为广州赛业生物科技有限公司产品(批号:RASMX-90021、T150610G001);硝酸银、硫代硫酸钠均购于Sigma公司(批号:S8157、72049);PrimeScriptTMRT Master Mix、SYBRPremix ExTagTMⅡ(TliRnase H Plus)试剂盒均购于Takara公司(批号:RR420Q、RR054A)。
1.1.3 主要仪器设备 TE2000-S型倒置相差显微镜为Nikon公司产品;PN PAL-CAXXXLSM2型纯水仪购于美国PALL公司;3111型二氧化碳培养箱购于美国FORMA公司;3K-15型台式高速冷冻离心机为德国Sigma公司产品,SpectraMax 190型酶标仪为美国MD公司产品,TS-1型脱色摇床购于海门其林贝尔仪器制造有限公司。
1.2 方法
1.2.1 大鼠MSCs的体外分离及培养 参照本课题组前期已建立的方法[11],采用全骨髓贴壁法培养大鼠骨髓MSCs,通过多次传代纯化细胞。
1.2.2 细胞分组 MSCs传代至P4代时,根据本课题组前期研究结果,将 MSCs分为 4组:DMOG 0μmol·L-1组(空白对照组)、DMOG 20μmol·L-1组、DMOG 40μmol·L-1组和 DMOG 80μmol·L-1组。DMOG以DMEM/F12培养基稀释,使各组中DMOG终浓度分别为 0、20、40、80μmol·L-1,用于后续生物学特性研究。
1.2.3 CCK-8法检测DMOG对MSCs增殖能力的影响 将P4代MSCs以1×104个/mL的细胞密度重悬于无FBS的DMEM/F12培养基中,接种于7块96孔板。次日,吸去各孔中细胞培养液,加入含不同浓度DMOG的DMEM/F12培养基,每组6个复孔。随机取1块96孔板,加入CCK-8试剂,孵育后酶标仪450nm测定吸光度值。此后连续6d,每天同一时间段重复上述操作。以未接种细胞的孔作为调零孔,以培养时间为横坐标,各组对应OD值为纵坐标,绘制细胞生长曲线。
1.2.4 流式细胞术分析DMOG对MSCs细胞周期的影响 各组MSCs经不同浓度DMOG处理24h后,收集细胞,加入预冷的70%乙醇,4℃冰箱固定过夜。次日,收集并洗涤细胞,每管细胞样品加入预制的碘化丙啶染液,37℃避光孵育。流式细胞仪在激发波长488nm处检测红色荧光,同时检测光散射情况。采用FlowJo软件进行细胞DNA含量分析和光散射分析。
1.2.5 Transwell法检测DMOG对MSCs迁移能力的影响 将P4代MSCs以1×105个/mL的细胞密度重悬于含不同浓度DMOG的培养基中,收集各组细胞悬液接种于Transwell小室上室,以含FBS的DMEM-LG培养基加入小室下层,培养15h后擦去小室上层未迁移的细胞。将上室的膜浸泡于4%多聚甲醛中固定,0.1%结晶紫染色,每组镜下随机选取9个视野拍照并计数。
1.2.6 诱导分化培养法研究DMOG对MSCs多向分化能力的影响 将P4代MSCs以1×105个/mL的细胞密度接种于含10%FBS、1%青霉素-链霉素的DMEM/F12培养基中,加入6孔板中培养。当细胞融合80%时,吸去孔内完全培养基,6孔板各孔分别更换为新鲜配制的含不同浓度DMOG的成骨、成脂和成软骨分化诱导培养基,培养至21d,再分别以硝酸银染色法、油红O染色法和甲苯胺蓝染色法鉴定结果。
成神经分化结果采用免疫荧光检测。先用含不同浓度DMOG的成神经分化预诱导培养基培养24h后,更换成神经分化诱导培养基继续培养6h,弃去诱导培养基,经4%多聚甲醛固定,0.3%Triton X-100浸泡,10%山羊血清封闭液室温封闭,加入小鼠抗大鼠Nestin或GFAP一抗4℃孵育过夜,二抗避光室温孵育,DAPI复染后,倒置相差荧光显微镜下观察荧光情况,选取任意9个视野拍照并进行阳性细胞计数,分析结果。
1.2.7 Real-time qPCR检测MSCs分化特异性基因的表达 诱导分化24、72、168h时分别收集各组细胞,依据Trizol操作说明,提取各组总RNA。按照Prime-ScriptTMRT Master Mix和SYBRPremix Ex TaqTMⅡ(TliRnaseH Plus)试剂盒的操作步骤,逆转录合成cDNA,然后进行目的基因的扩增,使用StepOne Software v2.2.2软件分析实验数据,采用2-△△Ct法计算基因相对表达量。引物由生工生物工程(上海)有限公司合成。见表1。

表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 应用SPSS 19.0统计软件进行统计学分析。计量资料以±s表示,多组比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 DMOG对MSCs增殖能力的影响 未经DMOG处理的MSCs,外形为长梭形,呈漩涡状生长;经不同浓度DMOG处理后的细胞,其形态均无明显改变。见图1。DMOG处理后,各浓度组细胞生长曲线均接近S型。接种后第1~3天为潜伏期,各组细胞增殖均较慢,从第3天开始各组细胞开始快速增殖,进入对数生长期,第6天后各组细胞增殖速度普遍减慢。潜伏期时,与 DMOG 0μmol·L-1比较,DMOG 20、40、80μmol·L-1组细胞增殖能力稍弱,差异有统计学意义(P<0.05);DMOG 20、40、80μmol·L-1这 3 组之间比较,差异无统计学意义(P>0.05)。进入对数生长期后,细胞增殖能力提高。第 6 天时,DMOG 20、40、80μmol·L-1组细胞增殖能力均显著高于DMOG 0μmol·L-1组,差异有统计学意义(P<0.01),其中 DMOG 40μmol·L-1组细胞增殖能力最强(P<0.01)。见图2。
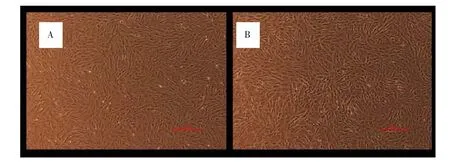
图1 MSCs的形态学观察(200×)Fig.1 Morphological observation of MSCs(200×)
2.2 DMOG对MSCs细胞周期的影响 流式细胞术检测结果显示,处理 24h后,与 DMOG 0μmol·L-1组比较,DMOG 20μmol·L-1组中 G0/G1期的细胞比例减少,而S期+G2/M期细胞比例增加,差异有统计学意义(P<0.05);DMOG 40、80μmol·L-1组 MSCs中 G0/G1期细胞比例均显著减少(P<0.01),而S期+G2/M期细胞比例均显著增加(P<0.01)。同时,DMOG 20、40、80μmol·L-1这 3 组间比较,G0/G1期和 S 期+G2/M 期细胞比例均无统计学差异(P>0.05)。见图3。
2.3 DMOG对MSCs迁移能力的影响 诱导培养15h后经结晶紫染色,显微镜视野中紫色多角形或长梭形的细胞即为迁移穿过Transwell小室上室膜的MSCs。与 DMOG 0μmol·L-1组比较,DMOG 20、40、80μmol·L-1组中MSCs细胞迁移数均增多,其中DMOG 20、80μmol·L-1组细胞迁移数目增加显著,差异有统计学意义(P<0.01),且该两组均高于 40μmol·L-1组,差异有统计学意义(P<0.01),但该两组间比较,差异无统计学意义(P>0.05)。见图4。

图2 DMOG对MSCs增殖能力的影响Fig.2 Effects of DMOG on proliferation of MSCs

图3 DMOG对MSCs细胞周期的影响Fig.3 Effects of DMOG on cell cycle of MSCs

图4 DMOG对MSCs迁移能力的影响Fig.4 Effects of DMOG on migration of MSCs
2.4 DMOG对MSCs多向分化能力的影响 硝酸银染色结果显示,各组细胞染色均呈阳性,有黑色钙盐着色,其中,DMOG 0μmol·L-1组黑色钙盐分泌集中且聚集在个别区域,DMOG 20μmol·L-1组 MSCs钙盐分泌较多且在孔板中分布均匀,DMOG 40、80μmol·L-1两组黑色钙盐分泌较为稀疏散在。见图5-1。甲苯胺蓝染色结果显示,各组细胞均呈阳性着色,其中,DMOG 20μmol·L-1组细胞呈明显异染性着色,即细胞外基质被染成紫色,细胞核呈深蓝色,表明诱导后细胞产生了软骨细胞基质糖胺聚糖。见图5-2。油红O染色结果显示,各组细胞中脂滴呈橘红色。见图5-3。免疫荧光结果显示,各组MSCs经诱导分化后,细胞表面Nestin阳性表达,GFAP阴性表达。见图5-4、5-5。提示DMOG处理后MSCs依然保留了成骨、成脂、成软骨和成神经分化能力。
2.5 DMOG对MSCs分化特异性基因表达的影响
2.5.1 成骨分化 成骨分化基因Bglap2检测结果显示,诱导分化 1d 时,与 DMOG 0μmol·L-1组比较,其余3组的Bglap2 mRNA相对表达量均无统计学差异(P>0.05);DMOG 20、40、80μmol·L-1这 3 组间比较,随着DMOC浓度增加,Bglap2 mRNA的相对表达量逐渐下降,但组间差异无统计学意义(P>0.05)。
诱导分化3d时,各组Bglap2 mRNA相对表达量均明显升高,与同时点DMOG 0μmol·L-1组比较,DMOG 20μmol·L-1组相对表达量显著升高(P<0.05);而其余两组差异无统计学意义(P>0.05)。DMOG 20、40、80μmol·L-1这 3组间比较,随着 DMOG 浓度增加,Bglap2 mRNA的相对表达量逐渐下降,其中DMOG 20μmol·L-1组 Bglap2 mRNA 的相对表达量显著高于 80μmol·L-1组(P<0.01)。
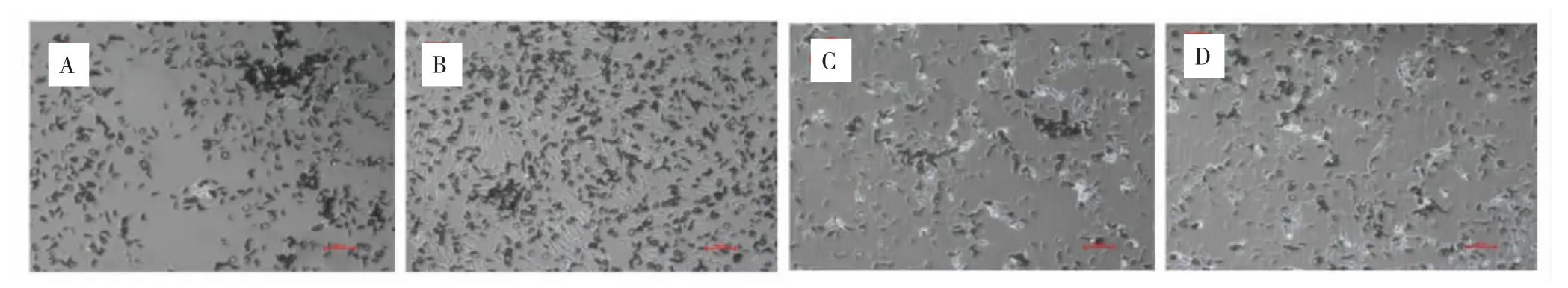
图5 -1 DMOG对MSCs成骨分化能力的影响(硝酸银染色,200×)Fig.5-1 Effects of DMOG on osteogenic differentiation of MSCs(silver nitrate stained,200×)

图5 -2 DMOG对MSCs成软骨分化能力的影响(甲苯胺蓝染色,200×)Fig.5-2 Effects of DMOG on chondrogenic differentiation of MSCs(toluidine blue stained,200×)

图5 -3 DMOG对MSCs成脂分化能力的影响(油红O染色,200×)Fig.5-3 Effects of DMOG on adipogenic differentiation of MSCs(oil red O stained,200×)

图5 -4 DMOG对MSCs成神经分化能力的影响(Nestin蛋白荧光染色,200×)Fig.5-4 Effects of DMOG on neural differentiation of MSCs(Nestin fluorescent stained,200×)

图5 -5 DMOG对MSCs成神经分化能力的影响(GFAP蛋白荧光染色,200×)Fig.5-5 Effects of DMOG on neural differentiation of MSCs(GFAP fluorescence stained,200×)
诱导分化7d时,各组细胞Bglap2 mRNA相对表达量均呈下降趋势。与同时点DMOG 0μmol·L-1组比较,DMOG 80μmol·L-1组 Bglap2 mRNA 相对表达量显著下降(P<0.05),而其余两组差异无统计学意义(P>0.05)。DMOG 20、40、80μmol·L-1这 3 组间比较,随着DMOG浓度增加,Bglap2 mRNA的相对表达量也逐渐下降,DMOG 20、40μmol·L-1这两组的 Bglap2 mRNA相对表达量均显著高于DMOG 80μmol·L-1组(P<0.01,P<0.05),但该两组间比较,差异无统计学意义(P>0.05)。说明随诱导时间增加,成骨诱导分化特异性基因Bglap2 mRNA相对表达量先升高后下降,诱导分化 3d时达到峰值;DMOG 20μmol·L-1处理对MSCs成骨分化能力具有显著促进作用,但随DMOG浓度增加,Bglap2 mRNA相对表达量逐渐降低。见图6A。
2.5.2 成脂分化 成脂分化基因Pparg2检测结果显示,诱导分化 1d时,与同时点 DMOG 0μmol·L-1组比较,DMOG 20μmol·L-1组 Pparg2 mRNA 相对表达量显著增高(P<0.05),其余两组差异无统计学意义(P>0.05)。DMOG 20、40、80μmol·L-1这 3 组间比较,DMOG 20、80μmol·L-1两组均显著高于 DMOG 40μmol·L-1组(P<0.01,P<0.05),但该两组间比较,差异无统计学意义(P>0.05)。
诱导分化3d时,各组Pparg2 mRNA相对表达量均呈现上升趋势。与同时点DMOG 0μmol·L-1组比较,其余3组 Pparg2 mRNA相对表达量均下降(P<0.05)。DMOG 20、40、80μmol·L-1这 3 组间比较,DMOG 20μmol·L-1组 Pparg2 mRNA 的相对表达量明显高于其余两组(P<0.05)。
诱导分化7d时,与同时点DMOG 0μmol·L-1组比较,DMOG 20、40、80μmol·L-1这 3 组 Pparg2 mRNA相对表达量均显著降低,差异均有统计学意义(P<0.01);而该3组之间比较,差异无统计学意义(P>0.05)。说明MSCs中Pparg2 mRNA相对表达量增加具有时间依赖性,而不同浓度(20、40、80μmol·L-1)DMOG作用后,MSCs内Pparg2 mRNA相对表达量增加随时间波动;且随诱导时间增加,DMOG对MSCs的成脂分化逐渐表现出一定的抑制作用。见图6B。
2.5.3 成软骨分化 成软骨分化基因CollagenⅡ检测结果显示,诱导分化1d时,与同时点DMOG 0μmol·L-1组比较,DMOG 20μmol·L-1组 Collagen ⅡmRNA相对表达量显著升高(P<0.01),其余两组CollagenⅡ mRNA相对表达量无统计学差异(P>0.05)。DMOG 20、40、80μmol·L-1这 3 组间比较,DMOG 20μmol·L-1组 Collagen Ⅱ mRNA 相对表达量最高,与另外两组比较,差异有统计学意义(P<0.05,P<0.01)。
诱导分化3d后,与同时点DMOG 0μmol·L-1组比较,其余3组mRNA相对表达量均增高,差异均有统计学意义(P<0.01)。DMOG 20、40、80μmol·L-1这 3组间比较,DMOG 80μmol·L-1组 Collagen Ⅱ mRNA相对表达量最高,与另外两组比较,差异有统计学意义(P<0.05,P<0.01)。
诱导分化7d时,与同时点DMOG 0μmol·L-1组比较,DMOG 20μmol·L-1组 Collagen Ⅱ mRNA 相对表达量显著增加(P<0.01),DMOG 40、80μmol·L-1组表达量则无统计学差异(P>0.05)。DMOG 20、40、80μmol·L-1这 3 组间比较,DMOG 20μmol·L-1组CollagenⅡ mRNA相对表达量最高,与另外两组比较,差异有统计学意义(P<0.05,P<0.01)。说明较低浓度(20、40μmol·L-1)DMOG 作用后,MSCs内 CollagenⅡ mRNA表达增加具有时间依赖性。见图6C。
2.5.4 成神经分化 成神经分化基因检测结果显示,诱导分化后各组MSCs均表达神经元样细胞标志性分子 Nestin。与同时点 DMOG 0μmol·L-1组比较,DMOG 20、40、80μmol·L-1这 3 组 Nestin 阳性细胞率均无统计学差异(P>0.05),提示DMOG处理对MSCs成神经分化能力无明显影响。见图6D。
3 讨论

图6 DMOG对MSCs分化特异性基因表达的影响Fig.6 Effects of DMOG on differentiation specific genes of MSCs
MSCs动员即采用动员措施或动员剂促使骨髓中MSCs释放并迁移到外周血,参与损伤修复、组织再生等[12]。在组织损伤的第一时间,给予一定的动员措施,可使MSCs在短时间内从骨髓跨越细胞及血管进入外周循环池,进一步迁移、归巢进入损伤部位,参与组织修复。正常生理状态下,人体外周循环中的MSCs含量极低[13]。研究发现,当机体在应激、损伤、烧伤等病理状态下,可发生MSCs内源性动员[14]。Rochefort等[15]发现慢性缺氧可使大鼠周围循环中MSCs数量显著增加。本课题组前期研究证实,基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)受体阻断剂AMD3100能提高外周血中的MSCs数量[12],DMOG也可以动员ICR小鼠和SD大鼠的MSCs进入外周血[10,16]。DMOG作为一种小分子酮戊二酸类似物,通过与内源性2-酮戊二酸竞争,从而抑制脯氨酸羟化酶,可作为高效安全的低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)稳定剂,且对动物及人类均无毒性[17]。Kelly等[18]研究发现,DMOG有利于心脑血管疾病的治疗。本课题组前期研究发现,DMOG对MSCs具有动员作用,其机制是通过稳定HIF-1表达,从而调控其下游血管内皮生长因子(vascular endothelial growth factor,VEGF)与 SDF-1α 的表达,从而发挥 MSCs动员作用[10]。
本研究以不同浓度DMOG处理MSCs,浓度20μmol·L-1时促进 MSCs增殖,浓度达到 40μmol·L-1时促进作用最明显。有研究发现,重组Wnt3a、胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)联合 AMD3100、氯化锂(lithium chloride,LiCl)等药物均可动员MSCs进入外周血,并促进其增殖和分化[19-21]。在本研究中,DMOG处理可以提高MSCs中S期+G2/M期的细胞比例,且3个浓度组间无统计学差异。研究报道指出,细胞周期的调控主要有外源性调控和内源性调控两种,外源性调控来源于细胞因子及一些外界刺激的作用[22]。笔者推测,DMOG作为一种外源性调控因素,其促进MSCs增殖可能是通过调控细胞周期相关蛋白的表达来实现的。
细胞迁移是细胞归巢的重要机制,也是影响干细胞动员的主要因素之一。本研究发现,DMOG可促进MSCs迁移能力,且 DMOG 20μmol·L-1时促迁移作用更为显著。Marchbank 等[23]研究发现 6.25~25μmol·L-1的DMOG能促进人HT29细胞的迁移能力,并呈剂量依赖性,其中25μmol·L-1促迁移活性最强;随着DMOG浓度增加,对细胞迁移则呈现抑制作用。
本研究研究发现,20~80μmol·L-1范围内,低浓度DMOG可上调成骨细胞特异性基因Bglap基因表达,高浓度则会下调Bglap基因表达。随诱导时间增加,DMOG对Pparg2的下调作用逐渐明显;而随给药浓度增加,Pparg2转录活性逐渐降低。随浓度增加,DMOG促进MSCs成软骨分化的作用在一定程度上减弱。DMOG处理后MSCs仍保留了原有的成神经分化能力,不同浓度的DMOG对MSCs成神经分化能力无显著促进或抑制作用。
有学者认为,MSCs成骨分化和成脂分化的过程不是彼此孤立的,而是存在着相互制约的动态平衡关系,诱导成骨分化过程中DMOG可能通过激活MSCs中Wnt/β-catenin信号通路从而抑制其成脂分化过程,进而下调成脂分化转录因子Pparg2的表达[24-26]。许多调控机制对两者也具有正反向调控作用[27-28]。Taipaleenmaki等[29]认为易于成骨的MSCs亚群Wnt信号基因高表达,而易于发生成脂分化的MSCs亚群则高表达Wnt通路抑制因子分泌型卷曲相关蛋白-1(secreted frizzled-related proteins,sFRP-1)。而Vanella等[30]研究发现,众多调节因子可使MSCs由成骨分化链转化为脂肪分化链,进而抑制其成骨分化。本课题组前期研究证实Wnt/β-catenin信号通路对大鼠MSCs向神经元样细胞分化有重要调节作用[31]。因此,DMOG干预后,MSCs的成骨分化、成脂分化以及成神经分化之间是否通过Wnt/β-catenin信号通路相互影响尚有待于进一步研究。
综上所述,不同浓度DMOG处理后,可显著提高MSCs增殖、迁移能力,但对其多项分化能力产生不同的影响。其中20μmol·L-1DMOG可促进MSCs成骨和成软骨分化能力,抑制其成脂分化能力,对其成神经分化能力无明显影响。

