白及对阿司匹林致大鼠胃溃疡的治疗作用研究
高俊丁兴红丁志山范永升
1.浙江中医药大学基础医学院 杭州 310053 2.浙江中医药大学医学技术学院
阿司匹林(aspirin)是常用的解热镇痛消炎药[1],主要通过抑制环氧化酶(cyclooxygenase,COX)发挥作用,长期使用阿司匹林会引起胃肠道不良反应[2],严重者引起胃溃疡及胃出血[3]。目前,针对阿司匹林引起的胃溃疡,临床上主要是以奥美拉唑等抗溃疡药物治疗,但是这些药物可能引起低镁血症[4]、皮肤损害[5]以及神经内分泌系统的不良反应;此外,临床上使用选择性COX-2抑制剂来代替阿司匹林,但是选择性COX-2抑制剂仍然可能导致消化道损伤[6],还可能造成血栓形成[7]、肾毒性[8-9]、肝脏不良反应[10]等。研究能够减轻阿司匹林所致的胃损伤且不良作用少的药物具有重要意义。
白及为兰科植物白及[Bletilla striata(Thunb.)Reichb.f.]的干燥块茎,味苦、甘、涩,性微寒,归肺、胃、肝经,具有收敛止血、消肿生肌的功效[11]。研究发现白及可促进胃上皮细胞更新,增强防御功能[12],但对其具体影响指标未做深入研究。本实验通过观察白及对阿司匹林诱导的大鼠胃溃疡的影响,进一步探讨白及的作用机制。
1 材料和方法
1.1 实验动物 SPF级成年雄性Wistar大鼠48只,体质量(200±20)g,由上海斯莱克实验动物有限公司提供[实验动物生产许可证号:SCXK(沪)2012-0002]。大鼠饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2018-0012],自由饮食饮水,适应性饲养1周后开始实验。
1.2 药品、试剂及仪器 白及饮片购于浙江天道医药有限公司(批号:170901);阿司匹林购于拜耳医药保健有限公司(100mg/片,批号:J20130078);奥美拉唑购于康恩贝生物制药有限公司(20mg/粒,批号:H19991118);大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)ELISA检测试剂盒购于达科为生物技术有限公司(批号:DKW12-3720-048、12-3060-096);胃黏膜前列腺素E2(prostaglandin E2,PGE2)、内皮素(endothelin,ET)ELISA检测试剂盒购于江苏酶标生物科技有限公司(批号:MB-1609A、MB-6634A);鼠抗 COX-1单克隆抗体、羊抗COX-2多克隆抗体、鼠抗β-actin单克隆抗体、山羊抗小鼠IgG二抗、驴抗山羊IgG二抗均购于 Abcam 公司(批号:ab695、ab23672、ab8226、ab205719、ab205723);PCR逆转录试剂盒、荧光定量试剂盒为宝生物工程有限公司产品(批号:RR036A、RR820A)。Multiskan MK3酶标仪购于Thermo公司;iCycler iQ5实时定量PCR仪为美国Bio-Rad公司产品。
1.3 动物建模及分组 48只雄性Wistar大鼠按照随机区组设计法分为正常组、模型组、白及高、中、低剂量组、阳性对照组,每组8只。根据汤宏斌等[13]所著的《实验动物学》中成人与大鼠剂量换算,得出大鼠用白及剂量为315mg·kg-1,设为中剂量,取其2倍为高剂量,0.5倍为低剂量。除正常组予0.9%氯化钠溶液灌胃外,余各组予阿司匹林200mg·kg-1灌胃造模,共8周。8周后,阳性对照组予奥美拉唑15mg·kg-1灌胃,白及高、中、低剂量组分别予 630、315、157.5mg·kg-1白及混悬液灌胃,正常组和模型组继续予0.9%氯化钠溶液灌胃,灌胃体积均为 10mL·kg-1,1 次/d,共 4 周。4 周后取大鼠眼眶血和胃组织进行相关指标检测。
1.4 实验方法
1.4.1 血清炎性指标检测 各组大鼠末次灌胃后第2天眼眶取血,4 000r/min离心20min分离血清,ELISA法检测血清TNF-α、IL-6的表达,具体操作按说明书进行。
1.4.2 胃黏膜PGE2、ET表达水平检测 处死大鼠并将胃摘除,分离胃组织,将胃组织在冰面上展平,用盖玻片刮取胃黏膜,迅速放入液氮冷冻。取50mg胃黏膜加入9倍体积的0.9%氯化钠溶液制备组织匀浆,4℃下2 500r/min离心10min。分离上清液,ELISA法检测PGE2、ET的表达,具体操作按说明书进行。
1.4.3 胃黏膜COX-1、COX-2蛋白表达Western blot检测 取冷冻的胃黏膜50mg,放入预冷的玻璃匀浆器中,加入0.5mL细胞裂解液,冰上研磨。组织匀浆4℃下12 000r/min离心20min,收集上清液,-80℃无菌保存。按BCA法测定各组蛋白浓度。各组取等量蛋白经10%SDS-PAGE电泳后转膜2h,5%脱脂奶粉摇床封闭2h,一抗4℃孵育过夜,TBST洗膜10min共3次,二抗孵育2h,TBST洗膜10min共3次,凝胶成像系统拍照后以Image J软件测定目的条带灰度值,与内参β-actin灰度值比较,计算蛋白相对表达量。
1.4.4 COX-1、COX-2 mRNA表达荧光定量PCR检测 取冷冻的胃黏膜组织100mg,用Trizol提取总RNA,按试剂盒方法进行实时荧光定量PCR检测。反应条件为 95℃ 30s,95℃ 5s,60℃ 30s,共 40 个循环,50℃ 30s。采用β-actin为内参,计算各组中目的基因相对于内参基因的表达量。引物由生工生物工程(上海)股份有限公司合成。序列见表1。
1.4.5 胃组织病理学观察 胃组织平铺于台上,大体观察病理改变,按Guth等[14]研究的方法计算溃疡指数;取胃组织,多聚甲醛固定24h,经梯度乙醇脱水、二甲苯透明、浸蜡等过程制成蜡块,切片后HE染色,100倍镜下观察。

表1 引物序列Tab.1 Primer squences
1.5 统计学分析 采用SPSS 19.0统计软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠血清TNF-α、IL-6表达比较 与正常组比较,模型组与各药物组大鼠血清TNF-α、IL-6表达均增加(P<0.01,P<0.05)。与模型组比较,阳性对照组大鼠血清 TNF-α、IL-6表达降低(P<0.01),白及高、中、低剂量组大鼠血清TNF-α、IL-6表达均降低(P<0.01,P<0.05)。与白及低剂量组比较,白及高、中剂量组大鼠血清TNF-α、IL-6表达均降低(P<0.01,P<0.05)。见表 2。
2.2 各组大鼠胃黏膜PGE2、ET表达比较 与正常组比较,模型组大鼠和白及各剂量组大鼠胃黏膜组织PGE2表达减少(P<0.01,P<0.05),ET 表达增加(P<0.01,P<0.05),阳性对照组 PGE2表达减少(P<0.05),ET表达增加,但差异无统计学意义(P>0.05)。与模型组比较,阳性对照组大鼠胃黏膜组织PGE2表达增加,但差异无统计学意义(P>0.05),ET表达减少(P<0.05),白及高、中、低剂量组大鼠胃黏膜组织PGE2表达增加(P<0.01,P<0.05),ET 表达减少(P<0.01,P<0.05)。与白及低剂量组比较,白及高、中剂量组大鼠胃黏膜组织 PGE2表达增加(P<0.01,P<0.05),ET 表达减少(P<0.05)。见表 3。
表 2 各组大鼠血清 TNF-α、IL-6 表达比较(±s,pg·mL-1)Tab.2 Comparison of expression of TNF-α and IL-6 in serum of each group(±s,pg·mL-1)
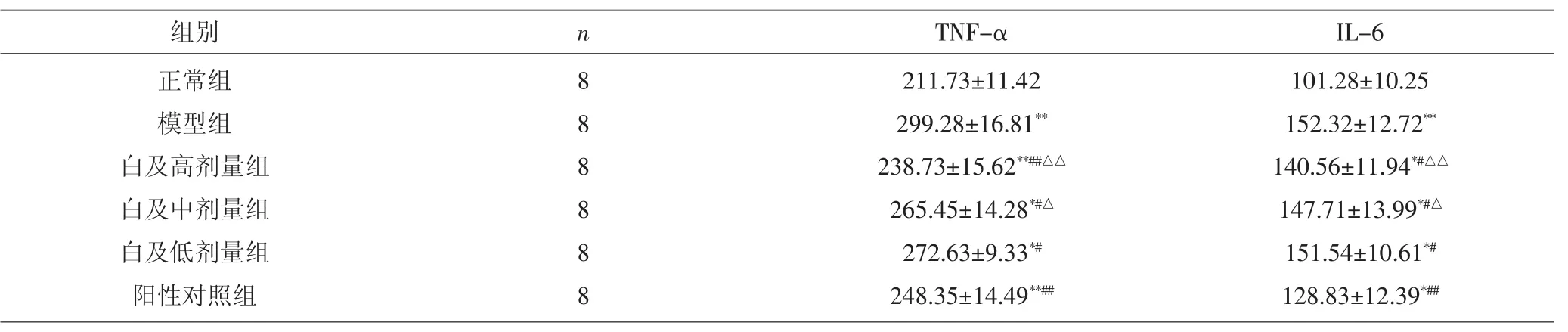
表 2 各组大鼠血清 TNF-α、IL-6 表达比较(±s,pg·mL-1)Tab.2 Comparison of expression of TNF-α and IL-6 in serum of each group(±s,pg·mL-1)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与白及低剂量组比较,△P<0.05,△△P<0.01Note:Compared with normal group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01;compared with Bletilla striata low dose group,ΔP<0.05,ΔΔP<0.01
组别 n TNF-α IL-6正常组模型组白及高剂量组白及中剂量组白及低剂量组阳性对照组8 8 8 8 8 8 211.73±11.42 299.28±16.81**238.73±15.62**##△△265.45±14.28*#△272.63±9.33*#248.35±14.49**##101.28±10.25 152.32±12.72**140.56±11.94*#△△147.71±13.99*#△151.54±10.61*#128.83±12.39*##
2.3 各组大鼠胃黏膜COX-1、COX-2蛋白表达比较
表3 各组大鼠胃黏膜PGE2、ET表达比较(±s)Tab.3 Comparison of expression of PGE2and ET in gastric mucosa of each group(±s)

表3 各组大鼠胃黏膜PGE2、ET表达比较(±s)Tab.3 Comparison of expression of PGE2and ET in gastric mucosa of each group(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与白及低剂量组比较,△P<0.05,△△P<0.01Note:Compared with normal group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01;compared with Bletilla striata low dose group,ΔP<0.05,ΔΔP<0.01
组别nPGE2(ng·L-1)ET(μg·L-1)正常组模型组白及高剂量组白及中剂量组白及低剂量组阳性对照组8 8 8 8 8 8 476.95±10.74 244.98±20.53**373.42±21.96*##△△307.63±17.55*##△285.41±19.63*#286.19±25.77*73.36±9.21 101.59±10.48**82.66±5.99**##△89.86±12.37*##△95.15±11.65*#90.47±9.14*#
与正常组比较,模型组与各药物组大鼠胃黏膜组织COX-1蛋白表达减少(P<0.01,P<0.05)、COX-2蛋白表达增加(P<0.05)。与模型组比较,阳性对照组大鼠胃黏膜组织COX-1蛋白表达增加(P<0.01)、COX-2蛋白表达减少(P<0.05),白及高、中、低剂量组大鼠胃黏膜组织 COX-1 蛋白表达增加(P<0.01,P<0.05)、COX-2蛋白表达减少(P<0.01,P<0.05)。与白及低剂量组比较,白及高、中剂量组大鼠胃黏膜组织COX-1蛋白表达增加(P<0.05)、COX-2蛋白表达减少(P<0.05)。见图1及表4。

图1 各组大鼠胃黏膜COX-1、COX-2蛋白表达比较Fig.1 Comparison of expression of COX-1 and COX-2 protein in gastric mucosa of each group
表4 各组大鼠胃黏膜COX-1、COX-2蛋白表达比较(±s)Tab.4 Comparison of expression of COX-1 and COX-2 protein in gastric mucosa of each group(±s)

表4 各组大鼠胃黏膜COX-1、COX-2蛋白表达比较(±s)Tab.4 Comparison of expression of COX-1 and COX-2 protein in gastric mucosa of each group(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与白及低剂量组比较,△P<0.05Note:Compared with normal group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01;compared with Bletilla striata low dose group,ΔP<0.05
组别 n COX-1/β-actin COX-2/β-actin正常组模型组白及高剂量组白及中剂量组白及低剂量组阳性对照组8 8 8 8 8 8 0.98±0.11 0.42±0.15**0.85±0.09*##△0.61±0.05*##△0.55±0.14*#0.84±0.06*##0.12±0.06 0.42±0.08*0.31±0.10*##△0.34±0.05*#△0.40±0.08*#0.37±0.04*#
2.4 各组大鼠胃黏膜COX-1、COX-2基因表达比较与正常组比较,模型组与各药物组大鼠胃黏膜组织COX-1基因表达减少(P<0.01,P<0.05)、COX-2 基因表达增加(P<0.01,P<0.05)。与模型组比较,阳性对照组大鼠胃黏膜组织COX-1基因表达增加(P<0.01)、COX-2基因表达减少(P<0.05),白及高、中、低剂量组大鼠胃黏膜组织 COX-1基因表达增加(P<0.01,P<0.05)、COX-2基因表达减少(P<0.01,P<0.05)。与白及低剂量组比较,白及高、中剂量组大鼠胃黏膜组织COX-1基因表达增加(P<0.01,P<0.05),COX-2 基因表达减低(P<0.01)。见表 5。
2.5 各组大鼠胃黏膜病理学观察
2.5.1 各组大鼠胃黏膜溃疡指数比较 与正常组比较,模型组与各药物组大鼠溃疡指数增加(P<0.01,P<0.05);与模型组比较,阳性对照组大鼠溃疡指数降低(P<0.01),白及高、中、低剂量组大鼠溃疡指数降低(P<0.01,P<0.05);与白及低剂量组比较,白及高、中剂量组大鼠溃疡指数降低(P<0.05)。见表6。
表5 各组大鼠胃黏膜COX-1、COX-2基因表达比较(±s)Tab.5 Comparison of expression of COX-1 and COX-2 gene in gastric mucosa of each group(±s)

表5 各组大鼠胃黏膜COX-1、COX-2基因表达比较(±s)Tab.5 Comparison of expression of COX-1 and COX-2 gene in gastric mucosa of each group(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与白及低剂量组比较,△P<0.05,△△P<0.01Note:Compared with normal group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01;compared with Bletilla striata low dose group,△P<0.05,△△P<0.01
组别 n COX-1/β-actin COX-2/β-actin正常组模型组白及高剂量组白及中剂量组白及低剂量组阳性对照组8 8 8 8 8 8 0.65±0.09 0.38±0.05**0.51±0.06**##△△0.46±0.10**#△0.40±0.08*#0.50±0.11*##0.04±0.02 0.26±0.07**0.21±0.10*##△△0.23±0.09*#△△0.25±0.11*#0.25±0.03*#
表6 各组大鼠胃黏膜溃疡指数比较(±s)Tab.6 Comparison of ulcer index in gastric mucosa of each group(±s)

表6 各组大鼠胃黏膜溃疡指数比较(±s)Tab.6 Comparison of ulcer index in gastric mucosa of each group(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与白及低剂量组比较,△P<0.05Note:Compared with normal group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01;compared with Bletilla striata low dose group,△P<0.05
组别n 溃疡指数正常组模型组白及高剂量组白及中剂量组白及低剂量组阳性对照组8 8 8 8 8 8 0.00±0.00 19.75±3.96**10.47±3.73*##△13.55±8.61*##△19.21±7.45**#8.38±2.20*##
2.5.2 各组大鼠胃组织病理改变比较 正常组大鼠胃黏膜结构完整,上皮细胞呈单层柱状排列整齐,基本未见缺损、脱落,固有层未见炎性细胞浸润,腺体形状规整;模型组大鼠胃黏膜变薄,病灶处上皮细胞脱落,出现缺损,黏膜固有腺体数量明显减少,排列稀疏紊乱,有大量炎性细胞浸润,黏膜层出血,黏膜下层水肿;白及高、中剂量组大鼠胃黏膜变薄,上皮结构修复,少量缺损、脱落,黏膜固有腺体增生较多,排列较整齐,少量炎性细胞浸润;白及低剂量组大鼠胃黏膜变薄,病灶处上皮细胞脱落,出现缺损,黏膜固有腺体少量增生,可见炎性细胞浸润,黏膜层出血;阳性对照组大鼠胃黏膜结构基本完整,上皮结构修复,黏膜固有腺体增生数量较多,排列整齐,少量炎性细胞浸润,黏膜下层水肿。见图2。

图2 各组大鼠胃体病理改变(HE染色,100×)Fig.2 Pathological changes of gastric body in each group(HE stained,100×)
3 讨论
阿司匹林进入机体后同时抑制COX-1和COX-2的表达,发挥抗炎镇痛的药效[15-16];但是其对于COX-1和COX-2的非选择性抑制使得PGE2生成减少、ET生成增加。PGE2生成减少,导致对细胞的保护作用被削弱;ET则是体内强烈收缩血管的物质[17],其表达增加使胃黏膜微血管收缩加剧,黏膜血供减少,两方面因素共同致使胃溃疡形成。TNF-α和IL-6作为重要的炎性细胞因子,参与胃黏膜的受损过程[18],是指示溃疡形成的较直观指标。有研究指出阿司匹林能够诱导TNF-α和白细胞介素分泌增加,促使胃溃疡发生[17]。本实验通过给予大鼠灌胃阿司匹林,成功构建胃溃疡模型。研究结果显示,模型组大鼠血清TNF-α、IL-6水平增高,胃黏膜组织COX-1表达减少,COX-2的表达增加,PGE2生成减少、ET生成增加。阿司匹林造模后大鼠胃黏膜COX-2的表达增加,探究其原因,有文献报道COX-2的启动子区域含有NF-κB结合位点,NF-κB 调控的靶基因包括 COX-2[19];TNF-α作为重要促炎因子,能通过与其受体的结合激活NF-κB信号通路[20]。笔者推断,阿司匹林诱导TNF-α表达增加,可能是通过NF-κB信号通路诱导了胃黏膜COX-2表达的上升,这可能是阿司匹林造成胃溃疡后胃黏膜组织COX-2表达增加的机制之一,有待进一步研究证实。
白及具有良好的止血作用,是治疗胃溃疡的常用药[21]。《神农本草经》中记载白及“主痈肿、恶疮、败疽,伤阴死肌,胃中邪气、贼风鬼击,痱缓不收”[22]。现代临床上多用白及粉治疗胃溃疡,效果明显[23]。本研究对阿司匹林诱导的胃溃疡大鼠分别给予西药奥美拉唑及中药白及治疗,结果显示,奥美拉唑及高剂量白及均有良好的治疗胃溃疡作用。奥美拉唑为质子泵抑制剂,本研究数据显示其对于COX-1、COX-2也具有调节作用,具体调节机制目前尚未见报道,奥美拉唑是否也通过调节COX发挥抗溃疡作用,有待进一步研究证实。
综上所述,本研究提示中药白及能够显著减少血清中的细胞因子TNF-α和IL-6表达,调节大鼠胃黏膜COX-1、COX-2表达水平,促使PGE2生成增加、ET生成减少,从而治疗胃溃疡。以上研究结果表明白及适用于阿司匹林诱导的胃溃疡的治疗,为临床上用药的选择提供了参考。

