雷公藤多苷不同给药方式对雌性大鼠肝功能及生殖功能影响的比较研究
徐丽萍张蕾宋欣伟
1.浙江中医药大学附属第一医院 杭州 310006 2.杭州市第七人民医院
雷公藤(Tripterygium Wilfordii,TW)系卫矛科雷公藤属木质藤本植物,具有强效的抗炎及免疫调节等作用,其有效活性提取物雷公藤多苷(Tripterygium glycosides,TG)已广泛应用于各种风湿免疫性疾病的治疗,因其疗效确切而逐渐受到国际医学同行的关注和认可,但不良反应在很大程度上限制了TG的临床应用。因此,如何在保证疗效的前提下减低TG的不良反应成了风湿免疫性疾病研究的热点。研究表明,TG不良反应的产生与给药剂量及给药时间密切相关,且临床多以肝功能损害、性腺抑制最为多见[1]。鉴于此,本课题组成员尝试在保证疗效的基础上改进给药时间,以间歇给药的方式替代连续给药,同时摸索最佳的间歇给药方案,以减少不良反应。为了进一步明确间歇给药方案在减少药物性肝功能损害和性腺抑制方面的优势,笔者在动物试验中将间歇给药方法与传统的连续给药方法进行比较,观察不同给药方式对SD大鼠肝功能及生殖功能的影响。
1 材料和方法
1.1 实验动物与分组 清洁级8周龄雌性SD大鼠60只,体质量222~258g,由浙江中医药大学实验动物中心提供[实验动物使用许可证号:SYXK(浙)2018-0012]。所有大鼠均饲养于23~25℃的室内,光照12h,标准饮食、自由饮水,适应性喂养2~3d后用于实验。将所有大鼠按随机数字表法分为间歇给药组、连续给药组、空白对照组,每组各20只。
1.2 试剂与仪器 TG片由浙江省普洛康裕药业有限公司生产(批号:Z33020778)。大鼠卵泡刺激素(follicle-stimulating hormone,FSH)ELISA 试剂盒、大鼠黄体生成素(luteinizing hormone,LH)ELISA试剂盒均购于杭州达文生物工程公司(批号:YKE20084、YKE20085)。生化分析仪、标准规格酶标仪均为美国GE公司产品。CL31R低温高速离心机为Thermo Forma公司产品,以上仪器均由浙江中医药大学动物实验中心提供。
1.3 实验方法
1.3.1 灌胃药物制备及给药 将TG片研末,以0.9%氯化钠溶液配成浓度为2mg·mL-1的混悬液,给药剂量根据魏伟等[2]主编的《药理实验方法学》中人与动物按体表面积折算的等效剂量比值表计算。各组大鼠按以下方法灌胃:间歇给药组以20mg/kg·d的TG灌胃给药4d,其后3d改以等容量的0.9%氯化钠溶液灌胃;连续给药组以20mg/kg·d的TG每天灌胃给药;空白对照组大鼠连续每天予等容量0.9%氯化钠溶液灌胃。
1.3.2 实验指标检测 间歇给药组、连续给药组大鼠药物累积剂量达到800mg·kg-1时,各组分别随机处死10只大鼠;药物累积剂量达到1 400mg·kg-1时,各组分别处死余下大鼠,检测以下指标。
1.3.2.1 大鼠动情周期观察 处死大鼠前10d,每日上午9~11时行阴道细胞学涂片,以观察给药后大鼠动情周期变化。以0.9%氯化钠溶液浸湿的棉签轻轻插入大鼠阴道内,旋转后取出棉签并涂片,95%乙醇固定20min后巴氏染色,光镜下观察脱落细胞。动情周期持续时间4~5d,根据脱落细胞的变化特点来划分动情周期的各阶段[3]:动情间期(65.72±10.69)h,阴道细胞学涂片以白细胞为主;动情前期(18.45±2.14)h,涂片以有核上皮细胞为主;动情期(12.24±3.36)h,以角化上皮细胞为主;动情后期(14.12±3.78)h,涂片上兼见角化上皮细胞和白细胞[4]。阴道涂片细胞学无典型改变者即为动情周期消失。
1.3.2.2 大鼠血清生化指标检测 大鼠以10%水合氯醛腹腔注射麻醉,腹主动脉取血,室温下放置1h,2 000r/min离心10min,分离血清后-4℃保存,择期以ELISA法测定血清FSH与LH水平,生化分析仪检测谷丙转氨酶(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)水平。
1.3.2.3 大鼠子宫、卵巢形态观察 大鼠以10%水合氯醛腹腔注射麻醉后,天平称取体质量。开腹取子宫和卵巢,以0.9%氯化钠溶液冲洗,冲洗后用滤纸吸去多余水分,电子天平精确称重后计算子宫、卵巢指数。卵巢指数=卵巢湿重(mg)/体质量(g)×100%;子宫指数=子宫湿重(mg)/体重(g)×100%。
1.4 统计学分析 应用SPSS 21.0统计软件进行统计学分析。计量资料以±s表示,组间比较采用配对样本t检验;计数资料组间比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝功能比较 TG累积剂量达到800mg·kg-1时,间歇给药组、连续给药组大鼠ALT、AST水平均高于同时期空白对照组,差异有统计学意义(P<0.05),但两给药组之间差异无统计学意义(P>0.05)。当累积剂量达1 400mg·kg-1时,间歇给药组、连续给药组SD大鼠的ALT、AST水平均较同时期空白对照组显著升高(P<0.01),而且间歇给药组 ALT、AST 水平均低于连续给药组(P<0.05)。见表1。
2.2 TG对大鼠生殖功能的影响
表 1 各组大鼠肝功能比较(±s,U·L-1)Tab.1 Comparison of liver function in each group(±s,U·L-1)
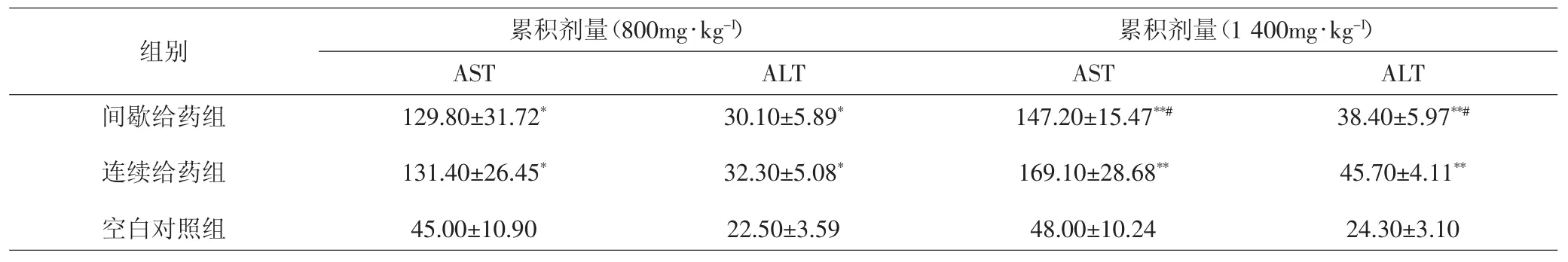
表 1 各组大鼠肝功能比较(±s,U·L-1)Tab.1 Comparison of liver function in each group(±s,U·L-1)
注:与空白对照组比较,*P<0.05,**P<0.01;与连续给药组比较,#P<0.05Note:Compared with blank control group,*P<0.05,**P<0.01;compared with continuous administration group,#P<0.05
组别 累积剂量(800mg·kg-1) 累积剂量(1 400mg·kg-1)AST ALT AST ALT间歇给药组连续给药组空白对照组129.80±31.72*131.40±26.45*45.00±10.90 30.10±5.89*32.30±5.08*22.50±3.59 147.20±15.47**#169.10±28.68**48.00±10.24 38.40±5.97**#45.70±4.11**24.30±3.10
2.2.1 各组大鼠动情周期变化比较 TG累积剂量达到800mg·kg-1时,两给药组均有部分大鼠出现动情周期延长,与空白对照组比较,差异有统计学意义(P<0.05);间歇给药组动情周期延长大鼠的比例低于连续给药组,差异有统计学意义(P<0.05),但两组均未出现动情周期消失大鼠。累积剂量达到1 400mg·kg-1时,两给药组大鼠动情周期均延长,两组均有部分大鼠动情周期消失,与空白对照组比较,差异有统计学意义(P<0.01),间歇给药组动情延长及动情周期消失大鼠比例显著低于连续给药组,差异有统计学意义(P<0.05)。见表 2。
2.2.2 各组大鼠卵巢、子宫指数比较 TG累积剂量达到800mg·kg-1时,间歇给药组与连续给药组大鼠卵巢、子宫指数均低于空白对照组,差异有统计学意义(P<0.05),但两给药组间差异无统计学意义(P>0.05)。累积剂量达到 1 400mg·kg-1时,间歇给药组与连续给药组大鼠卵巢、子宫指数均明显低于空白对照组(P<0.01),而且间歇给药组卵巢、子宫指数高于连续给药组,差异有统计学意义(P<0.01)。见表3。
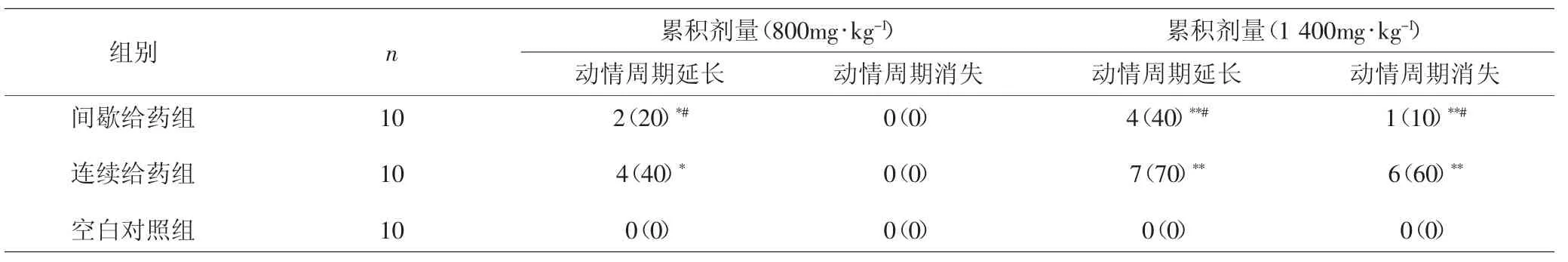
表2 各组大鼠动情周期变化比较[n(%)]Tab.2 Comparison of estrous cycle changes in each group[n(%)]
2.2.3 各组大鼠生殖激素水平比较 TG累积剂量达到800mg·kg-1时,各组间FSH、LH水平差异无统计学意义(P>0.05);但间歇给药组与连续给药组FSH/LH值均高于空白对照组,差异有统计学意义(P<0.05),两给药组间比较,间歇给药组性腺抑制情况较轻,FSH/LH值低于连续给药组(P<0.05)。累积剂量达到1 400mg·kg-1时,与空白对照组比较,间歇给药组大鼠FSH、LH水平差异仍无统计学意义(P>0.05),但以上两组大鼠FSH、LH水平均低于连续给药组(P<0.05);此时两给药组大鼠FSH/LH值均较前进一步升高,均高于空白对照组(P<0.05);而间歇给药组FSH/LH值仍低于连续给药组(P<0.01)。见表4。
表 3 各组大鼠卵巢、子宫指数比较(±s,mg·g-1)Tab.3 Comparison of ovarian and uterus indexes in each group(±s,mg·g-1)

表 3 各组大鼠卵巢、子宫指数比较(±s,mg·g-1)Tab.3 Comparison of ovarian and uterus indexes in each group(±s,mg·g-1)
注:与空白对照组比较,*P<0.05,**P<0.01;与连续给药组比较,##P<0.01Note:Compared with blank control group,*P<0.05,**P<0.01;compared with continuous administration group,##P<0.01
组别 累积剂量(800mg·kg-1) 累积剂量(1 400mg·kg-1)卵巢指数 子宫指数 卵巢指数 子宫指数间歇给药组连续给药组空白对照组0.4080±0.039*0.3498±0.047*0.4475±0.055 1.2035±0.2408*1.0296±0.1342*1.4717±0.3141 0.4176±0.0510**##0.3753±0.0575**0.5066±0.0650 1.6060±0.4320**##1.1134±0.1760**1.7680±0.5463
表 4 各组大鼠 FSH、LH 水平比较(±s,mU·mL-1)Tab.4 Comparison of FSH and LH in each group(±s,mU·mL-1)

表 4 各组大鼠 FSH、LH 水平比较(±s,mU·mL-1)Tab.4 Comparison of FSH and LH in each group(±s,mU·mL-1)
注:与空白对照组比较,*P<0.05;与连续给药组比较,#P<0.05,##P<0.01Note:Compared with blank control group,*P<0.05;compared with continuous administration group,#P<0.05,##P<0.01
组别 累积剂量(800mg·kg-1) 累积剂量(1 400mg·kg-1)FSH LH FSH/LH FSH LH FSH/LH间歇给药组连续给药组空白对照组1.12±0.18 1.15±0.11 1.01±0.28 2.77±0.13 2.84±0.22 2.76±0.12 0.39±0.02*#0.41±0.03*0.37±0.03 1.17±0.17#1.36±0.22 1.14±0.22#2.94±0.43#3.07±0.29 2.91±0.09#0.41±0.03*##0.44±0.06*0.38±0.04
3 讨论
自20世纪60年代至今,研究证实TG能够治疗多种自身免疫性疾病,并具有起效快、疗效好的特点,除了自身免疫性疾病外,TG还可用于皮肤病、血液病、肾脏病等疾病的治疗,均有确切可观的疗效[5]。不仅如此,近年来TG逐渐引起了国外学者的注意。2009年Goldbach-Mansky等[6]报道了类风湿关节炎(rheumatoid arthritis,RA)的多中心随机临床试验结果,TG治疗组患者的美国风湿病学会(American College of Rheumatology,ACR)20%缓解率优于柳氮磺吡啶组。2015年北京协和医院张烜教授联合国内9家风湿病研究中心的研究发现,在RA患者中单用TG的治疗效果不亚于单用甲氨蝶呤,而且TG与甲氨蝶呤联合使用的疗效显著优于单用甲氨蝶呤[7-8]。其疗效受到包括美国梅奥诊所首席风湿病学专家Mattson等诸多学者的高度重视,但其诸多不良反应,如胃肠道反应、肝酶升高、白细胞下降以及性腺损害(主要表现为月经紊乱、精子减少)等,在很大程度上限制了TG的进一步广泛应用。罗岚等[9]研究揭示,TG的肝毒性作用主要表现在胆汁淤积、氧化应激、炎症反应3个方面,并认为这可能与其肝脏蓄积有关。
本课题组前期进行了大量临床观察,发现临床上采用TG间歇给药方案治疗RA有着不亚于连续给药方案的疗效,而且能一定程度地减少TG的不良反应和耐药的发生,但不同给药方式对TG疗效及不良反应的影响目前尚无系统研究报道。而本课题组经过长期临床研究发现,按照说明书建议的每日最大剂量(60mg/d,分3次给药),每周用药4d、停3d的间歇给药方案能最大程度地保证疗效,同时可以减少肝脏损害、性腺抑制的发生。本研究以等效剂量TG进行了动物实验,证实当累积剂量达到800mg·kg-1和1 400mg·kg-1时,间歇给药方案能够显著降低药物性肝脏损害以及性腺抑制的发生,但是否还有更佳的间歇给药方案,目前正着手开展进一步的实验及临床研究。
目前,各类相关研究对提高TG疗效及减少肝脏损害的内容较多,而其对性腺损害的影响研究较少。本实验在研究间歇给药方式对性腺损害的影响时,采用了目前公认准确可行的动情周期、子宫及卵巢指数、性激素水平作为性腺功能的评判指标。结果显示,TG能使各组大鼠动情周期紊乱,主要表现为动情周期延长;随着剂量增加,连续给药组部分大鼠动情周期消失,比例高达60%。说明TG连续给药对大鼠的动情周期的影响更大,随着累积剂量的增加,两种不同给药方式的影响差异更显著。此外,本实验研究显示同等剂量下,间歇给药对子宫、卵巢发育的影响更小,可能与持续给药更容易造成大鼠体内生殖激素水平降低及失调有关,干扰卵泡发育成熟所需的激素微环境,从而影响子宫、卵巢的发育。临床上可以配伍益肾填精类中药,以减少TG长期使用对性腺的损害,但通过间歇给药方式来改善尚未见于报道,本研究结果为该给药方案的可行性提供了一定的理论依据。
综上所述,本研究证实同等剂量下,TG间歇给药对动物肝功能和性腺的影响小于连续给药。但本研究设计较为简单,未深入研究相关机制,今后的研究将在评估疗效的同时,进一步对不同给药方式的具体作用机制进行探讨。

