TGF-β1调控肺泡上皮细胞PI3K亚基构成变化的研究
董年 宋晨剑 董莉 陈成水
弥漫性肺泡损伤是肺损伤气血屏障破坏的重要病理特征,失控的炎症瀑布反应是肺泡损伤的关键环节[1-2]。异常的信号转导介导了失控的炎症瀑布反应,包括调节基团的表达突变和蛋白激酶的持续活化,其中异常磷脂酰肌醇 3-激酶(phosphoinositide 3-kinase,PI3K)信号转导介导了肺损伤炎症瀑布反应中的核心信号流[3-4]。研究发现肺泡上皮细胞(alveolar epithelial cells,AECs)在肺损伤炎症瀑布反应中扮演启动细胞和继发受体的角色[5],探究肺损伤时AECs中信号转导的异常改变可以深入揭示肺损伤的发病机制。转化生长因子β1(transforming growth factor-β1,TGF-β1)是肺损伤时重要的炎症介质,结合之前研究发现TGF-β1可以活化AECs中的PI3K/Akt信号转导参与肺损伤炎症的起始和转归[6],本文拟探讨TGF-β1是否可以调控PI3K亚基的构成变化,以进一步认识TGF-β1调控PI3K信号转导的分子机制。根据蛋白结构和底物特性PI3K家族包括ClassⅠ、Ⅱ和Ⅲ3类,具体包括Ⅰ型催化亚基(PIK3CA、PIK-3CB、PIK3CD 和 PIK3CG)、Ⅰ型调节亚基(PIK3R1、PIK3R2、PIK3R3、PIK3R5 和 PIK3R6)、Ⅱ型 PI3K 亚基(PIK3C2A、PIK3C2B和 PIK3C2G)和Ⅲ型 PI3K亚基(PIK3R4和PIK3C3)[7]。因此,明确PI3K家族在AECs中的表达情况和探究TGF-β1调控PI3K亚基的构成变化,有助于寻找潜在的肺损伤预测分子标志物和诊治分子靶点。
1 材料和方法
1.1 实验细胞 人AECs A549细胞株购于中科院上海细胞库。
1.2 主要试剂 RPMI 1640培养基(规格:500ml,批号:8118021)、FBS(规格:500ml,批号:1739464)购自美国 Gibco 公司;人重组 TGF-β1(规格:5μg,批号:0212209)购自美国PeproTech公司;兔抗人PIK3CD单抗(规格:100μl,批号:34050S)购自美国 CST 公司;BCA蛋白浓度测定试剂盒(规格:2 500次,批号:RD231236)、预染蛋白 Marker(规格:250μl,批号:00557320)、ECL 发光液(规格:100ml,批号:QH220370A)购自美国 Thermo公司;Trizol(规格:100ml,批号:162912)购自美国Invitrogen公司;cDNA逆转录试剂盒(规格:200次,批号:AK2601)购自日本TAKARA公司;其他生化试剂购自生工生物工程(上海)股份有限公司。实时定量PCR引物由生工生物工程(上海)股份有限公司设计合成,见表1。

表1 实时定量PCR引物序列
1.3 实验方法
1.3.1 细胞培养 A549细胞株使用包含10%FBS和1%双抗的RPMI 1640培养基于37℃、5%CO2恒温培养箱中培养。
1.3.2 AECs中PI3K亚基mRNA表达水平检测 获取生长状态良好的A549细胞铺板,选取5ng/ml TGF-β1刺激 A549细胞,根据不同刺激时间(0、3、6、12、24和 48h)分组,收集各组细胞,按照Trizol说明书提取细胞总RNA,分光光度计法测定总RNA水平。取总RNA 2μg反转录为cDNA,再以适量cDNA为模板进行实时定量PCR法。实时定量PCR反应条件为 95℃ 30s、95℃ 5s、60℃ 30s,共 40个循环。结果以GAPDH为内参,对目的基因进行相对定量。
1.3.3 PIK3CD蛋白表达水平检测 采用Western blot法。提取各组细胞总蛋白,BCA法测定总蛋白水平。每组取30μg蛋白进行凝胶电泳,湿转至PVDF膜,5%脱脂牛奶室温下封闭 2h,抗 PIK3CD 抗体(1∶1 000)4℃孵育过夜,TBST缓冲液洗膜10min 3次,抗兔抗体(1∶5 000)室温孵育1.5h,再用TBST缓冲液洗膜10min 3次,ECL化学发光法显影。以β-actin为内参,结果以各蛋白与β-actin灰度值比值表示。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni校正的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 AECs中PI3K亚基mRNA表达水平 AECs中Ⅰ型PI3K催化亚基以表达PIK3CA、PIK3CB和PIK3CD为主,见图1。Ⅰ型PI3K调节亚基以表达PIK3R1、PIK3R2和PIK3R3为主,见图2。Ⅱ型PI3K亚基和Ⅲ型PI3K亚基以表达PIK3R4、PIK3C3、PIK3C2A和PIK3C2B为主,见图3。
2.2 TGF-β1诱导PI3K亚基mRNA表达水平的变化TGF-β1可以诱导PIK3CD亚基mRNA的表达水平呈时间依赖性升高,与0h比较,12、24和48h的PIK3CD mRNA表达水平均升高,差异均有有统计学意义(均P<0.05),其余PI3K亚基mRNA表达水平均无明显变化,见表2。根据PI3K亚基表达水平分析其在PI3K家族中的构成比,发现TGF-β1诱导的PIK3CD在Ⅰ型PI3K催化亚基的构成比呈时间依赖性升高,且在48h构成比最高。

图1 Ⅰ型PI3K催化亚基在AECs中的表达(PI3CG mRNA绝对表达量较低,图中未显示)
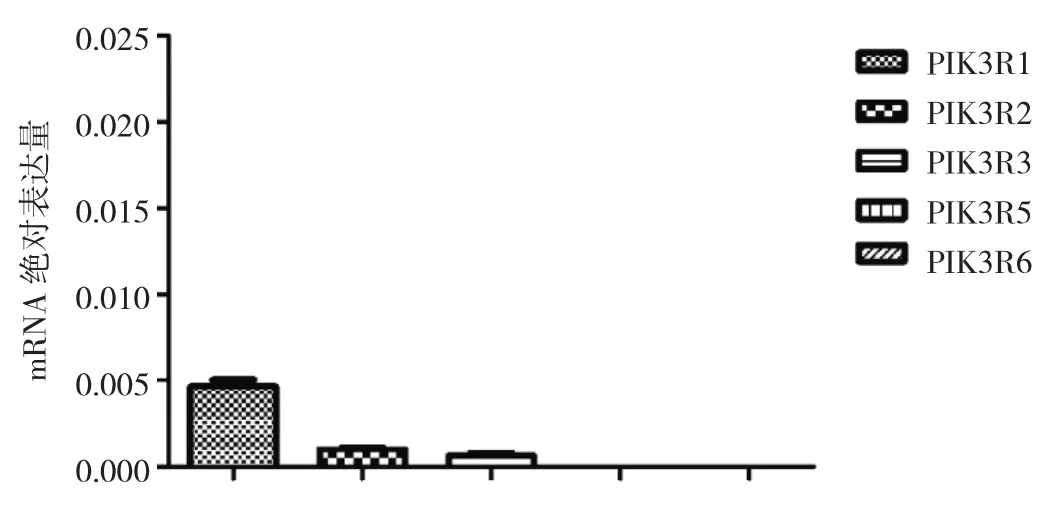
图2 Ⅰ型PI3K调节亚基在AECs中的表达(PIK3R5和PIK3R6 mRNA绝对表达量较低,图中未显示)

图3 Ⅱ型PI3K亚基和Ⅲ型PI3K亚基在AECs中的表达(PI3C2G mRNA绝对表达量较低,图中未显示)
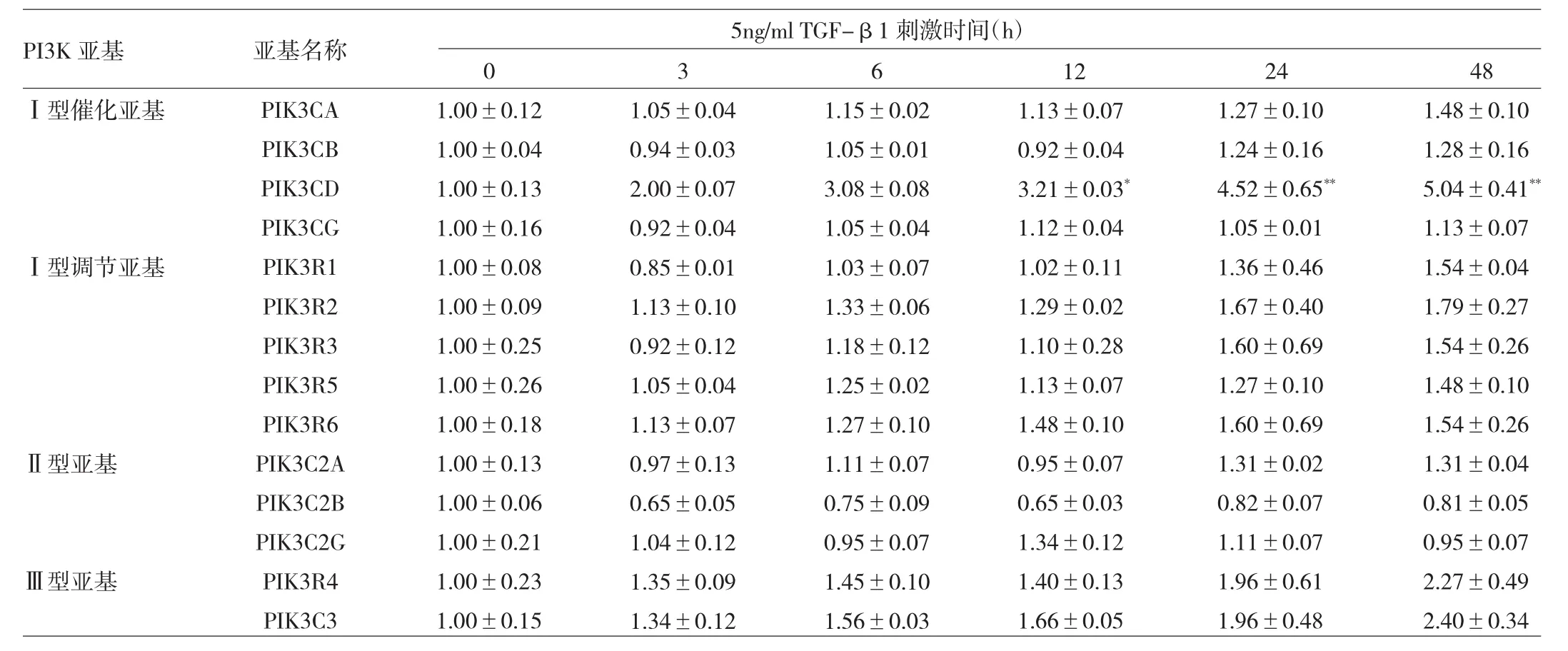
表2 TGF-β1诱导PI3K亚基mRNA动态变化
2.3 TGF-β1诱导 PIK3CD蛋白表达水平的变化TGF-β1可以诱导PIK3CD蛋白表达呈时间依赖性升高,48h 最高,见图 4。
3 讨论
PI3K是一类机体内广泛存在的特异性磷酸化磷脂酰肌醇激酶,其介导的PI3K/Akt信号转导与免疫炎症、损伤修复和恶性转化病理生理过程密切相关[8]。PI3K家族中14种PI3K亚基任一的基因位点突变或蛋白异常表达皆可以导致异常活化的PI3K/Akt参与不同疾病的发生、发展。既往关于PI3K在肺部疾病中的研究多集中在肿瘤方面,突变的PIK3CA是肺癌驱动基因之一[9],PIK3CA的突变导致PI3K/Akt信号转导的持续活化参与调控肿瘤的无限增殖和侵袭转移。近年来研究发现在肺损伤修复中同样存在持续活化的PI3K/Akt信号转导,其中肺泡上皮中持续活化的PI3K/Akt信号转导与炎性介质分泌、上皮间质转换和胞外基质分泌等密切相关[10-11]。考虑到PI3K亚基在肺损伤炎症起始转归中的重要角色,因此本文拟探讨AECs中PI3K亚基的表达情况和TGF-β1是否可以调控PI3K亚基的构成变化,期望以PI3K作为突破点为肺损伤发生、发展揭示新分子机制。

图4 TGF-β1对PIK3CD蛋白表达的影响(a:TGF-β1诱导PIK3CD蛋白表达的电泳图;b:TGF-β1诱导PIK3CD蛋白表达水平升高;与 0h 比较,*P<0.05,**P<0.01)
针对AECs中PI3K亚基mRNA表达检测,本研究发现AECs中Ⅰ型PI3K催化亚基以表达PIK3CA、PIK3CB和PIK3CD为主,Ⅰ型PI3K调节亚基以表达PIK3R1、PIK3R2和PIK3R3为主,Ⅱ型PI3K亚基和Ⅲ型PI3K亚基以表达PIK3R4、PIK3C3、PIK3C2A和PIK3C2B为主。PI3K亚基包括催化和调节两个功能,协同发挥作用,参与PI3K信号转导的活化。已知TGF-β1是参与肺损伤修复重要的炎症介质,AECs的上皮间质转换、胞外基质分泌与TGF-β1活化的PI3K信号转导相关[12-13],本研究深入探讨了TGF-β1是否可以调控PI3K亚基的构成变化。针对TGF-β1是否调控AECs中PI3K亚基构成变化,本研究发现 TGF-β1可以调控 AECs中PIK3CD催化亚基的表达,呈时间依赖性扩大PIK3CD在ClassⅠ型调节亚基中的比例。生理情况下PIK3CD在淋巴细胞中表达较为丰富,PIK3CD的突变或异常表达与B淋巴细胞非霍奇金淋巴瘤的发生密切相关[14]。Ge等[15]报道相较于正常对照,慢性阻塞性肺疾病(COPD)患者气道平滑肌细胞(ASMs)存在PIK3CD的过高表达,过高表达PIK3CD与ASMs收缩蛋白的合成和炎症机制的释放相关。与此同时Mercado等[16]报道COPD患者血液单个核细胞中过高表达的PIK3CD与其糖皮质激素治疗的不敏感性密切相关。目前PIK3CD在肺部疾病发病中的作用处于起始阶段,PIK3CD经调控氧化应激、内质网应激和2型组蛋白去乙酰化酶等途径参与免疫调节、气道炎症和激素耐受等[11,17],与肺部疾病的发生、发展密切相关。本研究发现TGF-β1可以诱导AECs中PIK3CD的表达,然而过高表达PIK3CD与TGF-β1活化PI3K/Akt信号转导过程之间的联系亟待阐明。考虑到催化亚基是PI3K的效应器,其表达水平与PI3K信号转导的持续活化密切相关[18],肺泡上皮中过高表达的PIK3CD可能是一个潜在的肺损伤和纤维修复的药物干预靶点。
本研究在体外实验中探讨了TGF-β1调控AECs中PI3K亚基的构成变化,但存在些许不足:首先,选取的AECs是永生化的肿瘤细胞,虽然细胞模型具备认可度,但在原代细胞上验证结果可能更为可信;其次,尚未在体内实验中证实肺损伤修复中AECs PI3K亚基的构成变化,从而可以验证体外实验的结果。总之,本研究初步揭示TGF-β1调控AECs中PI3K亚基的构成变化,提示PIK3CD可能是未来肺损伤防治的潜在靶点,为今后PIK3CD在肺损伤中的作用研究打下了一定的基础。

