结晶样视网膜变性患者的基因突变检测
颜虹 陆勤康 王惠云
结晶样视网膜变性(Bietti’s crystalline dystrophy,BCD)是一组以常染色体隐性遗传为主要遗传方式的视网膜退行性疾病,其临床特征为视网膜后极部结晶样物质沉积,伴进行性视力下降及视野缩小[1]。虽然大多数患者在20岁左右时即可根据典型的视网膜结晶样物质沉积进行临床诊断,但多数情况下,早期患者往往因为视功能损害轻微而未予及时就诊,从而延误诊断,单一的临床诊断存在明显的滞后性。自2004年Li等[2]发现了CYP4V2基因的13个突变位点,证实CYP4V2基因为BCD的致病基因以来,CYP4V2基因的突变位点不断涌现[3-6],至今发现的突变位点已高达82个[5]。因此,针对患者个体的精准化定位变得极为重要,对临床表现为BCD症状的患者进行相关突变筛查,有利于加强BCD的诊断,并提供遗传咨询和产前诊断,实现优生优育。本研究对3个BCD家系进行CYP4V2基因的突变筛查,现报道如下。
1 对象和方法
1.1 对象 收集2017年6月至2018年2月就诊于宁波市鄞州人民医院眼科门诊并确诊为BCD的患者3例(即先证者)。从先证者出发,寻找并收集家系中其他成员纳入研究。共搜集BCD家系3个,患者及其家系成员合计 20例,其中男 9例,女 11例;年龄 3~73(35.8±19.2)岁。先证者均为男性。同时招募150名无血缘关系的健康志愿者作为健康对照组进行CYP4V2基因测序比对,其中男 89 人,女 61 人;年龄 22~62(38.8±11.7)岁。本研究遵守赫尔辛基宣言,经宁波市鄞州人民医院伦理委员会批准(2017KY616),参与本研究的个体均签署知情同意书。
1.2 临床检查 对3个BCD家系的家系成员进行详细的病史、家族史询问及全面的眼科检查并记录。临床检查包括裸眼视力(5m视力表购于上海跃进医用光学器械厂)、最佳矫正视力(BCVA)(日本拓普康DK-600综合验光仪)、裂隙灯下眼前节及眼底检查(重庆康华瑞明科技股份有限公司SLM-5E)、眼底照相(北京高视远望科技有限责任公司KOWA-nonmyda-DⅢ)、眼部光学相干断层成像技术(OCT)检查(德国海德堡Spectralis OCT+Multicolor)、视野检查(德国蔡司 HUMPHTRY 750i)、电生理检查(法国 METROVISION MonPack3)及眼底荧光造影检查(德国海德堡Spectralis HRA)。
1.3 外周血DNA的提取与扩增 采集所有家系成员及健康对照组外周血 5ml,EasyPure Blood Genomic DNA Ki(t北京全式金生物技术有限公司,规格:50rxns,批号:Lot#M10420)提取基因组DNA。通过PCR扩增目标 DNA 序列,50.0μl反应体系中,DNA 模板 1.0μl,上、下游引物各1.0μ(l10μM),2×EasyTaqCR SuperMix 25.0μl,超纯水 22.0μl。94℃预变性 5min,94℃变性 30s,50~65℃退火30s,72℃延伸1min,共35个循环,最后72℃延伸5min。CYP4V2基因11个外显子的上、下游引物见表1。操作步骤及流程严格按照宁波市鄞州人民医院实验中心生化实验室要求进行。

表1 CYP4V2基因11个外显子的上、下游引物[7]
1.4 基因检测 对经过PCR扩增的目标DNA序列产物进行直接测序,测序由上海桑尼生物科技有限公司完成,测序结果与Genbank、千人基因组计划中的野生型CYP4V2基因参考序列(GenBank:KR710969.1)进行对比分析,同时与150名健康志愿者的基因测序结果进行比对,确定突变位点。
2 结果
2.1 BCD患者的临床特征 3例先证者均为散发患者,家系图见图 1。家系 1(F1)及家系 3(F3)中的先证者(F1:Ⅱ:1和F3:Ⅱ:1)首发症状均为夜盲,分别发生在25和 34 岁,家系 2(F2)中的先证者(F2:Ⅱ:1)主诉“双眼视力下降10余年”。3例先证者BCVA差异较大,从0.2~1.0不等;眼前节均未见明显异常,眼底见不同程度的结晶样物质沉积,伴或不伴视网膜色素上皮(RPE)层萎缩及色素沉着;视野检查可见不同程度的视野缺损;3例先证者的临床表现见表2。先证者F1:Ⅱ:1的双眼眼底照相示:后极部大量散在黄白色结晶样物质沉积(图2,见插页);眼部OCT示:双眼神经上皮外丛状层信号紊乱,色/脉反射带反射信号薄,黄斑区及高反光物质堆积(图3);双眼视觉诱发电位示:双眼b波波峰未见明显延迟,但波峰下降;视网膜电图(ERG)示:暗视下b波波幅下降(左眼较重),明视下未见明显异常;双眼眼底荧光造影示:全视网膜见透见与遮蔽荧光相间,后级部中央低荧光,周边透见荧光(图4)。先证者F2:Ⅱ:1眼部OCT示:双眼黄斑区囊样水肿,双眼ERG示:暗视下b波振幅下降,OPS震荡电位轻度下降,明视下b波振幅轻度下降。患者因就诊时血压高(180/110mmHg),而未行眼底荧光造影。先证者F3:Ⅱ:1因自身原因未完成全部眼科检查。其余家系成员未见发病。

图1 BCD患者家系图(黑箭为先证者)

表2 3例先证者临床表现
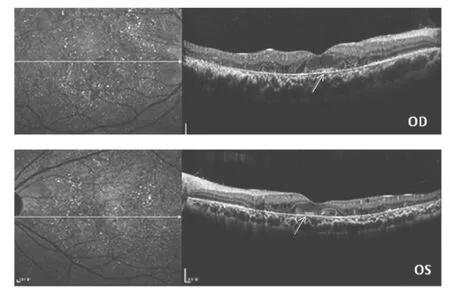
图3 先证者F1:Ⅱ:1双眼OCT图所见,箭头表示黄斑区及高反光物质堆积
2.2 基因检测结果 先证者F1:Ⅱ:1和F2:Ⅱ:1检测出c.802-8_810dell7insGC(Exon7del)突变,而 F1 和 F2 其他家系成员均未发现该突变。先证者F3:Ⅱ:1检测出c.219T>A(p.F73L)突变,F3其他家系成员中未见此突变。3个家系的所有成员均存在c.775C>A(p.Q259K)突变。在健康对照组中进行验证后发现150名健康志愿者均不存在 c.802-8_810dell7insGC(Exon7del)和 c.219T>A(p.F73L)突变,但有32名健康志愿者存在c.775C>A(p.Q259K)突变。基因测序结果见表3和图5-7。

图4 先证者F1:Ⅱ:1双眼眼底荧光造影图像(a:右眼早期荧光造影图像;b:右眼晚期荧光造影图像;c:左眼早期荧光造影图像;d:左眼晚期荧光造影图像)
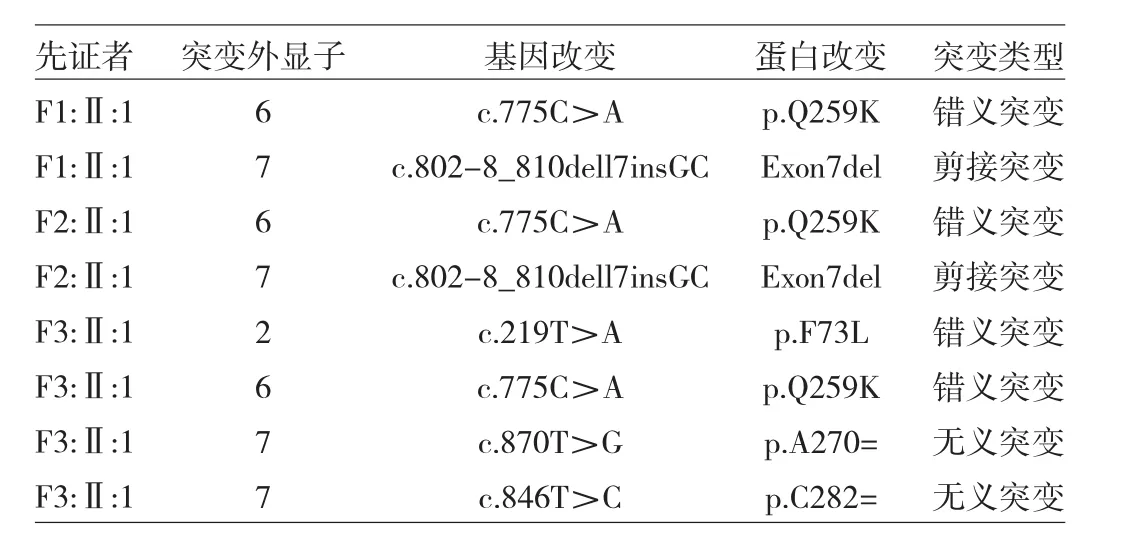
表3 3例先证者基因测序结果

图5 第7外显子DNA测序图(a:先证者F1:Ⅱ:1及先证者F2:Ⅱ:1 的 c.802-8_810dell7insGC 突变;b:除 F1:Ⅱ:1、F2:Ⅱ:1 外其余个体的基因测序结果)

图6 第2外显子DNA测序图[a:先证者F3:Ⅱ:1的c.219T>A(p.F73L)突变(黑箭);b:除F3:Ⅱ:1外其余个体的基因测序结果,相应位点不存在突变]
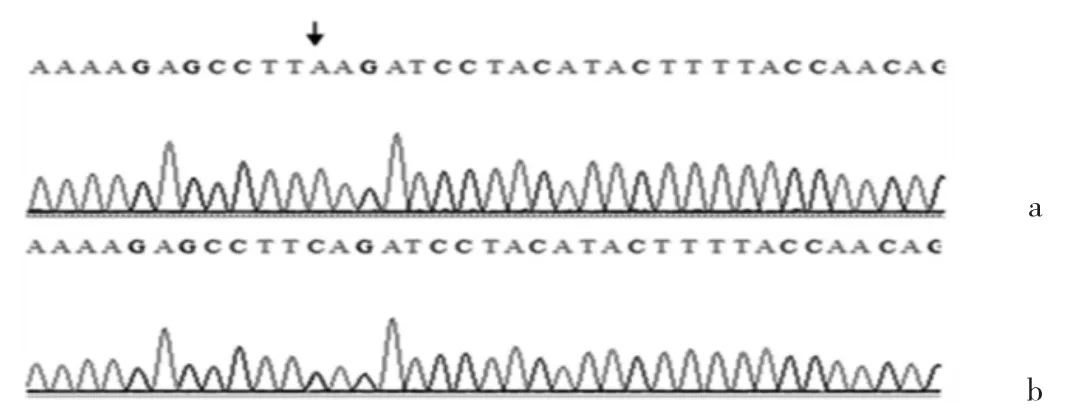
图7 第6外显子DNA测序图 ([a:3例先证者及其家系成员和32名健康志愿者基因测序图,其上存在c.775C>A(p.Q259K)突变(黑箭);b:健康对照组中剩余健康志愿者基因测序图,其上未发现相应突变]
3 讨论
早在2000年时,就有研究发现BCD的发病与细胞色素氧化酶 P450(CYP450)相关[8],随后,人们找到了BCD的致病基因——CYP4V2基因[2]。该基因编码蛋白CYP4V2,属于CYP450超家族。CYP450主要参与内源性及部分外源性物质的代谢[9],而CYP450超家族中的CYP1-4蛋白被普遍认为是多不饱和脂肪酸ω-3及ω-6氧化反应的催化剂[10],推测BCD的发病与脂质代谢异常相关。最新一项研究显示降低细胞内的游离胆固醇可能是BCD的一种有效疗法[11],但CYP4V2基因所主导的生化途径尚未被阐明。BCD具有高度遗传异质性,至今已发现的BCD致病突变位点达82个,遍布全部11个外显子区域[5]。因此,针对个体的基因筛查以明确病变基因,对于BCD患者的诊断、治疗及遗传咨询等有重要意义。
本文研究的3个BCD家系,先证者均具有明显的BCD表现:首发症状为夜盲或视力下降,眼底存在典型的结晶样物质沉积,伴有不同程度的RPE萎缩。笔者通过基因检测发现了几个突变位点(c.775C>A、c.802-8_810dell7insGC、c.219T>A、c.870T>G、c.846T>C),其中两个为同义突变(c.870T>G、c.846T>C)不造成蛋白质改变。对于F1及F2,笔者通过基因筛查,找到了c.802-8_810dell7insGC突变。经国内外多项研究证实,这是东亚人群中最为常见的突变方式[12-13],该突变引起的临床表现多样,国内外多项研究针对CYP4V2基因进行了一系列基因型-表型研究[14-19],但未得出明确的结论。有研究指出,相较于其他突变,CYP4V2基因中存在c.802-8_810dell7insGC突变的BCD患者的临床表现较为严重[15],而拥有复合杂合突变c.802-8_810dell7insGC的临床表现又较纯合突变严重,可合并黄斑水肿、脉络膜新生血管、黄斑裂孔等[6,14,18]。但也有研究指出 BCD患者的基因型-表型无明确关联,Meng等[16]首次对中国BCD人群进行大样本的人口特征及基因型-表型研究,发现两者之间表现出高度变异性,但并不存在明确的基因型-表型关联,提示环境因素在BCD进展中的重要作用。
F3中发现的c.219T>A(p.F73L)突变最早报道于2014年,Yin等[6]在17例BCD患者的34对等位基因中检出7个该突变。因为此突变在正常个体中未被发现,73号位的苯丙氨酸又是一个高度保守序列,再加上存在该变异的BCD患者未发现其他致病突变,故Yin等[6]认为c.219T>A(p.F73L)为BCD的致病突变。之后Meng等[16]对92个BCD家系进行研究发现该突变的频率为3/184,Tian等[3]的研究检测到突变频率为1/10,以上均表明c.219T>A(p.F73L)突变可能为BCD的致病突变。F3中先证者F3:Ⅱ:1检测出c.219T>A(p.F73L)突变,而其他家系成员及150名健康对照志愿者中均未发现该突变,且在先证者F3:Ⅱ:1中未发现其他已明确报道的致病突变,由此推测c.219T>A(p.F73L)突变可能为F3的致病突变。
此外,3个BCD家系的所有成员均检测出c.775C>A(p.Q259K)突变。2013年Rossi等[20]检测了15例BCD患者的CYP4V2基因,发现2例c.775A>C(p.K259Q)突变,他们判断此为良性突变。2017年Jiao等[5]在58例BCD患者中发现4例c.775A>C(p.K259Q)突变,并判断它可能不是BCD的致病突变。而笔者将测序结果与Genbank、千人基因组计划中的野生型CYP4V2基因参考序列(GenBank:KR710969.1)进行对比分析后发现c.775C>A(p.Q259K)突变,且该突变不只存在于3例先证者身上,同样存在于其他家系成员及32名健康志愿者中。故c.775C>A(p.Q259K)突变可能不是BCD的致病突变,不具备相应的临床意义,但先前报道的c.775A>C(p.K259Q)突变的准确性有待进一步验证。

