甘草黄酮拮抗高糖诱导的视网膜色素上皮细胞损伤及分子机制
王 鹤,厉新新,孙晓会,吴红男,冯卓蕾,刘丽娟
甘草黄酮(licorice flavonoids),具有抗氧化、抑制炎症反应、降血脂、抗肿瘤等作用[1]。有研究显示,甘草黄酮能够预防大鼠实验性糖尿病的发生,其作用机制与提高超氧化物歧化酶表达有关[2]。糖尿病的发生与患者的长期氧化应激状态有关,视网膜色素上皮(retina pigment epithelium,RPE)细胞正常代谢环境改变导致抗氧化能力降低,影响了视网膜的正常代谢,导致糖尿病患者视力下降[3]。鉴于甘草黄酮具有较强的抗氧化性功能,本文拟通过采用体外高糖条件下培养RPE细胞,研究甘草黄酮对高糖诱导的RPE细胞氧化损伤的保护作用及机制。
1 材料与方法
1.1 材料
RPE细胞(美国 ATCC公司),甘草黄酮(美国Sigma公司,纯度>99%),二甲基亚砜(北京索莱宝科技有限公司),胎牛血清、DMEM培养基干粉 (美国GIBCO公司),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 [3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]试剂盒(江苏凯基生物技术股份有限公司),2',7'-二氯二氢荧光素二乙酸酯 (2',7'-Dichlorodi hydrofluorescein diacetate,H2DCFDA)荧光探针(美国 BD 公司),Caspase-3及Caspase-9抗体(上海碧云天公司)。
1.2 方法
1.2.1 RPE细胞的培养 RPE细胞常规培养于10%胎牛血清的DMEM培养基内,每3 d传代1次,取对数期(此时期细胞都处于生长分裂旺盛时期,其细胞大小处于较稳定的情况)生长的细胞进行实验,培养箱内温度为37℃,CO2体积分数为5%。
1.2.2 RPE细胞分组 共分4组,每组5个复孔:(1)对照组 以正常培养液(葡萄糖浓度为5.5 mmol/L)培养细胞36 h。(2)高糖组 以葡萄糖浓度为40 mmol/L的培养液培养细胞36 h。(3)甘草黄酮低浓度组 10-9mol/L的甘草黄酮培养细胞24h后,更换为葡萄糖浓度为40 mmol/L的培养液继续作用12 h。(4)甘草黄酮高浓度组 10-8mol/L的甘草黄酮培养细胞24 h后,更换为葡萄糖浓度为40 mmol/L的培养液继续作用12 h。
1.2.3 MTT法测定细胞增殖 MTT法是一种检测细胞存活率的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能[4]。 RPE 细胞培养于 96孔板内,每孔 200 μl,细胞密度为 1×104个/L,各孔加入 10 μl MTT(5 g/L),置于细胞培养箱内4 h,去除上清液,加入100 μl DMSO溶液,低速振荡10 min后在酶联免疫检测仪上测定各孔570 nm的吸光度值(OD)。
1.2.4 流式细胞技术检测RPE细胞内活性氧表达RPE细胞培养于6孔板中,每孔500 μl,细胞密度为1×105个/L, 磷酸缓冲液 (phosphate buffer solution,PBS)冲洗 3 遍,离心(1000 r/min)后收集细胞,黑暗中在室温下加入5 μl H2DCFDA染料,15 min后流式细胞仪检测并分析细胞内活性氧 (reactive oxygen species,ROS)表达量变化。
1.2.5 ROS含量变化的形态学观察 RPE细胞经上述方法处理后,加入10 μm/L的氧敏感荧光探针H2DCFDA,黑暗中在室温下孵育20 min,荧光显微镜下拍照。
1.2.6 细胞凋亡的形态学观察 采用Hoechst染色法定量观察细胞凋亡情况,按照试剂盒说明更换细胞培养液,并用PBS冲洗3遍,在150 μL的Binding Buffer中分别加入 Hoechst试剂 5 μl及 PI试剂 2 μl混匀,室温避光反应5 min,荧光显微镜下观查并拍照,统计分析凋亡细胞比例。
1.2.7 凋亡因子相关蛋白检测 收集细胞,置于冰浴上,胰蛋白酶消化后提取蛋白质并行10%SDS-PAGE凝胶电泳,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照进行免疫印迹分析,检测细胞内Caspase-3及Caspase-9蛋白表达水平。
1.3 统计学处理
采用SPSS17.0进行统计学处理,结果采用均数±标准差(s)表示,采用成组 t检验及单因素方差分析(One-way ANOVA))法进行分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 甘草黄酮浓度依赖性的提高RPE细胞活力
40 mmol/L葡萄糖溶液处理后,高糖组RPE细胞存活率下降到40.45%±3.27%,与对照组(98.336%±2.98%)比较差异具有统计学意义(P<0.05)。用10-9mol/L、10-8mol/L甘草黄酮处理后,RPE细胞存活率逐渐提高,分别为64.76%±3.23%和78.67%±2.57%,与高糖组(40.45%±3.27%)比较差异具有统计学意义(P<0.05,表 1)。
2.2 RPE细胞内ROS改变
H2DCFDA荧光探针标记法是一种检测细胞内ROS生成量变化的检查方法,细胞氧化损伤程度越重,主峰越向右侧偏移[5]。流式细胞技术结果显示,对照组细胞内ROS表达均较低,ROS主峰位于基线左侧,高糖组DCF荧光信号明显增强,ROS主峰位于基线右侧,不同浓度甘草黄酮干预后,荧光信号强度逐渐减弱,ROS主峰向基线左侧移位(图1)。
表1 MTT法检测甘草黄酮对高糖诱导的RPE细胞存活率的影响(s)
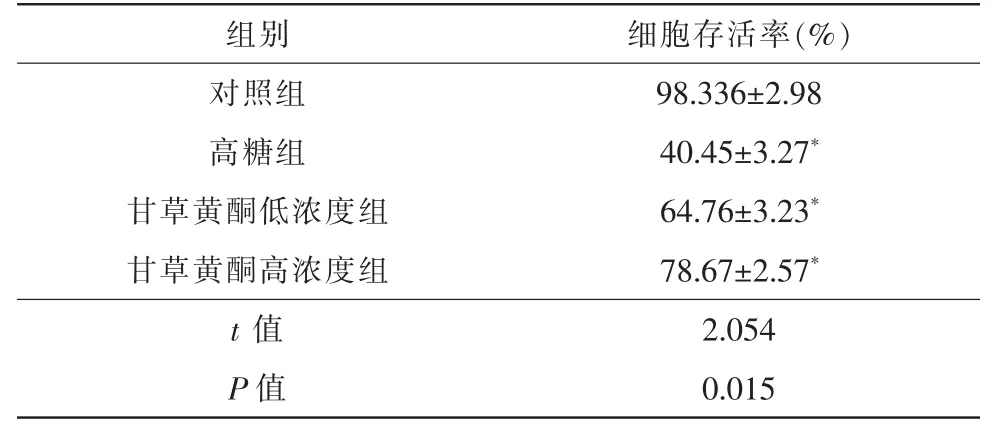
表1 MTT法检测甘草黄酮对高糖诱导的RPE细胞存活率的影响(s)
注:*与对照组比较P<0.05。
?
2.3 荧光显微镜观察细胞内ROS改变
荧光显微镜下,未发生氧化损伤的细胞核呈暗绿色低荧光,当氧化压力刺激时,ROS攻击细胞膜及细胞器,细胞核染色后呈亮绿色高荧光[6]。本研究结果显示,对照组细胞核表现为均一低荧光(图2A);高糖组出现明显增多的绿色高荧光,提示细胞发生氧化损伤(图2B);甘草黄酮处理后绿色高荧光细胞核数量逐渐减少,提示氧化损伤细胞随之减少 (图2C、2D),说明甘草黄酮能够计量依赖性的抑制RPE细胞发生氧化损伤。
2.4 甘草黄酮对RPE细胞凋亡的影响
荧光显微镜下,对照组背景荧光暗黑色,可见数个散在凋亡细胞核(暗蓝色低荧光,图3A),细胞凋亡率为(1.67±0.98)%;高糖组细胞核着色不均匀,凋亡细胞呈亮蓝色高荧光 (图3B),细胞凋亡率为(67.33±4.44)%,与对照组比较差异具有统计学意义(P<0.01)。 10-9mol/L、10-8mol/L 甘草黄酮处理后凋亡细胞数量逐渐减少(图3C、3D),细胞凋亡率分别为(48.67±3.90)%、(36.33±3.85)%,与高糖组比较差异具有统计学意义(P<0.01)。
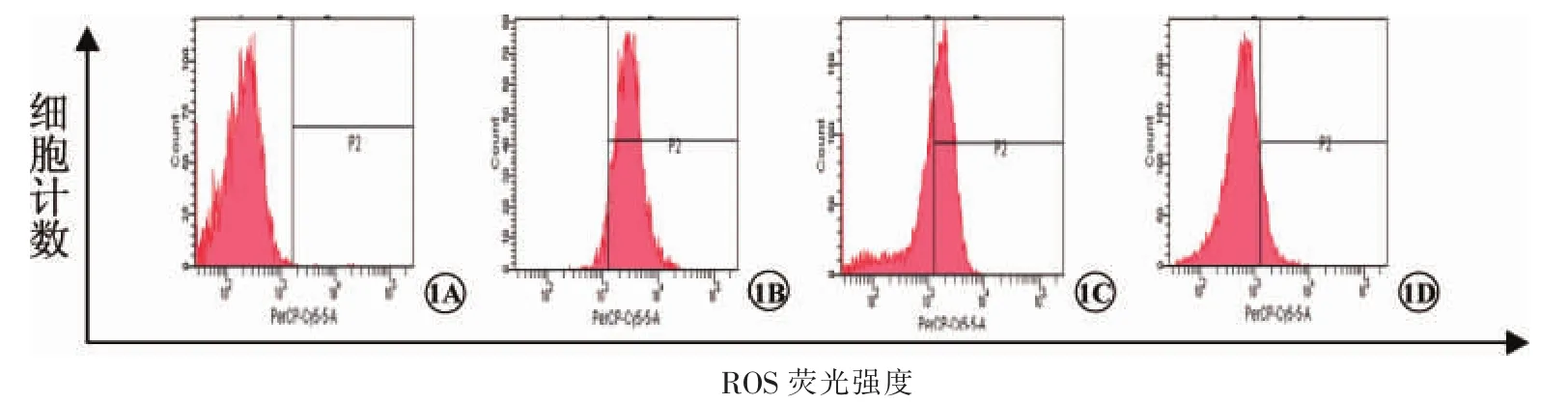
图1 流式细胞技术检测RPE细胞内ROS改变 横坐标是ROS荧光强度;纵坐标是细胞计数。1A为对照组,ROS主峰位于基线左侧;1B为高糖组,ROS主峰位于基线右侧;1C为甘草黄酮低浓度组,ROS主峰向基线左侧移位;1D甘草黄酮高浓度组,ROS主峰向基线左侧移位。
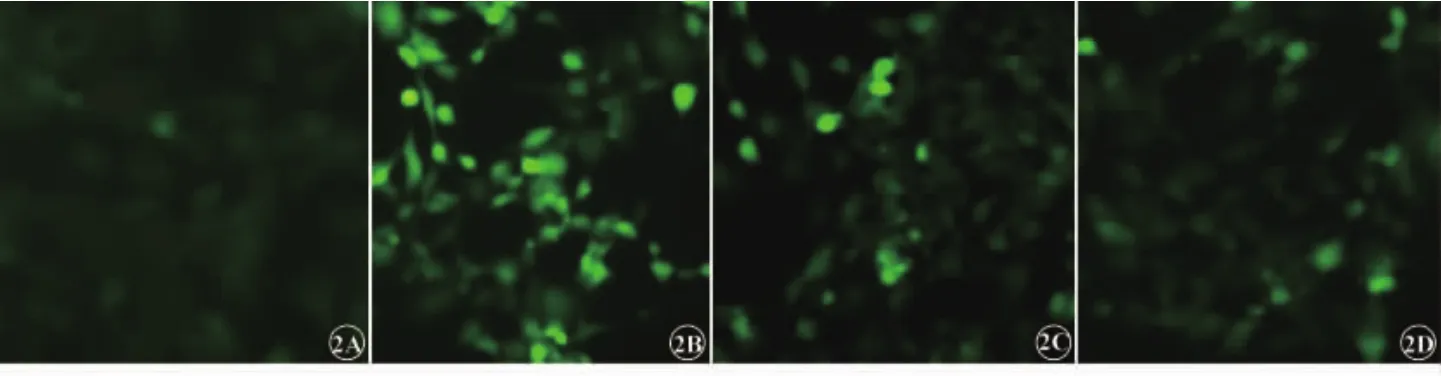
图2 荧光显微镜观察细胞内ROS改变 2A为对照组;2B为高糖组;2C为甘草黄酮低浓度组;2D为甘草黄酮高浓度组
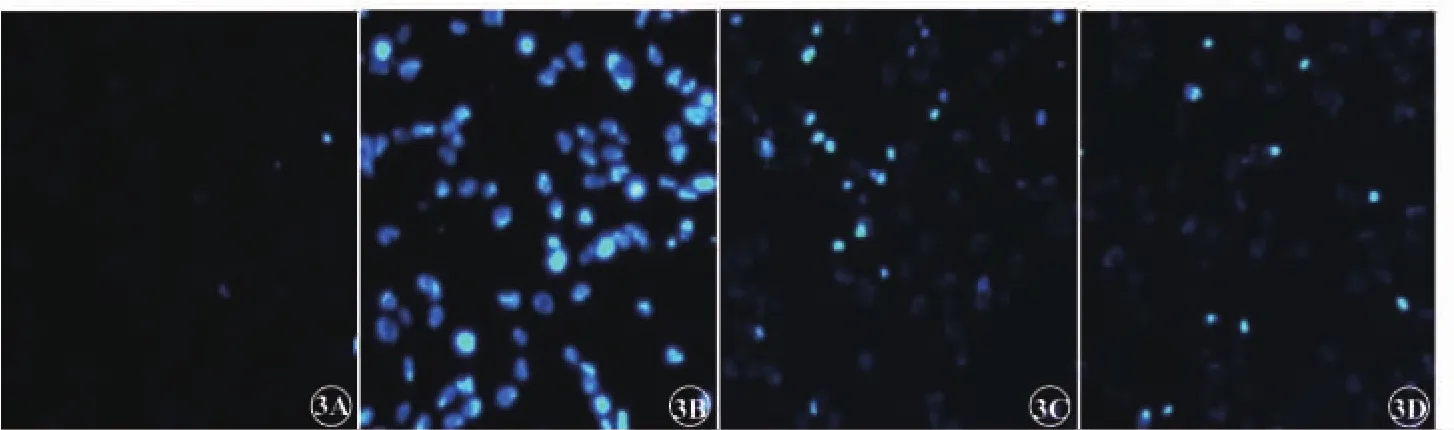
图3 甘草黄酮对高糖诱导RPE细胞凋亡影响。3A为对照组;3B为高糖组;3C为甘草黄酮低浓度组;3D为甘草黄酮高浓度组
2.5 Caspase-3及caspase-9蛋白表达水平检测
RPE细胞经高糖处理后,凋亡蛋白Caspase-3及Caspase-9的表达均明显上调 (相对表达量分别为250.84%±8.90%及270.03%±5.90%),与对照组(相对表达量为105.71%±5.99%)比较差异极具有统计学意义 (P<0.01),甘草黄酮剂量依赖性的抑制Caspase-3及Caspase-9的表达,相对表达量分别下降到(162.70±6.44)%、(132.39±4.56)%和(224.85±5.44)%、(169.57±6.31)%,与高糖组比较差异均具有统计学意义(P<0.05)(图 4)。
表2 各组RPE细胞凋亡率比较(
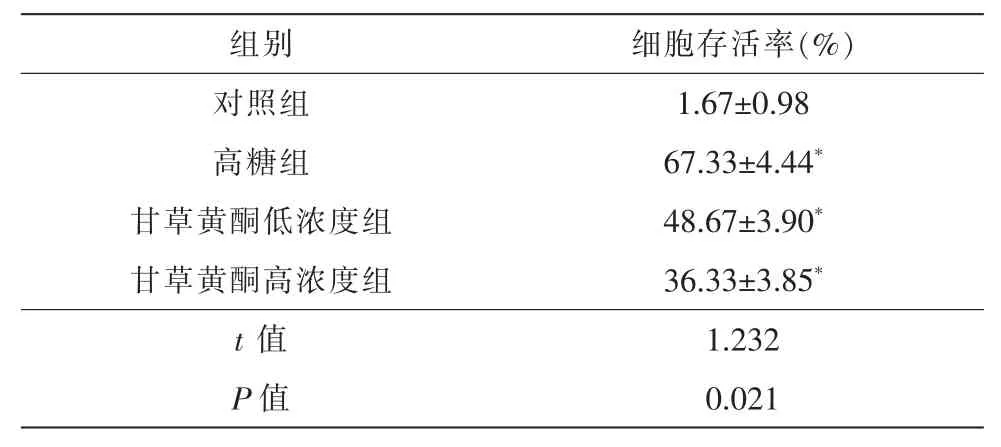
表2 各组RPE细胞凋亡率比较(
注:*与对照组比较P<0.05。
?
表3 各组Caspase-3及Caspase-9蛋白相对表达比较(
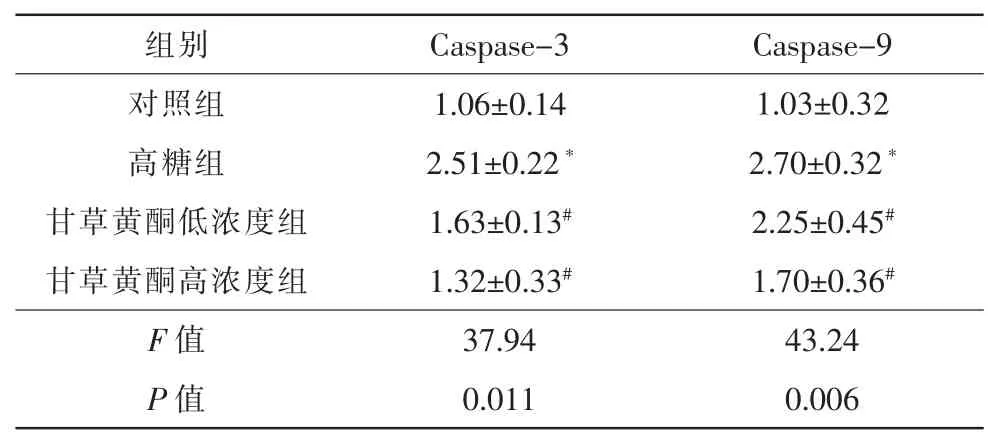
表3 各组Caspase-3及Caspase-9蛋白相对表达比较(
注:以GAPDH为内参。单因素方差分析,两两比较采用LSD法。* 与对照组比较,P<0.05; # 与高糖组比较,P<0.05。
?
3 讨论
RPE细胞对氧化应激损伤敏感,而且一旦死亡便不能再生,因此,其结构与功能完整对维持视网膜正常功能至关重要[7]。为了研究视网膜病变的发生机理并探索出更多的治疗性药物,国内外学者尝试了大量方法诱导RPE细胞凋亡,例如:高糖、H2O2、紫外线辐射、激素、化学药物等[8-10]。本实验使用40 mmol/L浓度的葡萄糖建立了RPE细胞高糖氧化应激模型,观查甘草黄酮对RPE细胞的保护作用。结果显示,40 mmol/L浓度的葡萄糖引起RPE细胞活力降低,给予10-9mol/L、10-8mol/L甘草黄酮作用后,细胞活力增加。
当机体的抗氧化防御屏障功能被破坏时,会产生大量的ROS,ROS的生成与中和失衡,对RPE细胞造成不可逆损伤[7]。过量生成的ROS可直接或间接通过损伤线粒体DNA导致线粒体呼吸链功能受损,进一步促使ROS释放,最终形成恶性循环并加速细胞凋亡[10]。H2DCFDA荧光探针是一种检测细胞氧化应激状态的染色方法,本实验中,我们分别采用流式细胞技术及荧光显微镜观察高糖对RPE细胞的氧化损伤程度。2种观察结果结论一致:高糖刺激下RPE细胞氧化损伤明显,甘草黄酮可以剂量依赖性的抑制高糖诱导的RPE细胞氧化应激损伤。
高糖刺激RPE细胞后产生的大量氧化代谢产物堆积引起细胞毒性损伤,大量自由基通过线粒体损伤引起RPE细凋亡[11-13]。实验中,Hoechst染色显示,高糖组中凋亡的RPE细胞数量明显升高,Western blot结果显示,高糖组细胞中Caspase-3及Caspase-9蛋白的表达均明显增加,提示高糖诱导了RPE细胞凋亡,甘草黄酮通过降低Caspase-3及Caspase-9的表达发挥抗细胞凋亡作用。
综上所述,甘草黄酮能够有效抑制高糖诱导的RPE细胞凋亡,抑制效应与浓度呈正相关。本研究为预防和治疗糖尿病性视网膜病变提供了新的干预措施。

图4 甘草黄酮对RPE细胞内Caspase-3及Caspase-9表达的影响

